羅格列酮對異育銀鯽血清生化指標和糖代謝的影響
武漢工業學院動物營養與飼料科學湖北省重點實驗室 楊 玲 侯永清* 丁斌鷹
魚類對碳水化合物的利用率較低(Wilson和Poe,1987)。但糖是最廉價的飼料能源,在魚飼料中添加適量水平的碳水化合物能起到節約成本,減少飼料蛋白質作為能源被消耗的作用(Erfanullah 和 Jerri,1998;Kaushik 等,1989)。 大量研究表明,魚類胰島素受體可能偏少,影響了胰島素的降血糖作用 (Ablett等,1983)。羅格列酮(rosiglitazone,RSG)屬于噻唑烷二酮類,是一種口服降血糖藥,能顯著增強靶組織對胰島素的敏感性,具有抗胰島素抵抗的作用,長期應用有保護胰腺β細胞功能的作用 (Lebovitz等,2001)。目前,在小鼠上的研究表明,羅格列酮能有效降低小鼠餐后血糖及空腹血糖,有效調節糖代謝(Stum和Haring,2002)。但關于羅格列酮對魚類糖代謝調控的研究鮮見報道。因此,本試驗旨在通過在異育銀鯽基礎純合日糧中添加不同水平的羅格列酮,研究其對異育銀鯽血液生化指標和糖代謝的影響,以期為魚類飼料中糖類物質的合理應用提供試驗依據。
1 材料與方法
1.1 試驗設計 試驗飼料為精制飼料,以酪蛋白為蛋白源,以糊精為糖源,基礎日糧配方及營養水平見表1。在基礎日糧中分別添加0(對照組)、10(試驗Ⅰ組)、15 mg/kg(試驗Ⅱ組)和 20 mg/kg(試驗Ⅲ組)羅格列酮,制成本試驗所需的4種試驗日糧。各種飼料原料分別過60目篩,按照逐級放大的原則充分混勻,再加入油、水,用小型絞肉機制成粒徑為2.0 mm的濕飼料,在40℃下烘干,用小型粉碎機粉碎,過10目篩,制得顆粒飼料,于4℃下保存。
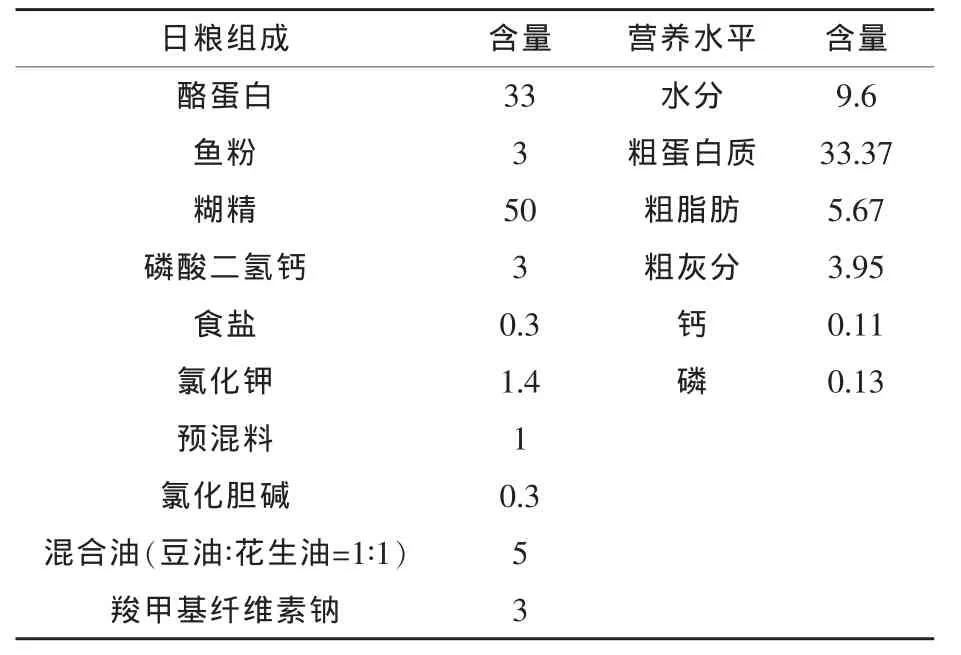
表1 基礎日糧組成及營養水平 %
1.2 試驗魚種 異育銀鯽 (Carassius auratus gibelio)(方正銀鯽♀×興國紅鯉♂)購于武漢市東西湖漁場。用3%氯化鈉溶液浸泡魚種15 min后放入120 cm×120 cm×150 cm水泥池馴養。馴養30 d后,選擇健康、規格和體重基本一致的魚種480 尾,初體重為(5.30±0.38)g,隨機分到 16 個100 cm×60 cm×60 cm水族箱中,每個水族箱放養30尾魚。將16個水族箱隨機分為對照組、試驗Ⅰ組、試驗Ⅱ組、試驗Ⅲ組,每個組4個重復(箱)。
1.3 飼養管理 以魚體重量的2%~4%投喂日糧,每天9∶00和15∶00各投喂一次并測定水溫,早晚各吸一次糞,定期消毒、換水,24 h充氣增氧,每周測一次水質。整個試驗期間水質指標為:水溫(26.4±4.56)℃,pH 為 7.0~7.5, 溶氧在 5 mg/L 左右,氨氮小于0.05 mg/L。試驗期為30 d。
1.4 樣品的采集 試驗結束,斷食24 h后,從每個水族箱隨機取10尾魚,用一次性注射器尾靜脈采血,在4℃下靜置2 h,然后在3000 r/min離心10 min,吸取上清液制備血清,放于-80℃保存備用。采完血后解剖取肝胰臟及背肌肉,于液氮速凍后-80℃保存待測。
1.5 測定指標與方法
1.5.1 飼料常規檢測 將飼料用超微粉碎機粉碎,過60目。采用恒溫干燥法(105℃)、凱氏定氮法、索氏抽提法和灼燒法(550℃)分別測定飼料的水分、粗蛋白質、粗脂肪和粗灰分含量。用高錳酸鉀法和磷釩鉬酸比色法分別測定飼料中的鈣和磷含量。
1.5.2 血液生化指標 取出冷凍保存的血清,采用日立7020全自動生化分析儀測定,試劑盒均由浙江伊利康生物技術有限公司生產,測定指標包括:總蛋白(TP)、白蛋白(ALB)、球蛋白(GLO)、谷丙轉氨酶(GPT)、谷草轉氨酶(GOT)、乳酸脫氫酶(LDH)、甘油三酯(TG)以及血糖。
1.5.3 糖代謝指標 取出冷凍保存的肝胰臟和背肌,用化學比色法測定肝糖原和肌糖原含量,丙酮酸激酶采用化學比色法測定,試劑盒均由南京建成生物工程研究所提供,胰島素采用放射免疫法測定,試劑盒由北京華英生物技術研究所提供。
1.6 數據統計與分析 試驗數據在SPSS13.0單因素方差分析(ONE-WAY ANOVA)的基礎上,采用Duncan’s進行多重比較,顯著水平設在P=0.05,試驗結果均以“平均值±標準差”表示。
2 結果與分析
2.1 羅格列酮對異育銀鯽血液生化指標的影響由表2可知,隨著羅格列酮添加量的增加,血清中的GPT和GOT活性逐漸提高,試驗Ⅱ組和Ⅲ組血清中GPT活性較對照組分別提高54.89%和71.06%(P<0.05)。Ⅲ組血清中的GOT活性顯著高于對照組(P<0.05),達27.77%,其他各組間差異不顯著(P>0.05)。Ⅲ組血清中的LDH較對照組高33.33%,差異顯著(P<0.05),其他各組間差異不顯著。與對照組相比,試驗Ⅰ組、Ⅱ組和Ⅲ組血清中的TP顯著提高(P<0.05),分別較對照組提高了5.89%、6.51%和9.21%。各個處理組間血清中的ALB、GLO和TG均差異不顯著(P> 0.05)。
2.2 羅格列酮對異育銀鯽糖代謝的影響 由表3可知,添加3種劑量的羅格列酮均能顯著降低異育銀鯽血清中的血糖濃度(P<0.05),與對照組相比,Ⅰ組、Ⅱ組和Ⅲ組血清中的血糖濃度分別降低10.50%、16.97%和21.26%,不同水平羅格列酮組間差異均不顯著(P>0.05)。與對照組相比,Ⅰ組、Ⅱ組和Ⅲ組血清中的胰島素含量顯著降低(P<0.05),分別較對照組降低10.90%、13.59%和15.54%,不同水平羅格列酮組間差異不顯著。與對照組相比,Ⅰ組、Ⅱ組和Ⅲ組肌糖原含量顯著提高 (P<0.05),分別較對照組提高 14.90%、19.17%和22.19%。各個處理組間丙酮酸激酶活性和肝糖原的含量差異均不顯著(P>0.05)。
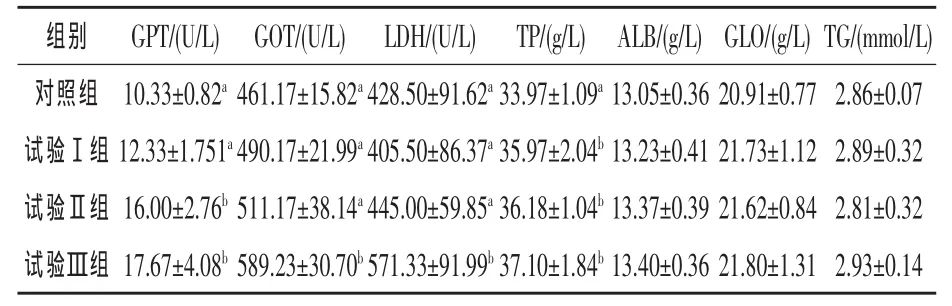
表2 羅格列酮對異域銀鯽血清生化指標的影響
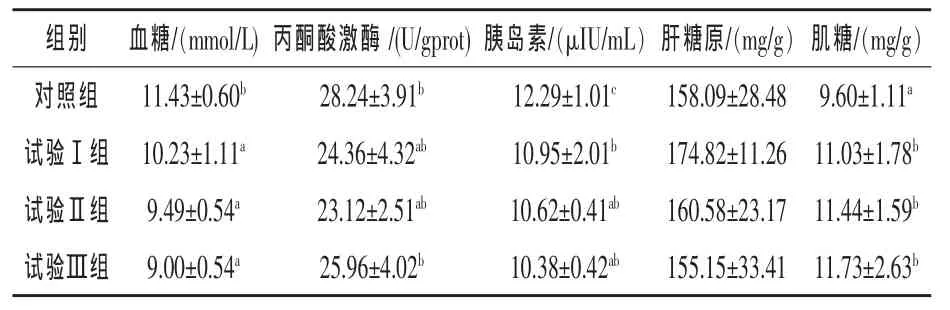
表3 羅格列酮對異育銀鯽糖代謝的影響
3 討論
3.1 羅格列酮對異育銀鯽血清生化指標的影響血清生化指標的改變是組織細胞通透性發生改變和機體新陳代謝機能發生改變的反映(褚武英等,2008)。添加15 mg/kg羅格列酮使異育銀鯽血清GPT活性顯著升高,添加20 mg/kg羅格列酮血清GPT和GOT活性都顯著升高,表明添加15 mg/kg羅格列酮時肝損傷較輕僅限細胞膜的通透性增加,細胞漿內的GPT釋放入血,添加20 mg/kg羅格列酮時肝細胞受損嚴重,線粒體里的GOT釋放入血(Berent等,2001)。這與報道過的高劑量的羅格列酮能使人肝功能失調的報道一致 (Freid等,2000;A1-Salman 等 ,2000;Ravinuthala Nori,2000;Hachey等,2000)。 添加 20 mg/kg羅格列酮時異育銀鯽血清中LDH活性顯著升高,說明在此添加量時異育銀鯽心、肝、肺等組織器官受損。LDH從組織或細胞中逸出進入血中,使血清LDH及其相應組織的LDH同工酶活性增高 (張劍等,2006)。 這與 Freed等(2000)報道一致。
血清TP和ALB是反映動物營養狀況的指標之一,良好的營養狀況可使血清蛋白維持在較高的水平(Levy等,1989)。本試驗3個添加水平的羅格列酮均能顯著提高異育銀鯽血清中TP含量,但各處理組間差異不顯著。這說明該添加水平的羅格列酮均能起到促進蛋白質合成的作用。
3.2 羅格列酮對異育銀鯽糖代謝指標的影響羅格列酮是一種高選擇性PPARγ的激動劑,羅格列酮與PPAR的γ異構體結合,激活該受體,增強胰島素對肝生糖作用的抑制,增強肌細胞對葡萄糖的攝取,同時提高胰島β細胞功能(Lebovitz,2001;Lehmann 等,1995)。動物試驗發現羅格列酮呈劑量依賴性降低空腹血糖和胰島素水平(Stum和Haring等,2002)。羅格列酮不是直接刺激胰島素的分泌,而是通過增強機體對胰島素的敏感性達到降低血糖的效果。因此,在胰島素缺乏的糖尿病動物中并未發現明顯的降血糖作用。本試驗結果表明,異育銀鯽中不缺乏胰島素,3個添加水平的羅格列酮均能顯著的降低異育銀鯽血糖的濃度和胰島素水平,增加異育銀鯽肝糖原的含量,且隨著羅格列酮劑量的增加,血糖濃度和胰島素水平隨之降低。表明羅格列酮能有效的控制異育銀鯽血糖濃度和胰島素水平,增強肌細胞對葡萄糖的攝取。
4 結論
本試驗3個添加水平的羅格列酮均能降低異育銀鯽血糖濃度和胰島素水平和提高肌糖原的含量,起到調節異育銀鯽糖代謝的作用,但是添加15 mg/kg和20 mg/kg的羅格列酮對異育銀鯽肝胰臟均會造成一定的損傷,因此,在本試驗條件下羅格列酮適宜添加水平為10 mg/kg。
[1]褚武英,吳信,成嘉,等.低聚木糖對草魚生長性能及血液生化指標的影晌[J].水生動物營養,2008,6:60~64.
[2]張劍,王京華,劉娟,等.常見血液病患者乳酸脫氫酶測定的臨床意義[J].哈爾濱醫科大學學報,2006,40(6):504~508.
[3]A1-Salman J,Arjomand H,Kemp D G,et al.HepatoceIlular injury in a patient receiving rosiglitazone.A case report[J].Ann Intern Med,2000,132(2):121.
[4]Ablett R R,Taylor M J,Selivonchick D P.The effect of high-protein and high-carbohydr ate diets on iodoinsulin binding in skeletal muscle plasma membranes and isolated hemocytes of rainbow trout (Salmo gairdneri)[J].Br J Nutr,1983,50:129~140.
[5]Berent D,Schmidt H,Wahli T,et al.Effluent from a sewage treatment works causes changes in serum chemistry of brown trout (Salmo trutta L)[J].Ecotox Environ Safe,2001,48(2):140~147.
[6]Erfanullah,Jerri A K.Effect of dietary carbohydrate-to-lipid ration on growth and body composition of walking catfish (Clarias batrachus)[J].Aquaculture,1998,161:l59~l68.
[7]Freed M,Fuell D,Menci L,et al.Effect of combination therapy with rosiglitazone and glibenclamide on PAI-1 antigen,PAI-1 activity,and tPA in patients with type 2 diabetes[J].Diabetologia,2000,43(suppl 1):A 1024.
[8]Freid J,Everitt D,Boscia J.Rosiglitazone and hepatic failure[J].Ann Intern Med,2000,132(18):164.
[9]Hachey D M,O’Nell M P,Force R W.Isolated elevation of alkaline phosphatase level associated with rosiglitazone[J].Ann Intern Med,2000,133(9):752.
[10]Kaushik S J,Luquet P,Blanc D,et al.Studies on the nutrition of Siberian sturgeon,Acipenser baeri.I.Utilization of digestible carbohydrate by sturgeon[J].Aquaculture,1989,76:97~l00.
[11]Lebovitz H E,Dole J F,Patwardhan R,et al.Rosiglitazon monotherapy is effective in patients with type 2 diabetes[J].J Clin Endocrinol Metab,2001,86(1):280.
[12]Lehmann J M,Moore L B,Smith-Oliver T A,et al.An antidiabetic thiazolidinedione is a high affinity ligand for peroxisome proliferator-activated receptor gamma (PPAR gamma)[J].Biology Chemistry,1995,270(22):12953~12956.
[13]Levy A,Perelman B,Waner T.Reference blood chemical values ostrich[J].American Journal of veterinary research struthio camelus,1989,50(91):1548~1550.
[14]Ravinuthala R S,Nori U.Rosiglitazone toxicity[J].Ann Intern Med,2000,133(8):658.
[15]Stum V M,HaringH U.Glitazoneclinicaleffectand molecular mechanisms[J].Ann Med,2002,34:217~22.
[16]Wilson R P,Poe W E.Apparent inability of channel catfish to utilize dietary mono-and disaccharides as energy source[J].Nutrition,1987,117:280~285.

