腫瘤免疫治療的現狀與展望
任 軍
(首都醫科大學附屬北京世紀壇醫院腫瘤內科)
近年來,惡性腫瘤的發病率逐年提高。盡管科學家們一直在探索以各種方式來攻克腫瘤,但臨床上對腫瘤的治愈率仍未顯示出明顯的提高。隨著腫瘤學、免疫學以及分子生物學等相關學科的迅速發展和交叉滲透,腫瘤免疫治療的研究突飛猛進。腫瘤免疫治療大約始于100年前,Coley W B等[1-2]發現應用鏈球菌和金黃色葡萄球菌毒素能夠控制某些癌癥的生長,后來將這種毒素稱為Coley毒素。1922年科學家[3]證實卡介苗可以刺激免疫反應,從而用來治療膀胱癌。機體免疫功能的改變可以直接影響腫瘤的表現,臨床上存在著某些腫瘤自發緩解或消退的現象[4-5]。另外,長期免疫治療可抑制患者的腫瘤發病率增高等[6]。20世紀80年代后期,隨著體外細胞培養技術的成熟應用,淋巴因子誘導的殺傷細胞(lymphokine activated killer cells,LAK)和腫瘤浸潤淋巴細胞(tumor infiltrating lymphocyte,TIL)等,迅速在臨床得以應用,結合化學治療及放射治療手段,明顯改善了臨床腫瘤患者的療效。
進入21世紀,醫學科學不斷進步,新型的細胞免疫治療技術得到迅速發展,為全世界成千上萬腫瘤患者帶來新的希望。2010年4月29日,美國食品藥品管理局(food and drug administration,FDA)批準了樹突狀細胞治療晚期前列腺癌,這一歷史性的突破使得這項經歷15年的漫長臨床研究、耗費了60億美金的治療技術進入到臨床應用階段[7]。該療法治療激素治療失敗的晚期前列腺癌的Ⅲ期臨床試驗顯示,512名患者中位生存期為25.8個月,對照組患者中位生存時間僅為21.7個月,Provenge治療患者3年存活率為32%,而對照組僅為23%[7]。
2011年10月3日美國洛克菲勒大學教授Ralph M.Steinman因“發現樹突狀細胞及其在獲得性免疫中的作用”獎得諾貝爾生理學或醫學獎[8]。免疫治療成為繼手術、放射治療和化學治療之后又一種重要的抗腫瘤治療手段,成為攻克惡性腫瘤的希望。美國FDA近期已批準了若干個免疫治療項目進入臨床研究,相信在未來5-10年內將不斷有抗腫瘤特異性免疫治療產品問世(表1)[9]。目前樹突狀細胞免疫治療已經廣泛進入臨床應用,治療乳腺癌、肺癌、消化道腫瘤、前列腺癌、腎癌和惡性黑色素瘤等的臨床研究超過200項[10]。其中乳腺癌23項,肺癌18項,結直腸癌16項。DC細胞免疫治療應用范圍廣泛,無明顯不良反應,安全性良好。目前美國國立衛生院及國立癌癥研究院(national institutes of health/national cancer institute,NIH/NCI)組織全美具有國際腫瘤免疫治療水平的27家腫瘤中心,成立腫瘤免疫治療協作中心(cancer immunotherapy trials network)。政府將花大力氣投入腫瘤免疫治療,以期腫瘤免疫治療技術盡快服務于患者。
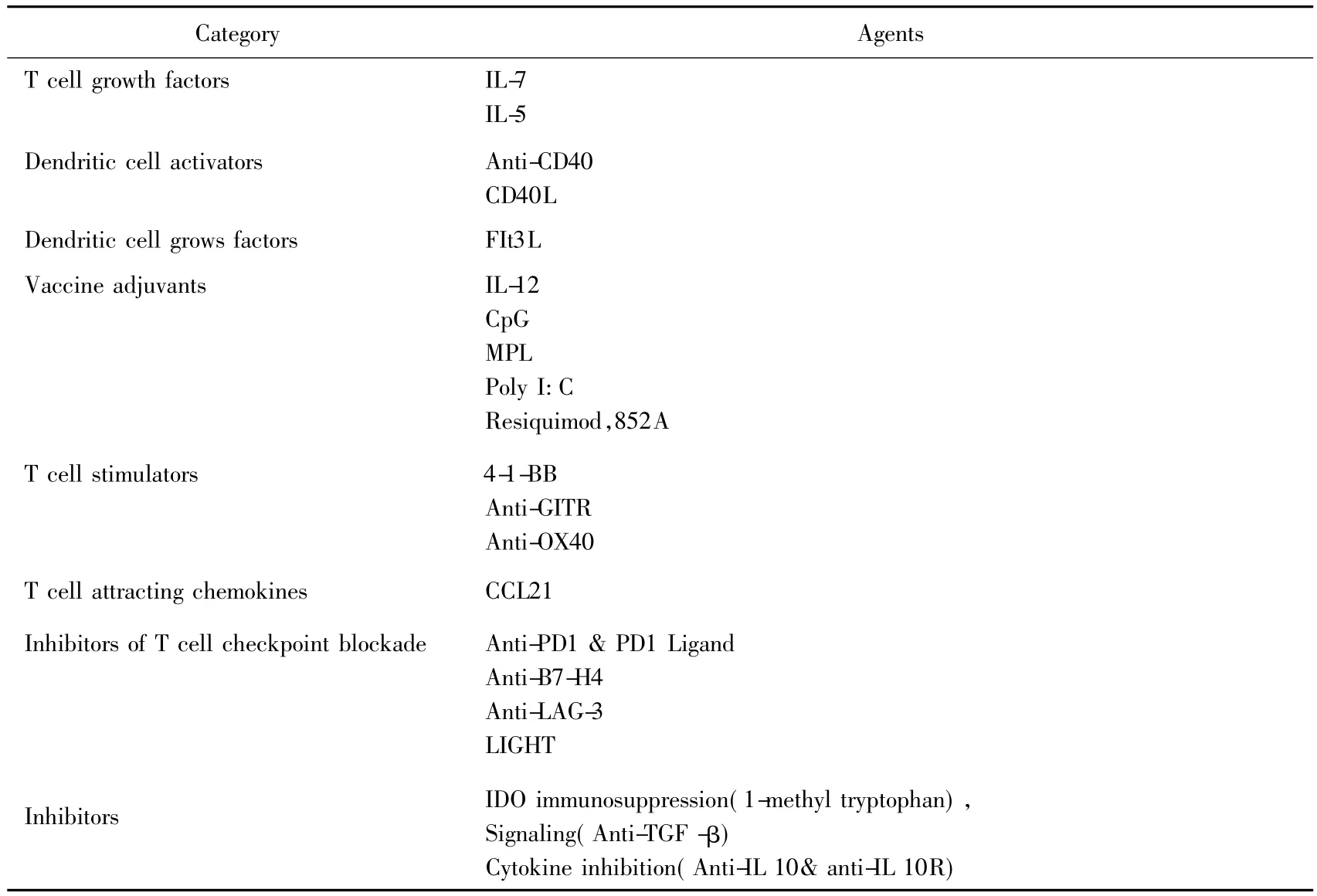
表1 美國NIH/NCI在研腫瘤特異性免疫治療項目[9]Tab.1 Tumor-specific immunotherapy research projects in NIH/NCI of USA
1 腫瘤免疫治療的分類
腫瘤免疫治療通常分為兩類,非特異性免疫和特異性免疫。非特異性免疫治療主要包括白細胞介素-2(interleukin-2,IL-2),干擾素 α(interferonα,IFN-α),腫瘤壞死因子(tumor necrosis factor,TNF-α),卡介苗等細胞因子和毒素,過繼性細胞免疫治療等。特異性免疫治療主要是腫瘤疫苗。
1.1 腫瘤非特異性免疫治療
非特異性免疫應答是與生俱來的,它的形成并不需要抗原刺激,能廣泛地針對多種抗原,是免疫應答的基礎,但特異性不強,對某種特定抗原物質往往不能產生足夠強度的反應非特異性的免疫治療。在進入臨床試驗的多種細胞因子中,白細胞介素-2和干擾素應用最為廣泛[11,12]。
1.2 腫瘤單克隆抗體的免疫治療
近20多年來單克隆抗體已在腫瘤治療領域得到廣泛應用。抗腫瘤單抗藥物一般包括兩類:一是抗腫瘤單抗,二是抗腫瘤單抗偶聯物,或稱免疫偶聯物。免疫偶聯物分子由單抗與“彈頭”藥物兩部分組成,“彈頭”主要包括放射性核素、藥物和毒素,與單抗連接后分別構成放射免疫偶聯物、化學免疫偶聯物和免疫毒素。在1997年11月和1998年10月美國FDA分別通過了用于臨床腫瘤治療的兩個單抗—Rituximab(rituxan)和 Trastuzumab(herceptin)[13-14],引起臨床腫瘤學界的極大興趣和關注,目前單克隆抗體已在肺癌、乳腺癌、結直腸癌、淋巴瘤、頭頸部腫瘤等得到廣泛應用[15]。
在抗體對于免疫功能調節作用的研究中,細胞毒性T淋巴細胞相關抗原4(cytotoxic T lymphocyte-associated antigen 4,CTLA-4)不斷得到人們的重視,它是一個參與T細胞免疫反應激活或抑制的重要分子。CTLA-4在和T細胞上表達,包括FOXP3+調節性T細胞[16]。目前已經研發了兩個完全人源化抗體 Tremelimumab 和 Ipilimumab[17-18]。Ipilimumab治療轉移性黑色素瘤組患者3年總生存率為20%以上,對照疫苗組約10%。基于以上結果,FDA批準其用于晚期黑色素瘤患者的治療。CTLA4-抗體的成功引發了人們對于CD28/B7通路免疫控制點的進一步研究,如程序性細胞死亡蛋白1(programmed cell death protein 1,PD1,也被稱為PDCD1),細胞程序性死亡配體1(PDL1;也被稱為CD274),具有B和T淋巴細胞衰減作用的CD276(又稱為B7H3)和含V-結構域的T細胞活化抑制劑1(也稱為B7x)[19]。尤其應用PD1抗體進行阻滯,同樣取得了良好的效果。近年正在積極研究中的抗體治療是雙特異性抗體,如將抗腫瘤的單抗與抗免疫效應細胞表面的抗體結合起來,可增加免疫效應細胞的激活或對腫瘤細胞的殺傷。
1.3 腫瘤的過繼免疫治療
腫瘤的過繼免疫治療是指將體外激活的自體或異體免疫效應細胞輸注給患者,以殺傷患者體內的腫瘤細胞。腫瘤過繼性免疫治療中的一個關鍵問題是尋找合適的腫瘤殺傷細胞。自上世紀80年代以來,包括LAK、細胞因誘導的殺傷細胞(cytokine-induced killers,CIK)、TIL等細胞已先后應用于臨床,但由于存在著擴增倍速較低、細胞來源困難、細胞毒力不高等諸多問題,在臨床應用上受到限制。如何提高T細胞的腫瘤抗原特異性具有重要的臨床意義。T細胞對腫瘤抗原的識別主要是通過T細胞受體(T cell receptor,TCR)識別腫瘤細胞表面的人類白細胞抗原(human leukocyte antigen,HLA)-肽復合物,因此,T細胞對腫瘤抗原識別的特異性取決于T細胞表 面的TCR。利用分子生物學的手段克隆腫瘤特異性T細胞的TCR,并通過構建含TCR的病毒載體,把TCR轉入正常的T細胞中,使這些T細胞因攜帶腫瘤特異性而成為特異性腫瘤殺傷細胞[20]。此外,靶抗原的選擇是至關重要的,選擇僅限于腫瘤表達的抗原,如腫瘤/睪丸抗原 1(cancer/testis antigen 1,又稱 NYESO-1),可以避免全身的風險[21]。
1.4 腫瘤疫苗治療
腫瘤疫苗治療是通過給患者體內導入腫瘤抗原來激發患者的特異性抗腫瘤免疫反應。由于疫苗治療具有特異性、在體內免疫效應維持時間長等優點,目前已成為研究熱點。近年來多肽疫苗、核酸疫苗、全蛋白疫苗、抗獨特性抗體疫苗、重組病毒疫苗、細菌疫苗、基因修飾的腫瘤細胞疫苗、樹突狀細胞(dendritic cells,DC)疫苗等得到廣泛研究和應用[21]。近年來以DC為基礎的腫瘤免疫基因治療顯示出良好的應用前景[22]。
本人帶領的課題組開展重組人腺相關病毒(adeno-association virus,AAV)感染DC基因免疫治療(簡稱AAV-DC基因免疫治療),應用該技術獲得的DC可刺激產生具有強大殺傷腫瘤細胞的細胞毒性T淋巴細胞(cytotoxic T-lymphocyte,CTL),對攜帶靶抗原(如carcino-embryonic antigen,CEA;human epidermal growth factor receptor-2,HER-2等)的腫瘤細胞產生強大的殺傷作用。基礎研究[23]顯示,攜帶CEA基因AAV轉染DC誘導產生的抗原特異性CTL細胞可殺傷表達CEA的MCF-7乳腺癌細胞,且對/low乳腺癌干細胞的殺傷率高于未轉染CEA基因的對照組。提示基因免疫治療可能是治療乳腺癌干細胞潛在有效的手段,值得進一步深入研究。另一項體外研究[24]顯示,攜帶HER-2基因的AAV轉染DC可顯著殺傷曲妥珠單抗耐藥的(MDA-MB-453)和曲妥珠單抗敏感的(SK-BR-3)HER-2陽性乳腺癌細胞系,可為DC腫瘤疫苗治療HER-2陽性乳腺癌提供理論基礎。另外,DC疫苗的抗腫瘤作用優勢在臨床中也得到的證實,臨床研究[25]顯示,負載 CEA抗原的AAV-DC治療高表達CEA的惡性腫瘤(包括胃腸癌、乳腺癌、肺癌等)效果較好,臨床獲益率達到60%以上,無明顯不良反應,安全性良好。
2 免疫治療的臨床評價
免疫反應的客觀評價是推動免疫治療發展的重要因素之一,特別是尋找某些能夠衡量臨床療效和免疫反應關聯指標[26]。國外目前采用酶聯免疫斑點法(enzyme linked immunospot assay,ELISPOT)、主要組織相容性復合物四聚體檢測、細胞因子檢測等方法,期望建立公認的標準[27]。然而,利用免疫反應作為臨床試驗的終點仍然有其局限性,且更多的研究重點應瞄準器官和組織的免疫效應[28]。世界衛生組織(world health organization,WHO)和實體瘤的療效評價標準(response evaluation criteria in solid tumors,RECIST)是通過腫瘤的大小及是否出現新病灶來評價細胞毒性藥物的療效。然而,目前有充足的證據表明,這些標準并不完全適用于免疫治療[28]。免疫治療引發的腫瘤縮小多半發生在腫瘤一過性增大后,甚至是在出現新病灶后,其原因可能是腫瘤體內伴有淋巴細胞浸潤。例如,在一些患者接受Ipilimumab治療后,腫瘤負荷的下降出現在“腫瘤進展”或有新發病灶[29]。
這些結果反映出免疫治療與細胞毒藥物具有不同的作用機制,也引發了免疫治療相關評價標準的討論,目的在于避免有效病例因初期腫瘤的進展而停止治療。制定標準對于免疫治療臨床試驗的設計、實施和中期分析均具有重要意義[30]。
3 免疫治療與化學治療聯合
研究證實,化學治療引起的細胞死亡可觸發機體的免疫反應。例如,蒽環類藥物可引起鈣網蛋白被轉運到腫瘤細胞表面,從而增強樹突狀細胞吞噬腫瘤細胞的能力[31]。蒽環類或奧沙利鉑引起高遷移家族蛋白 B1(high mobility group protein B1,HMGB1)和三磷酸腺苷(adenosine triphosphate,ATP)的釋放,導致TOLL樣受體4(Toll-like receptor 4,TLR4)和 NLRP3炎性反應上調[32-33]。這些數據表明,化學治療藥物有利于抗腫瘤免疫反應,甚至化學治療的臨床療效取決于其引發的免疫反應。化學治療不影響T細胞的誘導和活化[34]。因此,臨床上如何將化學治療和免疫治療更好地有機結合是今后腫瘤治療的發展方向。本課題組開展了DC-CIK與化學治療聯合治療轉移性乳腺癌的臨床試驗,共計入組患者200余例,與單純化學治療相比,DC-CIK聯合化學治療能顯著延長PFS(10.2月 vs 5.1月,P<0.001)和OS(33.1月 vs 19.4月,P=0.001)。且DC-CIK治療不良反應小,無明顯劑量限制性毒性。
另外,“化學+免疫”治療模式并不局限于全身治療,免疫治療也可通過局部注射用于惡性漿膜腔積液的治療。惡性漿膜腔積液主要包括惡性胸腔積液,惡性細胞積液和惡性腹腔積液,通常病情發展迅速,嚴重影響患者的生活質量。本課題組采用局部注射DC-CIK的方法治療難治性惡性漿膜腔積液收到了良好的效果,有效率54%(14/26),獲益率(CR+PR+SD)81%,有效及穩定患者的中位緩解時間為20周(4~45周),治療中無嚴重不良反應發生。
腫瘤免疫治療的臨床應用取得了矚目的成果,免疫治療已成為腫瘤臨床治療的熱點。但我國目前臨床免疫治療的水平仍然落后于國外,具體表現在:①治療規模幾乎均在實驗室層面,沒有國際認證的臨床細胞培養機構;②細胞制備和處理缺乏標準操作程序,各個中心差異較大等。
前景:需要在中國建立符合國際標準的臨床腫瘤免疫治療中心,引進國際標準的細胞培養和處理操作流程,開展國家多中心免疫治療臨床試驗,建立統一標準的評價體系,培養專業化的人才梯隊,為中國腫瘤臨床免疫治療的國際化、專業化發展奠定基礎。
[1]Coley W B.The treatment of malignant tumors by repeated inoculations of erysipelas:With a report of ten original cases[J].Am J Med Sci,1893,105:487.
[2]Wiemann B,Starnes Co.Coley's toxins,tumor necrosis factor and cancer research:A historical perspective[J].Pharmacol Ther,1994,64:529.
[3]Frances H B,George A F,Helen C N.A review of the influence of bacterial infection and of bacterial products(Coley’s toxins)on malignant tumors in man,a critical analysis of 30 inoperable cases treated by Coley’s mixed toxins,in which diagnosis was confirmed by microscopic examination selected for special study[J].Acta Med Scand,1953,144:S1-S103.
[4]Sumner W C,Foraker A G.Spontaneous regression of human melanoma:Clinical and experimental studies[J].Cancer,1960,13:79.
[5]Cole W H.Relationship of causative factors in spontaneous regression of cancer to immunologic factors possibly effective in cancer[J].J Surg Oncol,1976,8:391-411.
[6]Emens L A.Chemoimmunotherapy[J].Cancer J,2010,16(4):295-303.
[7]Hammerstrom A E,Cauley D H,Atkinson B J,et al.Cancer immunotherapy:sipuleucel-T and beyond[J].Pharmacotherapy,2011,31(8):813-828.
[8]張婷,王曉民.揭示免疫應答的關鍵環節——2011年諾貝爾生理學成醫學關系簡介[J].首都醫科大學學報,2011,32(5):710-713.
[9]NCI Immunotherapy Agent Workshop(2007):Cancer Immunotherapy Trials Network[EB/OL].[2012-09-12].http://citninfo.org/research/rationale.html workshop_1.
[10]The U.S.National Institutes of Health.DC Vaccine[EB/OL].[2012-09-18].http://clinicaltrials.
[11]Rosenberg S A,Lotze M T,Muul L M,et al.A progress report on the treatment of 157 patients with advanced cancer using lymphokine-activated killer cells and interleukin-2 or high-dose interleukin-2 alone[J].N Engl J Med,1987,316(15):889-897.
[12]West W H,Tauer K W,Yannelli J R,et al.Constant-infusion recombinant interleukin-2 in adoptive immunotherapy of advanced cancer[J].N Engl J Med,1987,316(15):898-905.
[13]Dillman R O.Magic bullets at last!Finally—approval of a monoclonal antibody for the treatment of cancer[J].Cancer Biother Radiopharm,1997,12:223-225.
[14]Dillman R O.Perceptions of Herceptin:A monoclonal antibody for the treatment of breast cancer[J].Cancer Biother Radiopharm,1999,14:5-10.
[15]Oldham R K,Dillman R O.Monoclonal antibodies in cancer therapy:25 years of progress[J].J Clin Oncol,2008,26(11):1774-1777.
[16]Peggs K S,Quezada S A,Chambers C A,et al.Blockade of CTLA-4 on both effector and regulatory T cell compartments contributes to the antitumor activity of anti-CTLA-4 antibodies[J].J Exp Med,2009,206(8):1717-1725.
[17]Ribas A,Camacho L H,Lopez-Berestein G,et al.Antitumor activity in melanoma and anti-self responses in a Phase I trial with the anti-cytotoxic T lymphocyte-associated antigen 4 monoclonal antibody CP-675,206[J].J Clin Oncol,2005,23(35):8968-8977.
[18]Weber J S,O'Day S,Urba W,et al.PhaseⅠ/Ⅱ study of ipilimumab for patients with metastatic melanoma[J].J Clin Oncol,2008,26(36):5950-5956.
[19]Zou W,Chen L.Inhibitory B7-family molecules in the tumour microenvironment[J].Nat Rev Immunol,2008,8(6):467-477.
[20]Johnson L A,Morgan R A,Dudley M E,et al.Gene therapy with human and mouse T-cell receptors mediates cancer regression and targets normal tissues expressing cognate antigen[J].Blood,2009,114(3):535-546.
[21]Robbins P F,Morgan R A,Feldman S A,et al.Tumor regression in patients with metastatic synovial cell sarcoma and melanoma using genetically engineered lymphocytes reactive with NY-ESO-1[J].J Clin Oncol,2011,29(7):917-924.
[22]Steinman R M.Dendritic cells in vivo:a key target for a new vaccine science[J].Immunity,2008,29(3):319-324.
[23]王小利,馬博,賈軍,等.rAAV/CEA轉染樹突狀細胞誘導特異性CTL殺傷MCF-7細胞系/low乳腺癌干細胞[J].北京大學學報:醫學版,2011,43(2):173-178.
[24]Lin X L,Wang X L,Ma B,et al.HER2-specific T lymphocytes kill both trastuzumab-resistant and trastuzumabsensitive breast cell lines in vitro[J].Chin J Cancer Res,2012,24(2):143-150.
[25]Di L J,Zhu Y L,Jia J,et al.Clinical safety of induced CTL transfusion through recombinant adeno-associated virus transfected dendritic cells vaccination in Chinese cancer patients[J].Clin Translational Oncology,2012,14(9):675-681.
[26]Wolchok J D,Hoos A,O'Day S,et al.Guidelines for the evaluation of immune therapy activity in solid tumors:immune-related response criteria[J].Clin Cancer Res,2009,15(23):7412-7420.
[27]Janetzki S,Britten C M,Kalos M,et al.“MIATA”-minimal information about T cell assays[J].Immunity,2009,31(4):527-528.
[28]Lurquin C,Lethé B,De Plaen E,et al.Contrasting frequencies of antitumor and anti-vaccine T cells in metastases of a melanoma patient vaccinated with a MAGE tumor antigen[J].J Exp Med,2005,201(2):249-257.
[29]Weber J.Ipilimumab:controversies in its development,utility and autoimmune adverse events[J].Cancer Immunol,2009,58(5):823-830.
[30]Hoos A,Eggermont A M,Janetzki S,et al.Improved endpoints for cancer immunotherapy trials[J].J Natl Cancer Inst,2010,102(18):1388-1397.
[31]Obeid M,Tesniere A,Ghiringhelli F,et al.Calreticulin exposure dictates the immunogenicity of cancer cell death[J].Nat Med,2007,13(1):54-61.
[32]Apetoh L,Ghiringhelli F,Tesniere A,et al.Toll-like receptor 4-dependent contribution of the immune system to anticancer chemotherapy and radiotherapy[J].Nat Med,2007,13(9):1050-1059.
[33]Ghiringhelli F,Apetoh L,Tesniere A,et al.Activation of the NLRP3 inflammasome in dendritic cells induces IL-1βdependent adaptive immunity against tumors[J].Nat Med,2009,15(10):1170-1178.
[34]Lesterhuis W J,de Vries I J,Aarntzen E A,et al.A pilot study on the immunogenicity of dendritic cell vaccination during adjuvant oxaliplatin/capecitabine chemotherapy in colon cancer patients[J].Br J Cancer,2010,103(9):1415-1421.

