氧化損傷在HIV相關神經認知損害中的作用
丁 渭 張玉林 喬錄新 宋鳳麗 徐樹瑩 陳德喜
(北京市肝病研究所,首都醫科大學附屬北京佑安醫院,北京100069)
對感染人類免疫缺陷病毒(human immunodeficiency virus,HIV-1)的患者的腦組織進行尸檢可以發現在中樞神經系統存在神經細胞和非神經細胞的凋亡,尤其在HIV相關性癡呆。盡管神經相關癡呆的發病頻率非常高,而最嚴重的神經認知障礙由于抗反轉錄病毒試劑的應用已開始下降,但在艾滋病患者中仍然存在大量的神經認知合并癥,這些都歸類為HIV相關的神經認知障礙。
HIV-1感染的非神經細胞,如巨噬細胞和小膠質細胞,對轉錄反式激活因子(trans-activator of transcription,Tat),病毒蛋白 R(viral protein regulatory,Vpr)和HIV-1包膜糖蛋白gp120通過免疫刺激產生神經毒素誘導的神經毒性是必需的[1-3]。這些神經毒素是興奮性毒素,與谷氨酸受體結合,主要是C-X-C趨化因子受體4(C-X-C chemokine receptor 4,CXCR4)和 CC趨化因子受體5(C-C chemokine receptor 5,CCR5),使這些受體過度激活。這些過度激活的受體能夠激活細胞內鈣離子信號通路并使細胞內活性氧增加[3-6]。線粒體活性氧生成后Tat蛋白誘導細胞質游離鈣離子水平逐步升高[5-6]。因此,HIV-1蛋白,尤其是gp120,Tat和Vpr能夠刺激活性氧(reactive oxygen species,ROS)的產生,表明在艾滋病患者中凋亡樣神經元死亡是由活性氧介導的。迄今為止發現的活性氧誘導的所有病變中,DNA和RNA病變最豐富的是8-氧鳥嘌呤(8-hydroxyguanine,8-oxoG)。為了檢測額葉皮質中DNA氧化損傷在感染了HIV-1的中樞神經系統神經元損傷中是否起重要作用,本研究在感染了HIV的中樞神經系統對氧化核DNA損傷和線粒體DNA損傷進行了研究。此外,我們試圖在艾滋病患者尸檢的額葉組織中檢測8-氧鳥嘌呤的水平,以此作為艾滋病毒導致的神經系統疾病包括HIV相關的神經認知功能障礙患者活性氧水平的生物標記。
1 材料與方法
1.1 抗體、主要設備和試劑
本研究中用到的抗體主要有:抗-8-氧鳥嘌呤(8-oxoG)單克隆抗體(Trevigen公司,美國)、抗-8-氧-20脫氧鳥苷糖甘酶1(OGG1)多克隆抗體(Novus Biologicals,Littleton,CO,美國)、FITC標記的抗兔 IgG和Cy3標記的抗鼠IgG(Sigma公司,美國)。其他主要試劑有:二氫乙錠(Dihydroethidium)(Invitrogen公司,美國)。病毒載量通過 Nuclisens EasyQ分析儀(Nuclisens EasyQ HIV-1 1.1,biomerieux bv)檢測,而CD4細胞計數通過流式細胞儀檢測(BD FACSCalibur,美國)。
1.2 HIV相關的神經認知障礙評估
HIV相關神經認知功能障礙采用國際獲得性免疫缺陷綜合征(acquired immunodeficiency syndrome,AIDS)癡呆量表進行評分(IHDS),包括記憶-記錄-回憶3個步驟,主要測試運動速度和心理運動速度[7]。IHDS總分12分。IHDS評分低于或等于10分考慮為HIV-1相關神經認知紊亂(HIV-1 associated neurocognitive disorders,HAND),得分越低越嚴重。
1.3 尸檢腦組織標本
本研究中的10例額葉腦組織來源于河南省1994和1995年因商業性獻血感染了HIV-1的一組艾滋病死亡患者。10例尸檢腦組織標本中,5例生前依據IHDS考慮為HAND,另外5例為非HAND。5例正常額葉皮質腦組織標本來源于首都醫科大學附屬北京朝陽醫院神經外科腦部腫瘤患者的癌旁腦組織碎片。研究經過首都醫科大學附屬北京佑安醫院倫理委員會審核批準。組織采用10%的甲醛固定。
1.4 免疫熒光染色
組織玻片保存于-80℃。1×triton穿孔15 min后,1×PBS洗滌15 min×2次;1%BSA+2%羊血清+1×PBS 37℃封閉1 h;1∶1 000濃度抗-8-oxoG,抗OGG1抗體(封閉液稀釋)4℃過夜;1×PBS洗滌15 min×3次;1∶1 000濃度對應的Cy3或FITC標記IgG二抗(封閉液稀釋)37℃溫育1 h;1×PBS洗滌20 min×3次;DAPI封片后于德國Leica-dm500b型正向熒光顯微鏡下閱片并用Xillix數碼相機拍攝相關圖像(每個點至少選取3個視野,取平均數)。8-oxoG的陽性水平可通過8-oxoG陽性細胞核/DAPI陽性細胞核比率算得,OGG1相關密度可用Image Pro Plus 6.0軟件進行分析。
1.5 DNA提取和實時定量PCR
使用中國天根公司DNA提取試劑盒,按照使用說明提取基因組DNA。通過實時定量PCR相對定量的方法,我們分析了這些尸檢組織中線粒體DNA的拷貝數變化,包括5例HAND、5例非HAND和5例正常對照。首先,我們對實際DNA含量與qPCR實驗所獲得的DNA拷貝數之間關系進行驗證,建立標準曲線(圖1A)。實時定量PCR檢測采用已經成熟的探針法[8],相對定量。采用 Taqman7900HT系統進行實時定量PCR擴增線粒體DNA。所有的引物探針均由Invitrogen公司合成(上海,中國),所用序列詳見表1。每個標本作3個復孔,并設立陰性和陽性對照。引物和探針在反應中的終濃度為250和300 nm。反應程序依次為:95℃ 3 min,95℃15 s 40個循環,60℃ 1 min。利用Microsoft Excel軟件對數據進行分析處理。
1.6 線粒體DNA D-loop區的克隆測序
我們通過PCR的方法從前面提取的腦組織標本基因組DNA中擴增線粒體DNA D-loop區,再通過BioEdit軟件將克隆測序所得標本D-loop區序列與Gen-Bank線粒體DNA標準序列(NC_012920)進行核苷酸進化距離分析。根據標準的方法學,使用高保真的Taq多聚酶(Invitrogen公司,美國),用10 ng總DNA進行PCR擴增。PCR產物根據廠商說明書連接到pGEM-18T載體(Tankra公司,中國)。所有的序列由中國Biotake公司通過ABI3130序列儀進行測序。使用NCBI的BLAST和BioEdit軟件進行序列分析。使用7.0.5.3版本BioEdit軟件的Clustal W多序列比對程序進行多序列的比對。
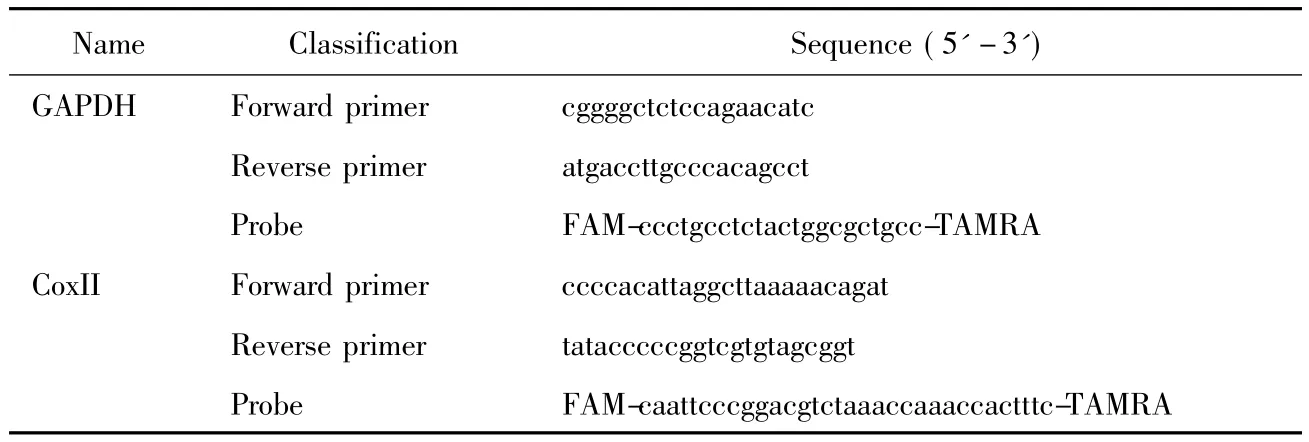
表1 實驗所用引物和探針序列Tab.1 Primer and probe sequences used in the experiment
1.7 通過K562細胞檢測AIDS患者腦脊液中超氧化物
基于熒光技術二氫乙啶(HE)常被用于檢測細胞和組織中的超氧化物。HE在細胞質中本身會發出藍色熒光(吸收/發射波長:355/420納米),一旦被氧化形成2-羥基乙啶,與DNA嵌合后會發出紅色熒光(吸收/發射波長:518/605納米)[9]。只有當它脫氫(氧化)成2-OH-E+后才可以與DNA嵌合。為了進一步驗證AIDS患者中樞神經系統氧化損傷情況,本研究中,利用穩定表達EGFP綠色熒光的人類白血病K562-EGFP細胞系和艾滋病患者(包括HAND和非HAND患者)新鮮腦脊液共同孵育15 min。然后利用流式細胞技術檢測K562-EGFP細胞HE的水平。人類白血病K562-EGFP細胞一直由本實驗室保存,用含有10%胎牛血清,100U/mL青霉素和100 μg/mL鏈霉素的RPMI1640培養基在加濕的5%CO2培養箱中,接種于6孔板中培養。1×105K562-EGFP細胞與200 μL的艾滋病患者腦脊液共同孵育15 min為了檢測AIDS患者腦脊液中超氧化物。K562-EGFP細胞在0.03%H2O2中孵育5 min作為陽性對照,同時將沒有做任何處理的K562-EGFP細胞作為陰性對照。去除培養基,加入1×PBS稀釋的儲存濃度為10 mg/mL的HE[于二甲基亞砜(dimethyl sulfoxide,DMSO)中儲存](Polysciences公司,美國),使終濃度為 50 μg/mL。避光,37 ℃孵育10 min。最后用BD FACSDiva流式細胞儀對細胞進行分析(BD FACS CantoTMⅡ)。HE在490 nm波長處被激發,在620 nm波長處可被檢測到。儲存10 000個細胞的數據,然后用CellQuest軟件進行分析。
1.8 數據分析
每個樣品均分析了8-oxoG和OGG1,在額葉皮質組織中隨機選取了顯微鏡視野(20×)的10個細胞進行計數分析。所有統計分析均使用SPSS18.0統計軟件,采用單因素方差分析進行比較,以P<0.05為差異有統計學意義。
2 結果
2.1 患者一般情況和臨床資料
10名艾滋病患者,這些患者分別在2006年和2007年去世。其中有7名男性和3名女性,平均年齡為32.9歲(8~56歲)。所有的患者終末期CD4計數都很低,平均為31.4(13~56)×106/L。這些患者的HIV-1亞型為HIV-1B亞型。最后一次記錄的平均血漿病毒載量是102 400(28 000-219 000)拷貝/mL;腦脊液(cerebrospinal fluid,CSF)病毒載量未知。所有患者未見中樞神經系統機會性感染,但是有3例患者合并肺結核,1例患者合并肺囊蟲感染,1例患者合并淋巴瘤,還有1例患者眼底巨細胞病毒感染,4例患者沒有任何機會性感染。IHDS測試表明5例患者有神經認知障礙(≤10分)。5例對照患者沒有任何機會性感染、HIV-1感染、未進行過化療和放射治療。
2.2 AIDS患者大腦皮質線粒體DNA檢測
HAND組和非HAND組線粒體DNA拷貝數下降到正常對照組的(0.69±0.18)倍和(0.74±0.15)倍(圖1B)。這表明,HIV-1慢性感染者的腦組織中線粒體DNA含量明顯下降。但是,在非HAND組和HAND組之間腦組織中線粒體DNA含量差異無統計學意義。
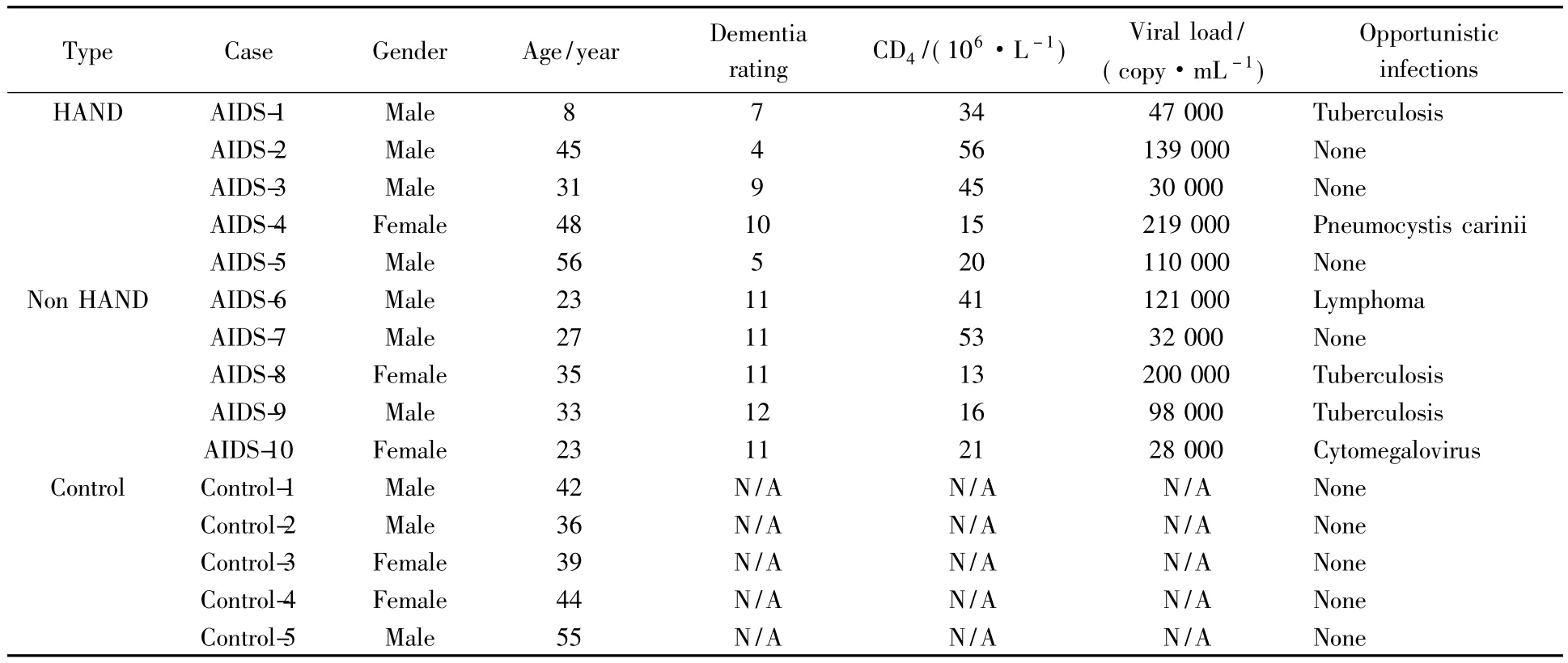
表2 患者一般情況和臨床資料Tab.2 General information:dementia rating CD+4T cell,viral load and opportunistic infections of the 10 AIDS patients and 5 control cases
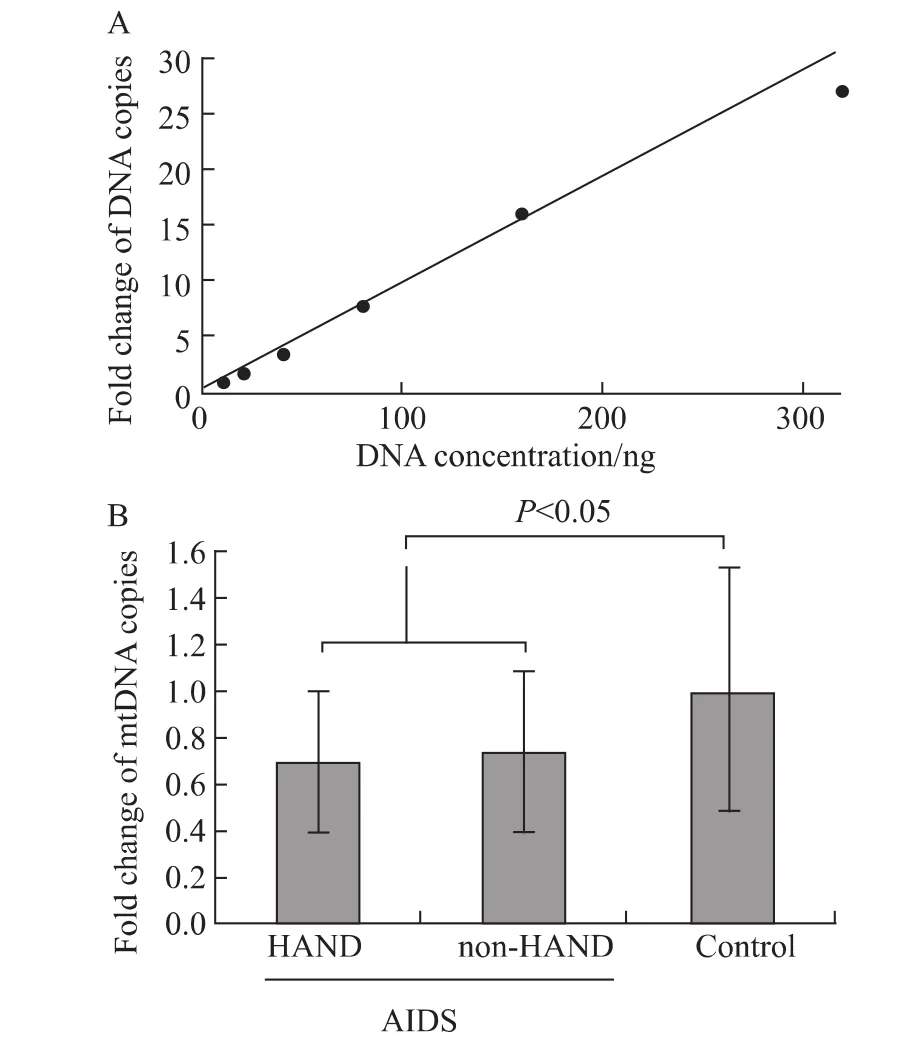
圖1 HIV-1感染者大腦皮質mtDNA缺失Fig.1 Depletion of mtDNA was detected in frontal cortex autopsy tissue from HIV-1 infected patients
2.3 DNA氧化損傷標志物8-oxoG在AIDS患者尸檢皮質腦組織中顯著增加
HAND組和非HAND組患者腦組織中8-氧鳥嘌呤的表達水平均增加,而且HAND組和非HAND組腦組織8-氧鳥嘌呤的表達水平增加更加明顯。比較而言,對照組額葉皮質組織中幾乎檢測不到8-氧鳥嘌呤的表達(圖2A)。對3次獨立實驗結果進行統計分析,結果顯示HAND組有近45%8-oxoG陽性細胞,非HAND組有近30%8-oxoG陽性細胞,而對照組只有4%8-oxoG陽性細胞(圖2B)。
發現AIDS患者尸檢組織中OGG1水平明顯低于對照組,但HAND和非HAND患者之間OGG1水平差異無統計學意義(圖2C,D)。
2.4 艾滋病患者尸檢組織額葉皮質中線粒體DNA突變增加
AIDS患者尸檢組織中D-loop區DNA突變水平明顯增加。核苷酸進化距離是0.047 1(0.012 2-0.122 7);而對照組的5份標本中只有2人存在缺失(D310C),沒有突變(圖3A)。進一步分析顯示,與對照組相比,HAND尸檢組織在線粒體DNA D-loop區突變率明顯增高(圖3B),單核苷酸突變數量在HAND組織中是39,非HAND組織中是13,而在對照組標本中僅有2個。HAND患者額葉皮質高水平的單核苷酸突變可能與線粒體功能障礙相關,進而增加了活性氧的水平。
2.5 艾滋病患者腦脊液中超氧化物增加
能夠代表腦脊液中超氧陰離子水平的HE的檢出率隨著HAND的進展而逐漸增加:陰性對照為4%,非HAND組為28% ~40%,HAND組為37% ~65%,陽性對照0.3%H2O2組為99%(圖4)。
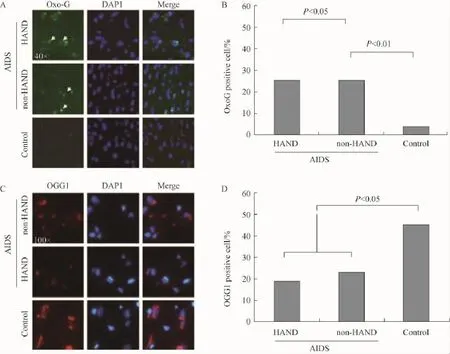
圖2 HIV-1感染患者大腦皮質腦細胞核DNA 8-oxoG氧化損傷和OGG1蛋白低表達Fig.2 High levels of 8-oxoG oxidative DNA damage in nuclear DNA and low levels of OGG1 protein co-exist in frontal cortex autopsy tissue from HIV-1 patients

圖3 大腦皮質腦組織mtDNA D-loop非編碼區突變分析.Fig.3 Mutation assay of the noncoding region of the mtDNA D-loop in frontal cortex autopsy issue from HIV-1 infected samples and controls
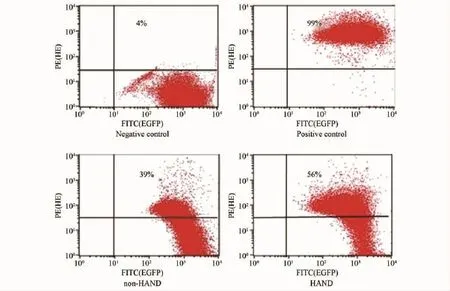
圖4 AIDS患者腦脊液超氧陰離子水平Fig.4 Level of superoxide in cerebrospinal fluid from AIDS Patients
3 討論
HIV-1感染患者的尸檢腦組織可見神經細胞和非神經細胞的凋亡,尤其在HIV相關癡呆癥患者[10-12]。早期研究[13-16]表明 HIV-1 對神經突觸的損害和誘導慢性細胞凋亡可導致大腦局部(如海馬和基底節區)神經元的死亡,繼而引起認知和運動功能障礙。艾滋病患者腦組織中神經凋亡的機制非常復雜,目前主流觀點認為由于分裂細胞(單核巨噬細胞和巨噬細胞)感染了HIV-1后釋放神經毒性物質,繼而產生神經毒性[17]。因此,HIV-1蛋白 gp120、Tat和Vpr能夠刺激活性氧的產生這一現象表明艾滋病患者神經元凋亡或死亡可能是由活性氧介導的。在細胞內,酶促和非酶促抗氧化反應組成一個復雜的防御系統以對抗各種氧化應激。然而,HIV-1蛋白在誘導過量活性氧產生的同時,還抑制機體抗氧化系統功能,從而進一步加重氧化損傷對神經元的毒性作用。
眾所周知,線粒體DNA氧化損傷和線粒體DNA缺失是非常嚴重的損傷,能夠導致線粒體呼吸功能下降和細胞凋亡。此外,慢性神經元凋亡是HAND主要的病理改變。本研究中,HIV-1感染時間均較長。隨著HIV相關的神經認知功能障礙的進展,活性氧的產生和氧化線粒體DNA的損傷(突變和缺失)能夠干擾線粒體氧化磷酸化,從而進一步誘導神經細胞凋亡,加速HIV相關神經認知功能障礙的進展[18-22]。迄今為止發現的活性氧誘導的所有病變中,DNA和RNA病變最豐富的是8-氧鳥嘌呤,而且可能作為活性氧水平有效的生物標志。既往研究[23]表明氧化應激可能在HIV感染的神經病變中發揮重要作用,HIV-1感染患者的CD+4T細胞中8-氧鳥嘌呤水平增加,DNA糖基化酶活性減低;而CD+8T細胞中8-氧鳥嘌呤的水平與健康對照組相似。我們對HIV-1感染患者尸檢組織額葉皮質的研究發現8-氧鳥嘌呤染色陽性的細胞占所有DAPI陽性細胞的45%,但是在健康對照組中只有4%。HIV-1感染的患者尸檢腦組織中氧化損傷DNA的積累以及AIDS患者中樞神經系統高水平的活性氧可能在神經退行性疾病中發揮關鍵作用。本研究的結果表明活性氧和OGG1能影響艾滋病患者中樞神經系統中8-氧鳥嘌呤的聚集。另外的試驗[24]證明8-oxo-G和OGG1表達主要在神經元細胞。OGG1可啟動針對DNA損傷的堿基切除修復。對老齡化和神經退行性疾病的研究[18]發現OGG1活性與8-氧鳥嘌呤積聚呈負相關。
臨床研究[25]發現,阿爾茨海默病等神經退行性疾病以及老齡化可見線粒體DNA突變率和缺失率增加。HIV-1感染和抗病毒治療所用的核苷類似物反轉錄抑制劑是線粒體DNA突變和線粒體功能障礙的兩個重要原因[26-27]。心肌細胞中特異表達HIV Tat能夠破壞其線粒體;此外,HIV Tat的過表達能夠抑制線粒體超氧化物歧化酶的表達[28]。在HIV-1感染早期,病毒即能進入中樞神經系統。此后在HIV-1感染大腦的慢性病程中,神經免疫的激活以及病毒蛋白的直接毒性能夠增加神經元和膠質細胞氧化應激的水平,導致大量的活性氧產生,包括羥自由基、超氧陰離子和單態氧等[29]。正如我們初步結果所揭示的那樣,腦脊液中的超氧化物隨著HAND的發展而增加,而線粒體基質中高水平的活性氧使得細胞線粒體DNA突變率大大增加。此外,HIV-1感染本身就可以產生氧化應激,并且刺激線粒體谷氨酰胺酶過表達,從而在HAND病程中誘導谷氨酸介導的神經細胞凋亡通路[10,29-30]。因此,我們對線粒體DNA突變和缺失是否與HAND相關很感興趣,最終研究結果顯示HIV-1感染的患者尸檢腦組織中存在高水平的線粒體DNA突變和缺失。有研究[31]顯示HIV-1感染和HIV-1蛋白Tat、Vpr可誘導線粒體產生活性氧,從而影響HAND的進程。我們的研究結果顯示HAND和非HAND患者線粒體DNA缺失顯著不同,表明HIV-1相關中樞神經系統病理過程是非常復雜的。眾所周知,HIV-1感染的巨噬細胞和膠質細胞釋放的促炎性細胞因子,HIV-1蛋白和興奮性氨基酸能夠直接或間接刺激神經元產生活性氧,從而損傷細胞大分子物質,導致脂質過氧化、蛋白質氧化和DNA氧化損傷。在HAND患者腦脊液中檢測到的高水平的活性氧表明,中樞神經系統活性氧與HAND的發展相關。氧化應激的慢性積累會誘導神經元凋亡,導致神經退行性疾病的發生和發展。因此,確定氧化應激在誘導核DNA氧化損傷和線粒體DNA突變,從而導致神經細胞凋亡中的作用非常重要。同時,這些結果表明,抗氧化劑治療不乏為預防和治療HAND的一種有益的選擇。
[1]Buzy J,Brenneman D E,Pert C B,et al.Potent gp120-like neurotoxic activity in the cerebrospinal fluid of HIV-infected individuals is blocked by peptide T[J].Brain Res,1992,598(1-2):10-18.
[2]Jones G J,Barsby N L,Cohen E A,et al.HIV-1 Vpr causes neuronal apoptosis and in vivo neurodegeneration[J].J Neurosci,2007,27(14):3703-3711.
[3]Yeung M C,Pulliam L,Lau A S.The HIV envelope protein gp120 is toxic to human brain-cell cultures through the induction of interleukin-6 and tumor necrosis factor-alpha[J].AIDS,1995,9(2):137-143.
[4]Kaul M,Lipton S A.Chemokines and activated macrophages in HIV gp120-induced neuronal apoptosis[J].Proc Natl Acad Sci USA,1999,96(14):8212-8216.
[5]Norman J P,Perry S W,Reynolds H M,et al.HIV-1 Tat activates neuronal ryanodine receptors with rapid induction of the unfolded protein response and mitochondrial hyperpolarization[J].PLoS One,2008,3(11):e3731.
[6]Perl A,Banki K.Genetic and metabolic control of the mitochondrial transmembrane potential and reactive oxygen intermediate production in HIV disease[J].Antioxid Redox Signal,2000,2(3):551-573.
[7]Sacktor N C,Wong M,Nakasujja N,et al.The International HIV dementia scale:a new rapid screening test for HIV dementia[J].AIDS,2005,19(13):1367-1374.
[8]Wu Y,Li N,Zhang T,et al.Mitochondrial DNA base excision repair and mitochondrial DNA mutation in human hepatic HuH-7 cells exposed to stavudine[J].Mutat Res,2009,664(1-2):28-38.
[9]Kaufman J,Jing J.China and AIDS-the time to act is now[J].Science,2002,296(5577):2339-2340.
[10]Allard J P,Aghdassi E,Chau J,et al.Effects of vitamin E and C supplementation on oxidative stress and viral load in HIV-infected subjects[J].AIDS,1998,12(13):1653-1659.
[11]Garden G A,Morrison R S.The multiple roles of p53 in the pathogenesis of HIV associated dementia[J].Biochem Biophys Res Commun,2005,331(3):799-809.
[12]Petito C K,Roberts B.Evidence of apoptotic cell death in HIV encephalitis[J].Am J Pathol 1995,146(5):1121-1130.
[13]Kaul M.HIV's double strike at the brain:neuronal toxicity and compromised neurogenesis[J].Front Biosci,2008,13:2484-2494.
[14]Bassiri A,Holden J,Wong M.A case of fulminant human immunodeficiency virus dementia[J].Clin Infect Dis,1995,21(5):1313-1314.
[15]Chiodi F.Tissue lesions in AIDS patients involve both the lymphoid and the nervous system[J].AIDS,1995,9 Suppl A:S41-48.
[16]Kaul M,Lipton S A.Mechanisms of neuronal injury and death in HIV-1 associated dementia[J].Curr HIV Res,2006,4(3):307-318.
[17]Ozdener H.Molecular mechanisms of HIV-1 associated neurodegeneration[J].J Bio Sci,2005,30(3):391-405.
[18]Bolin C M,Basha R,Cox D,et al.Exposure to lead and the developmental origin of oxidative DNA damage in the aging brain[J].FASEB J,2006,20(6):788-790.
[19]Eugenin E A,King J E,Nath A,et al.HIV-tat induces formation of an LRP-PSD-95-NMDAR-nNOS complex that promotes apoptosis in neurons and astrocytes[J].Proc Natl Acad Sci USA,2007,104(9):3438-3443.
[20]Lipton S A.Similarity of neuronal cell injury and death in AIDS dementia and focal cerebral ischemia:potential treatment with NMDA open-channel blockers and nitric oxide-related species[J].Brain Pathol,1996,6(4):507-517.
[21]O'donnell L A,Agrawal A,Jordan-Sciutto K L,et al.Human immunodeficiency virus(HIV)-induced neurotoxicity:roles for the NMDA receptor subtypes[J].J Neurosci,2006,26(3):981-990.
[22]Saitoh A,Fenton T,Alvero C,et al.Impact of nucleoside reverse transcriptase inhibitors on mitochondria in human immunodeficiency virus type 1-infected children receiving highly active antiretroviral therapy[J].Antimicrob Agents Chemother,2007,51(12):4236-4242.
[23]Aukrust P,Luna L,Ueland T,et al.Impaired base excision repair and accumulation of oxidative base lesions inT cells of HIV-infected patients[J].Blood,2005,105(12):4730-4735.
[24]Boiteux S,Radicella J P.Base excision repair of 8-hydroxyguanine protects DNA from endogenous oxidative stress[J].Biochimie,1999,81(1-2):59-67.
[25]Reeve A K,Krishnan K J,Turnbull D M.Age related mitochondrial degenerative disorders in humans[J].Biotechnol J.2008,3(6):750-756.
[26]Casula M,Bosboom-Dobbelaer I,Smolders K,et al.Infection with HIV-1 induces a decrease in mtDNA[J].J Infect Dis,2005,191(9):1468-1471.
[27]Kohler J J,Lewis W.A brief overview of mechanisms of mitochondrial toxicity from NRTIs[J].Environ Mol Mutagen,2007,48(3-4):166-172.
[28]Raidel S M,Haase C,Jansen N R,et al.Targeted myocardial transgenic expression of HIV Tat causes cardiomyopathy and mitochondrial damage[J].Am J Physiol Heart Circ Physiol,2002,282(5):H1672-1678.
[29]Pocernich C B,Sultana R,Mohmmad-Abdul H,et al.HIV-dementia,Tat-induced oxidative stress,and antioxidant therapeutic considerations[J].Brain Res Brain Res Rev,2005,50(1):14-26.
[30]Tian C,Erdmann N,Zhao J,et al.HIV-infected macrophages mediate neuronal apoptosis through mitochondrial glutaminase[J].J Neurochem,2008,105(3):994-1005.
[31]Opii W O,Sultana R,Abdul H M,et al.Oxidative stress and toxicity induced by the nucleoside reverse transcriptase inhibitor(NRTI)-2',3'-dideoxycytidine(ddC):relevance to HIV-dementia[J].Exp Neurol,2007,204(1):29-38.

