利用溶劑結晶法純化環維黃楊星D*
高藝歌,李思思,和琳琳,王高峰
(1.河南省康利醫藥技術開發有限公司,河南鄭州450044;2.黃河科技學院醫學院,河南 鄭州450001)
環維黃楊星D為黃楊科植物小葉黃楊Buxus microphylla Sieb.et Zucc.var.sinica Rehd.et Wils.及其同屬植物中提取而得的生物堿,是《中國藥典》收錄的國家基本心血管治療藥物,功能是行氣活血、通絡止痛,用于氣滯血淤所致的胸痹心痛、脈結代、冠心病、心律失常見上述癥候者。用量:1~2 mg,每日2~3次,每日用量2~6 mg,屬于微量用藥范圍。作為一個天然藥物,如此微量的用量便具備很強的心血管生理活性,預示了該藥物不同凡響,具有很大的潛在續開發價值。黃楊寧的成分為環維黃楊星D。現代醫學理論[1]揭示黃楊寧的藥理活性有以下5個方面:①對腦血栓所致損傷的治療作用;②對心肌缺血所致心律失常、心肌梗死的治療作用;③抗心律失常和治療心肌衰竭的治療作用;④強心作用;⑤改善微循環的作用。最新的藥理學研究[2]顯示:黃楊寧對鉀離子通道具有阻滯作用,可歸屬于三類抗心律失常藥使用。因為環維黃楊星D是一個在心臟部位具有多靶點、強藥理活性的天然植物單體藥物,所以其具有進一步深入開發的良好前景。
1 背景概述
在2002年至2006年之間,我國新藥開發領域曾出現過環維黃楊星D新制劑的開發熱潮。期間圍繞黃楊寧新藥開發的專利申報有30多件,申報的新藥品種包括膠囊劑、滴丸劑、軟膠囊劑、分散片、口腔崩解片、緩釋制劑、控釋制劑、復方制劑、小體積注射劑、大體積注射劑、粉針劑等近十幾個品種,參與制劑研究并已經在國家食品藥品監督管理局申報新藥的研究單位多達幾十家,是與葛根素、燈盞花素等天然植物提取藥物深入開發同時閃亮的中藥新藥開發亮點。
但是自2006年之后,除了一個環維黃楊星D的分散片獲準上市之外,再沒有環維黃楊星D的新的藥物制劑獲得注冊批準,其中一個重要的原因就是環維黃楊星D的純度問題沒有得到很好的解決。
目前環維黃楊星D作為中藥提取物被收錄在《中國藥典》一部中,其質量標準規定的純度為99.0%。然而截止到目前為止,市場上可以購買到的環維黃楊星D的純度在86%~92%。用于生產環維黃楊星D口服制劑黃楊寧片所使用的原料就是這種達不到《中國藥典》規定純度的環維黃楊星D。
多年來,圍繞環維黃楊星D研究的技術人員從來沒有放棄過對環維黃楊星D純化的研究,以求真正獲得99.0%以上純度的有效生產工藝。有人采用選擇性合成然后再分離純化的方法,盡管有文獻[3]報道得到了高純度的產品,但是由于所采用的檢測方法不能提供高純度的有效證據,所以這種純化工藝被質疑。筆者認為環維黃楊星D中存在的雜質是與主成分結構極其相似的生物堿。由于它們的結構相似,所以具備非常類似的理化性能,尤其是溶解度等方面的性能非常接近,因此選擇性合成純化工藝難以在化學反應中只選擇環維黃楊星D產生反應而不選擇結構類似的同系物雜質。如果一些同系物雜質也將隨之一同參與化學反應,則這種純化工藝難以實現純化之目的。
也有人采用柱分離的方法[4-5],盡管從分析級別的色譜柱上可以獲得純化的樣品,但這種工藝難以實現放大來滿足工業化生產的需要。這是因為環維黃楊星D在采用柱分離時,同系物雜質與環維黃楊星D的分離度比較小,小的柱分離度盡管可以滿足分析的需要,但是移植到工業化生產的大型分離柱時,雜質和主成分的分離度將更進一步縮小,同時對分離現場的檢測也存在技術難度,由此而來將進一步增大柱分離的難度。盡管有文獻報道[4-5]采用柱分離的方法獲得了純度可以達到99.0%的環維黃楊星D,但是這種方法是難于放大生產的。
2 純化方法的研究結果
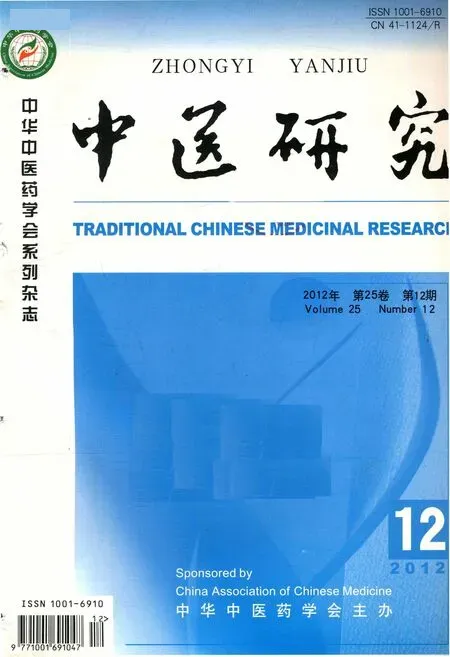
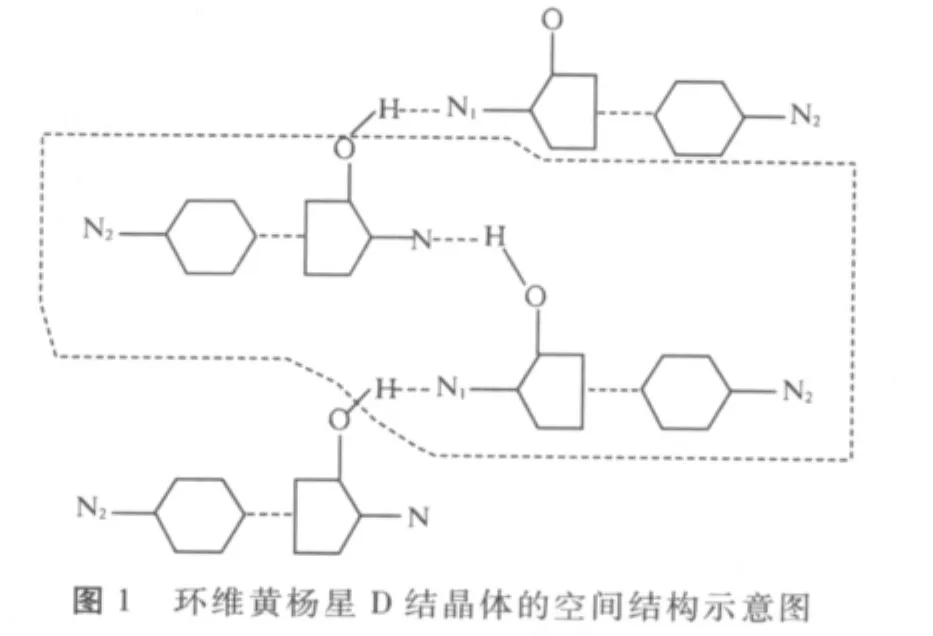
筆者通過研究得知環維黃楊星D在形成結晶體時是通過兩個環維黃楊星D分子靠N…H分子間結合力成健形成晶胞。結構示意圖如圖1所示,進一步的單晶測定環維黃楊星D的空間堆積結構,如圖2所示。
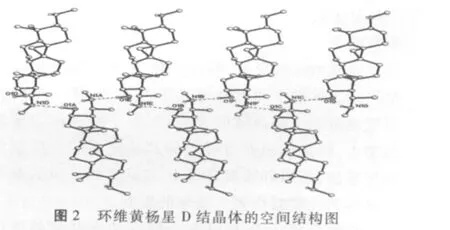
筆者通過研究獲得在特定的溫度和溫度曲線條件下,環維黃楊星D可以與甲醇形成甲醇溶劑結晶體,環維黃楊星D與甲醇所形成的溶劑結晶體的結構示意圖如圖3所示,進一步測定環維黃楊星D與甲醇溶劑結晶體的空間堆積結構如圖4所示。
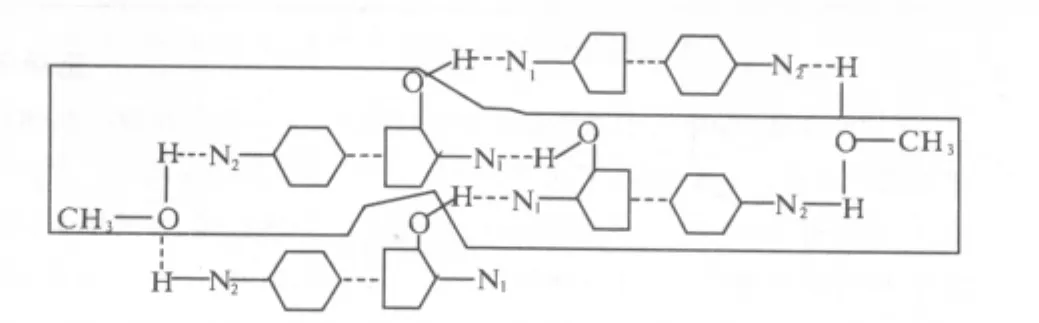
圖3 環維黃楊星D與甲醇所形成的溶劑結晶體的空間結構示意圖
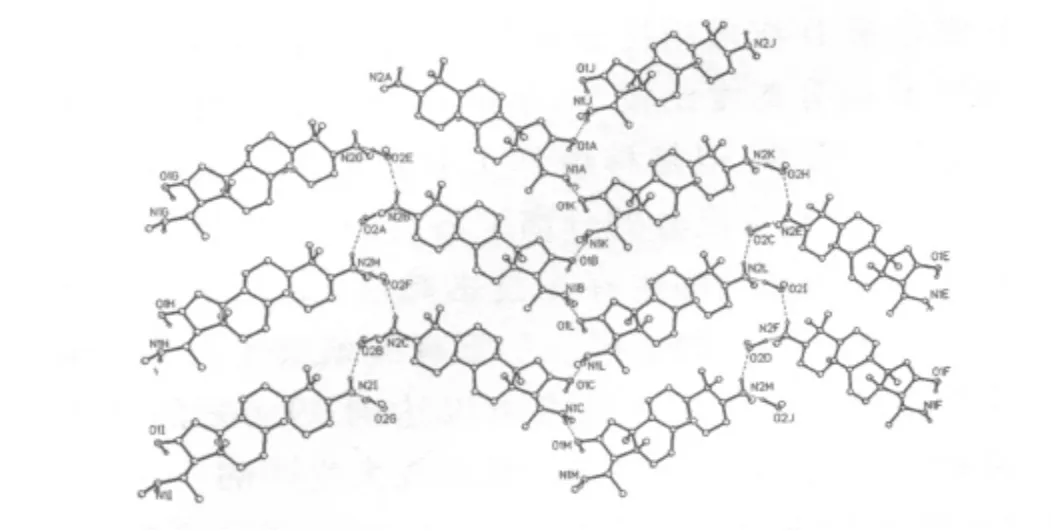
圖4 環維黃楊星D與甲醇所形成的溶劑結晶體的空間結構圖
當化合物可以形成結晶體時,如果沒有外來化合物參與到該化合物結晶體內部,則結晶體內部是不存在雜質的,因此結晶體產物一般來說純度都比較高。然而,當只有兩個環維黃楊星D結合所形成的結晶體為空間尺寸很小的粉末或針狀形態時,結晶體的表面積比較大,一些雜質特別是與環維黃楊星D結構非常相似的同系物雜質,被吸附在環維黃楊星D晶體的表面。由于這些結構相似的雜質成分在理化性質上也與環維黃楊星D相似,所以空間尺寸微小的環維黃楊星D結晶體表面就吸附了大量的結構相似、理化性質接近的雜質成分,而采用溶劑清洗的方法難于洗滌干凈這些吸附在結晶體表面的雜質,這就是環維黃楊星D產品純度不高的實質性因素。
當環維黃楊星D與甲醇形成溶劑結晶時,由于甲醇分子的介入,所形成的結晶體是由兩個甲醇分子與四個環維黃楊星D分子交叉組合而成。由于這種特殊的結構形態,環維黃楊星D與甲醇形成的溶劑結晶體的空間尺寸增大了很多,這樣一來就大幅度地降低了結晶體的表面積,由于結晶體表面積的增大,結晶體表面所吸附的其他同系物雜質就大幅度減少,所以環維黃楊星D與甲醇所形成的溶劑結晶體的純度就得到大幅度的提升。
環維黃楊星D與甲醇所形成的溶劑結晶體中由于存在甲醇,顯然不能直接取代環維黃楊星D的目前藥學注冊地位。將環維黃楊星D與甲醇所形成的溶劑結晶體溶解到乙醇溶劑中再重新結晶,就可以得到由兩個環維黃楊星D分子結合而成的環維黃楊星D晶體。有這種方法獲得的環維黃楊星D的純度幾乎與一甲醇結晶體的純度一致。一般情況下,通過兩個循環的重結晶純化,就可以獲得99.0%的化學純度。
3 研究意義
目前由于現有的環維黃楊星D標準采用非水滴定方法進行純度檢測,這種方法是對總生物堿檢測的方法,所以不能有效地分別檢測環維黃楊星D與其他結構類似的雜質,檢測方法的專屬性差,已經不能滿足環維黃楊星D質量控制的要求。提高藥品質量標準的技術水平是保障藥品質量的有效方法。國務院國發〔2012〕5號文件—國務院關于印發國家藥品安全“十二五”規劃的通知中指出:最新公布的國家醫藥安全十二五規劃將提高藥品質量標準水平作為進一步保障我國藥品安全的基本手段。因此,環維黃楊星D質量標準的提升迫在眉睫。在環維黃楊星D質量標準提升以后,目前市場銷售的低純度環維黃楊星D原料將不能符合質量標準99.0%純度的要求,所以本文介紹的純化方法將會有效地應用于環維黃楊星D的工業化生產中。
[1]方泰惠.中藥現代化代表藥物-環維黃楊星D藥理研究進展[C].中藥(新型制劑)專業委員會成立大會和首屆學術研討會論文集,北京大學,2004:80-87.
[2]劉紅軍,余海濱,朱明軍,等.環維黃楊星D對豚鼠心室肌細胞膜電位的影響[J].中國藥理與臨床,2009,25(6):39-42.
[3]胡國強,許啟泰,張保國,等.環維黃楊星D分離方法改進[J].中國天然藥物,2004,2(3):155-156.
[4]杭太俊,夏合柱,劉潔,等.環維黃楊星D的制劑:中國,CN1864690A[P].2006-11-22.
[5]徐新盛,文艷秋.環維黃楊星 D的純化方法:中國,CN1319984C[P].2007-06-06.