濃香型白酒窖泥中細菌多樣性的免培養技術分析*
湯斌,劉金英,周慶武,李安軍,萬春環,湯有宏
1(安徽工程大學微生物發酵安徽省工程技術研究中心,安徽蕪湖,241000)
2(安徽古井貢酒股份有限公司,安徽毫州,236826)
濃香型白酒窖泥中細菌多樣性的免培養技術分析*
湯斌1,劉金英1,周慶武2,李安軍2,萬春環2,湯有宏2
1(安徽工程大學微生物發酵安徽省工程技術研究中心,安徽蕪湖,241000)
2(安徽古井貢酒股份有限公司,安徽毫州,236826)
采用免培養(culture independent)技術直接從濃香型白酒窖泥中提取細菌微生物混合基因組DNA(也叫元基因組DNA),利用細菌16S rDNA通用引物擴增窖泥細菌的序列,根據16S rDNA序列對細菌多樣性進行初步分析。采用PCR擴增技術、分子克隆技術以及序列同源性分析等方法測定細菌的16S rDNA,通過與基因數據庫中相似菌群序列同源性的比較,得到樣品菌種多樣性,分別構建系統發育樹。結果顯示,細菌含有幾大類群,表現出高度的細菌多樣性。共分為Uncultured bacterium、Clostridium、Lactobacillus、Eubacterium和 S yntrophomonas五個細菌分類。
濃香型白酒,窖泥,微生物多樣性,免培養法,系統發育樹
近年來分子生物學技術不斷興起,研究者可以選用更先進的分子技術手段分析樣品的各種信息資源。16S rDNA分類方法被大家廣泛采用,將免培養分析法與其結合,能準確快速的分析樣品中微生物構成的多樣性[1-3]。
中國濃香型白酒的生產以泥窖的窖池為基礎,發酵的過程就是棲息在窖泥和糟醅的龐大而復雜的微生物相互之間做用的結果。由于我國研究專家在固態發酵窖池上具有得天獨厚的地理優勢,在窖泥的微生物生態,特別是在主要功能菌的分離培養,人工培育活性窖泥等方面取得了很大的成績。但僅僅依托于傳統的微生物分離培養的分析方法是遠遠不能滿足窖泥微生物生態學研究的需要。眾多研究表明自然界微生態系統中可培養的微生物僅僅占微生物總數的0.1%~10%[4]。本研究運用免培法初步探索了白酒窖池窖底窖泥中細菌的多樣性構成,通過窖泥細菌菌群16S rDNA序列同源性和系統發育遠近關系初步了解了窖泥中含有哪些微生物,初步了解細菌的組成框架,希望對窖泥的傳統培養法提供一點指導意義。
1 材料與方法
1.1 實驗材料
(1)分析樣品:安徽古井貢酒酒廠窖池底層窖泥。
(2)菌種:DH5α Escherichia coli,安徽工程大學可再生資源研究室保藏。
(3)主要試劑和儀器:Taq DNA聚合酶、PCR產物純化試劑盒,上海生工;連接酶及相關試劑,Takara公司;DNA大片段回收試劑盒(Biotech),抗生素氨芐青霉素,上海生工;PCR引物合成,上海生工;英國Techne公司的TC-312型PCR儀;高速冷凍離心機,貝克曼公司;XSJ-HS型顯微攝影儀,上海華宇。
1.2 實驗方法
1.2.1 總DNA的提取
從土壤樣品中高效提取可進行分子操作的基因組DNA是進行免培養法的基礎。此過程包括:從環境樣品中高效獲得粗制基因組DNA和去除粗制DNA中的雜質。
直接提取窖泥微生物總DNA的方法采用預處理和不進行預處理的提取方法有明顯區別:未預處理的提取方法得到的DNA樣品電泳條帶有明顯的彌散現象,而經過預處理得到的DNA樣品的條帶較整齊。這是因為對窖泥進行預處理可以有效地去除雜質,減少胞外游離DNA污染,減少可溶性的無機物、有機物和腐植酸類物質的污染。特別是腐殖酸影響后續PCR的質量所以在參考大量的文獻[5-9]后本研究采用如下方法:取適量的窖泥冷凍干燥過夜;取200 mg加入2 mL EP管中;采用0.1 mol/L pH7.6磷酸鹽緩沖溶液(NaCl 0.8%,KCl 0.02%,Na2HPO40.15%,KH2PO40.025%)1 mL浸泡5 min;1000 r/min離心2 min,去上清液;重復步驟2依次;加入0.35 g無菌玻璃珠(直徑1 mm)以及0.8 mL DNA提取液(100 μmol/L Tri,100 μmol/L EDTA,200 μmol/L NaCl,3%CTAB,pH 9.0),劇烈振蕩10 min加入溶菌酶500 μL(500 mg/mL)混勻37℃水浴30 min(期間顛倒混勻3次);(4)加入0.8 mL SDS緩沖液(100 mmol/L Tris,200 mmol/L NaCl;3%SDS,pH9.0)振蕩混勻;65℃水浴30 min(期間顛倒混勻3~5次),10000 r/min離心10 min收集中間液相層(分層后將上層液相全部取出);加入等體積氯仿/異戊醇(24∶1)抽提2次12000 r/min離心5 min取上清液加入1/10體積的醋酸鈉溶液混勻,加入等體積的異丙醇混勻;室溫沉淀30 min以上;最大轉速離心15 min取沉淀,70%乙醇洗滌室溫自然晾干,溶于適量ddH2O中。用大片段DNA回收試劑盒純化去除雜質,-20℃保存。
1.2.2 總DNA質量的檢測
用紫外分光光度計檢測DNA在A260、A280波長下的值,核酸的紫外最大吸收值在260 nm,蛋白質的紫外最大吸收峰在280 nm,利用核酸和蛋白質的這個特性,一般用A260/A280表示DNA樣品純度。一般A260/A280≈1.8較純,否則可能存在蛋白質或小分子雜質等污染[10]。
將總DNA樣品用1.2%(w/v)瓊脂糖凝膠在電壓100 V,電泳1 h條件下電泳,EB染色,于紫外凝膠成像拍照系統觀察。
1.2.3 窖泥PCR擴增
用細菌16S rDNA通用引物[11]F:5’-AGAGTTTGATCCTGGCTCAG-3'和 R:5'-AAGGAGGTGATCCAGCCGCA-3'進行擴增。PCR擴增反應體系總50 μL,模板2 μL。PCR反應條件為:95℃預變性5 min,然后94℃變性1 min,55℃退火50 s,72℃延伸50 s,循環30次,72℃延伸10 min。
1.2.4 PCR產物純化
去除dNTP、引物二聚體和非特異性核酸片段等雜質用DNA膠回收純化試劑盒進行切膠純化。
1.2.5 PCR產物的克隆以及鑒定
用膠回收試劑盒對擴增出的目的片段進行純化,產物連接到pUCT載體,轉化到DH5α中,運用藍白斑原理篩選陽性克隆,將轉化產物涂布到篩選的LB平板(含有氨芐、IPTG和X-gal),待藍白斑長出,用牙簽挑取白色菌落于含氨芐的LB液體培養基中。待培養基變渾濁,初步鑒定為克隆成功。再利用菌液PCR法進一步鑒定是否是陽性克隆,用電泳檢測,將含有DNA片段的菌液送交測序公司。
1.2.6 基因的序列測序和分析
陽性克隆送到上海生工測序,去除序列頭尾中所含的載體序列,根據圖譜去除尾部信號雜帶,余下序列進行拼接。提交序列到NCBI基因庫中進行序列同源性比對,找到各序列的同源性較高的16Sr DNA序列,根據同源相似性的比值對序列進行分類。同時對這些序列用ClustalX軟件[12]按照最大同源性的原則進行多序列比對,根據比對結果用DNAsp、MEGA3.1、PAUP等軟件轉化格式用鄰接法((Neighbor-joining method)構建系統發育樹[13],以確定其系統發育地位。進一步分析窖泥細菌多樣性。圖3是基于PAUP軟件構建的NJ型系統發育樹。
2 結果與分析
2.1 DNA樣品提取結果分析
圖1的1~6號泳道為窖泥總DNA用瓊脂糖凝膠電泳后的條帶,M為2000bp的分子量標記。可見6個樣品的DNA目的片段雜質少且條帶清晰。由于基因組模板的純度會影響后續實驗結果[14]。同時將樣品用紫外分光光度儀定性檢測DNA的純度。選取A260/A280最接近1.8的樣品進行后續的PCR擴增。

圖1 窖泥DNA樣品瓊脂糖凝膠電泳結果
2.216S rDNA基因的PCR擴增結果
圖2長度約1.5 kb的目的片段條帶清晰。圖2是以窖泥細菌總DNA為摸板,利用細菌通用引物擴增出的16S rDNA基因片段,是切膠純化后的結果。如圖條帶清晰,可以進行后續的克隆實驗。
2.3 窖泥16S rDNA序列同源性與系統發育樹分析
本研究中提取窖泥樣品6份DNA樣品,分別進行PCR反應,每次PCR設置3次重復,將3次重復的PCR產物混合后利用PCR產物回收試劑盒回收,進行后續實驗。然后將6份DNA樣品的PCR產物充分混合后分別連接在載體上,用于克隆。利用這種方法可以大大增加減少PCR過程中的可能存在的誤差。本研究共得到30個有效的陽性克隆,將有效的16S rDNA基因的全部序列上傳到網絡數據庫NCBI做同源性比對和序列分析,同源性上獲得的總序列中有11個序列為未培養菌株,19個序列為鑒定出的細菌序列。其中有3個序列與已報道的未培養或未鑒定菌株的16S rDNA序列的同源相似性≥97%,8個序列與已報道的未培養或未鑒定菌株的16S rDNA序列的同源相似性在94%~96%;另有5個序列與已知的序列相似性為97%~100%,14個序列與已知細菌的序列相似性在91%~96%。一般全序列具有99%~100%相似性的判定為一個種,全序列在97%~99%相似性的認定為一個屬[15-16]。對于同源性上有22個克隆子與網絡數據庫NCBI做同源性比對低于97%。可見濃香型白酒窖泥中存在許多未知的菌種等待開發。
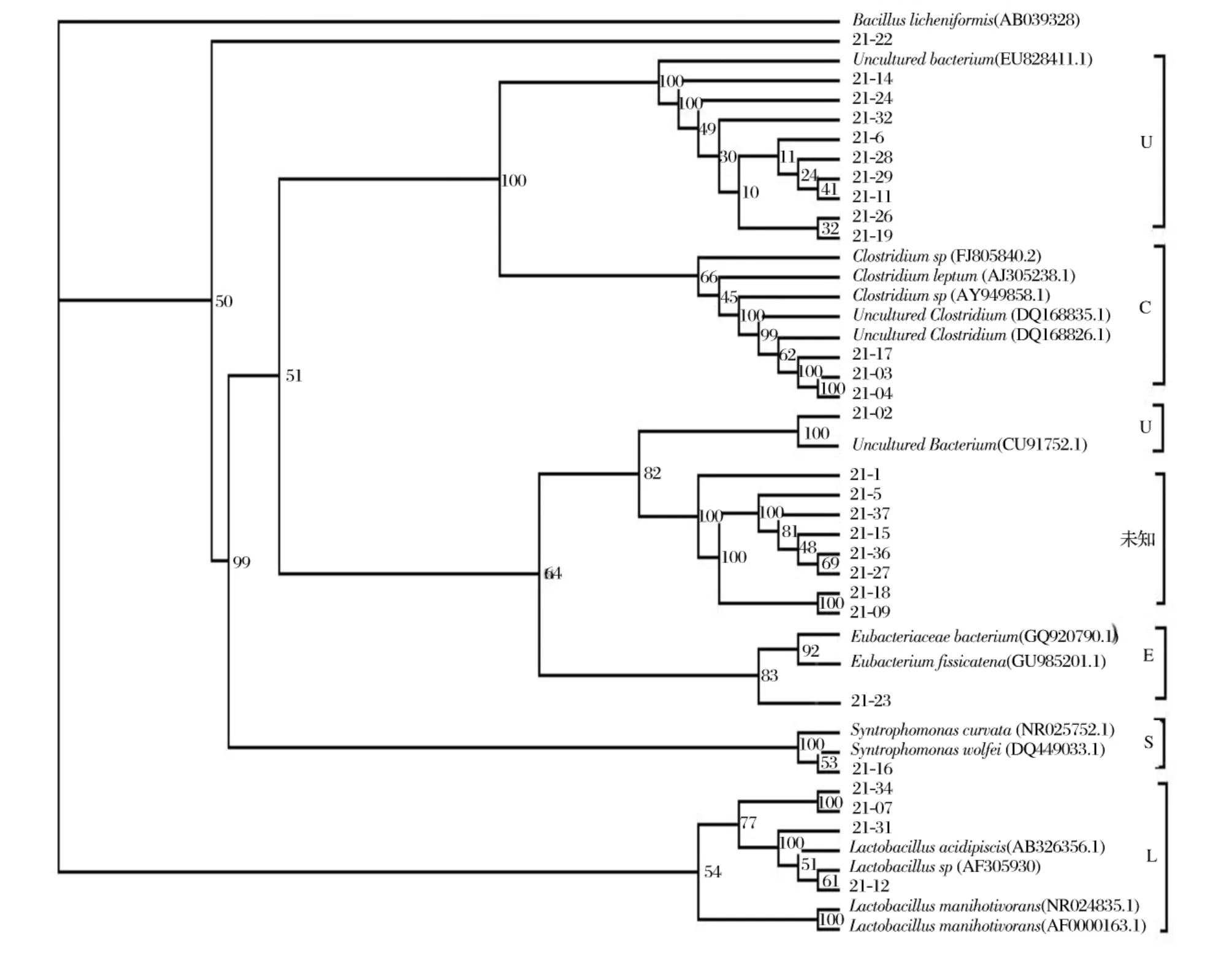
圖3 基于16S rDNA序列為基礎的窖泥中細菌的系統發育樹圖(NJ樹)
從系統發育樹結構看,以Bacillus licheniformis為外群構建,結構分為8個部分。有效克隆分別屬于Uncultured bacterium、Clostridium、Lactobacillus、Eubacterium和Syntrophomonas 5個細菌分類。克隆子21-22和圖3結構中未知部分的8個克隆分化成獨立的結構,表明與已知菌種的幾個屬的進化距離較遠,他們無疑代表了新的分類單元,如果能深入研究這些序列的宿主菌對深入探索窖泥細菌多樣性更具有深遠的意義。
對于整個細菌域來說,除了未培養菌株外,梭狀芽孢菌為窖泥的優勢菌,并沒有呈現多種類的多樣性。這可能由于窖泥底層,土壤結構、營養成分、理化性質、土壤環境很穩定,一些適應此環境的微生物就形成較優勢的菌群生存,不適應這個環境的微生物就逐漸被淘汰。Clostridium類群能降解有機底物產生醇類、有機酸、CO2/H2以及礦物質成分,一般從厭氧的窖泥中分離,在白酒窖泥中與甲烷菌共生,并在中后期游離于糟醅中,難于單獨分離培養或不能培養,包括一些產己酸菌、丁酸菌等[17],可與淀粉質物質水解產生己酸、丁酸并形成己酸乙酯、丁酸乙酯等有關。濃香型白酒主要呈香成分是己酸乙酯,所以梭狀芽孢桿菌起到了很重要的作用。
Lactobacillus類乳酸類細菌菌群為第二優勢菌,適合于在厭氧環境下的繁育,白酒發酵中乳酸屬的主要代謝產物為乳酸,是形成乳酸乙酯的主要物質,乳酸菌同時會產生乙酸、乙醇、CO2等其它代謝產物,丙酸、丁酸等菌可以利用乳酸為底物或為碳源形成成丙酸或丁酸,形成白酒其它香味物質成分。在白酒發酵初期乳酸菌起到調節酸度的作用,發酵中期為其它微生物提供必需氨基酸和維生素促進釀酒微生物的繁殖,發酵后期乳酸乙酯的不揮發特性,留在酒尾中增加了酒風味中的后味。整個發酵過程中乳酸菌的發酵產物多,代謝方向多,又作為多種微生物的底物,表明其在白酒發酵中至關重要的地位。
Syntrophomonas類互營單胞菌和Eubacterium類在系統發育樹中獨立成一分枝。在整個克隆子中也分別僅有一個克隆子屬于這兩類。他們在白酒研究中很少報道,需要研究者進一步研究其在白酒生產中的相關作用。
本研究得到的細菌菌群多樣性結構,與已有窖泥文獻報到存在共同點同時也存在一些差異。傳統的微生物培養法和新興的分子生物技術都檢出窖泥中有梭狀菌、乳酸菌[18-21],本次應用免培養法檢出都含有這些菌。表明這兩種菌群對白酒發酵起到至關重要的作用。差異性則是Syntrophomonas類互營單胞菌和Eubacterium類優桿菌很少有相關報道,另外,對于免培養法發現的很多序列只和未培養和未鑒定的菌種序列相似,需要對這些序列更進一步的研究才能把握其在白酒發酵中的作用。對研究結果的相似性和差異性,一方面濃香型白酒呈香成份主要為己酸乙酯所以主要的菌種類群基本相似,另一方面由于各釀酒廠土質、地理環境的差異以及窖泥時間長短等因素的不同;再者免培養研究法本身所具有的不可避免的方法缺點所以肯定存在差異性。
3 討論
本文利用免培養法對安徽古井貢酒酒廠窖池窖底的窖泥進行細菌微生物多樣性的研究,來確定窖泥中優勢細菌的組成情況。結果共有Uncultured bacterium、Clostridium、Lactobacillus、Eubacterium和Syntrophomonas 5個細菌分類。但免培養法存在以下幾個缺陷:1)由于免培養法是以PCR反應為基礎的,所以由于混合樣品中的不同DNA與載體親和度的不同對結果會產生影響,使得親和度大的片度較易反映,而某些基因片度卻不能鑒定出。這是方法本身存在的缺陷,在實驗時采用把多次提取的基因組樣品進行混合后進行多組PCR,以減少誤差。2)對混合樣品進行克隆,存在重復克隆的現象。本文挑取的克隆數不多,但初步反應了細菌的多樣性組成,在排除假陽性后獲得有效基因序列仍然是細菌組成的一個縮影。所以將獲得的有效克隆全部送去測序,通過序列結果可以看出克隆重復度。以后為避免方法的缺陷,需將克隆數加大,更可能全面的反應細菌構成。該方法的好處在于免于對微生物的長時間培養,快速省時尤其是生化反應不明顯、難以培養的細菌;采用分子水平的鑒定也有比較高的準確度和可信度,尤其適用于及傳統表型方法難以鑒定出的細菌。
窖池窖底的窖泥的細菌結構組成可以通過本方法大致了解。因為窖池底層結構基本沒有太大變化,對菌種的要求比較苛刻,利于形成優勢菌群。了解窖池底層的菌群結構更有代表性的了解某一地理環境下的窖池窖泥。隨著分子技術水平的不斷發展,要確定窖泥中微生物的精確構成,確定新物種的產生,對新物種代謝和產物的研究,僅靠本文的研究方法是肯定不夠的,這就要結合傳統的技術和新型的研究方法,以排除單一方法存在的缺陷,做出更細致準確的研究成果。
[1]Amann R I,Ludwig W,Schleifer K H.Phylogenetic identification and in situ detection of individual microbial cells without cultivation[J].Microbiological Reviews,1995,59(1):143-149.
[2]Giovannoni S J,Britschgi T B,Moyer C L,et al.Genetic diversity in Sargasso Sea bacterioplankton[J].Nature,1990,345(6270):60-63.
[3]Ward D M,Weller R,Bateson M M,et al.16S rRNA sequences reveal numerous uncultured microorganisms in a natural community[J].Nature,1990,345(6270):63-65.
[4]Brock T D.The study of microorganisms in situ:progress and problems[A].Symposia of the Society for General Microbiology[C],Midsion,1987,41:1-17.
[5]Zhou J Z,Bruns M A,Tiedje J M.DNA Recovery from soils of diverse composition[J].Applied and Environmental Microbiology,1996,62(2):316-322.
[6]趙勇,周志華,李武,等.土壤微生物分子生態學研究中總DNA的提取[J].農業環境科學學報,2005,24(5):854-860.
[7]曹治明,鄭維,權春善.土壤DNA提取方法的研究[J].大連民族學院學報,2005,7(3):94.
[8]陳敏.土壤樣品中DNA提取方法的比較[J].微生物學雜志,2005,25(3):101-104.
[9]宋培勇.從土壤中提取DNA方法比較[J].微生物學雜志,2006,26(1):109-112.
[10]Versalovic J,Koeuth T.Distribution of repetitive DNA sequences in eubacteria and application to fingerprinting of bacterial genomes[J].Nucleic Acids Research,1991,19(24):6823-6831.
[11]Edwards U,Rogall T,Blocker H,et al.Isolation and direct complete nucleotide determination of entire genes characterization of a gene coding for 16S ribosomal RNA[J].Nucleic Acids Research,1989,17(19):7843-7853.
[12]Thompson J D,Gibson T J,Plewniak F,et al.The ClustalX windows interface:Flexible strategies for multiple sequence alignment aided by quality analysis tools[J].Nucleic Acids Research,1997,25:4876-4882.
[13]Tamura K,Dudley J,Nei M,et al.MEGA4:Molecular Evolutionary Genetics Analysis(MEGA)software version 4.0[J].Molecular Biology and Evolution,2007,24:1596-1599.
[14]Frostegard A,Courtois S,Ramisse V,et al.Quantification of bisa related to the extraction of DNA directly from soils[J].Applied and Environmental Microbiology,1999,65:5409-5420.
[15]Drancourt M,Bollet C,Carlioz R,et al.16S ribosomal DNA sequence analysis of a large collection of environmental and clinical unidentifiable bacterial isolates[J].Journal of Clinical Microbiology,2000,38(10):3623-3630.
[16]Janda J M,Abbott S L.Bacterial identification for publication:when is enough enough?[J].Journal of Clinical Microbiology,2002,40:1887-1891.
[17]姚萬春,唐玉明,任道群,等.優良窖泥功能菌的篩選及其生物學特性的初步研究[J].釀酒科技,2010(11):33-35.
[18]喬宗偉,張文學,張麗鶯,等.濃香型白酒發酵過程中酒醅的微生物區系分析[J].釀酒,2005,32(1):32-34.
[19]鄧依,唐云容,張文學.16-23S RNA ITS-AFLP指紋圖譜分析在白酒窖泥細菌多樣性分析中的應用[J].釀酒科技,2010(3):46-48.
[20]張文學,喬宗偉,向文良,等.中國濃香型白酒窖池微生態研究進展[J].釀酒,2004,31(2):31-35.
[21]唐云容,鐘方達,張文學,等.濃香習酒窖泥微生物菌群多樣性及系統發育分析[J].釀酒科技,2011(12):24-28.
ABSTRACTCulture independent method was used to study the diversity of Pit Mud bacteria.The techniques included culture independent approach,PCR technique and 16S rDNA sequence homology analysis etc.The total DNA directly extracted from Pit Mud was used as PCR template.Random clones containing almost full size 16S rDNA sequences(about 1.5 kb)were sequenced and subjected to an on line similarity search.According to the sequences alignment and homology analysis,the bacteria of Pit Mud were consisted of Uncultured bacterium,Clostridium,Lactobacillus,Eubacterium,and Syntrophomonas.
Key wordsGujing-flavor Liquor,Pit Mud,microbiology diversity,culture independent approach,phylogenetic analysis
Phylogenetic Diversity Analysis of Bacteria In Gujing-flavor Liquor Pit Mud Using Culture Independent Method
Tang Bin1,Liu Jin-ying1,Zhou Qing-qu2,Li An-jun2,Wan Chun-huan2,Tang You-hong2
1(Anhui Polytechnic University,Engineering Technology Research Center of Anhui Microbial Fermentation,Wuhu 241000,China)
2(Anhui Gujing Distillery Company Limited,Haozhou 236826,China)
學士,教授。
安徽省自然科學基金(No.KJ2007A018)。
2012-02-28,改回日期:2012-04-27

