熱處理過程中牡蠣閉殼肌肌原纖維蛋白部分理化特性的變化*
陳錚,朱蓓薇,李冬梅,姜鵬飛,趙鑫,鄧麗
(大連工業大學食品學院,國家貝類加工技術研究分中心(大連),遼寧 大 連,116034)
熱處理過程中牡蠣閉殼肌肌原纖維蛋白部分理化特性的變化*
陳錚,朱蓓薇,李冬梅,姜鵬飛,趙鑫,鄧麗
(大連工業大學食品學院,國家貝類加工技術研究分中心(大連),遼寧 大 連,116034)
通過對牡蠣閉殼肌肌原纖維蛋白加熱過程中濁度、溶解度、表面疏水性、α螺旋含量和總巰基含量的測定,研究了熱處理過程中牡蠣閉殼肌肌原纖維蛋白理化特性的變化,結果表明,在20~40℃,牡蠣閉殼肌肌原纖維蛋白溶液的濁度、溶解度、表面疏水性、α螺旋含量和總巰基含量均無明顯變化。在溫度高于40℃時,隨著溫度的升高,牡蠣閉殼肌肌原纖維蛋白的濁度整體呈增大趨勢,46℃下變化最為明顯;溶解度在40~50℃變化最大,結合濁度的變化規律推測其變性溫度為46℃;表面疏水性總體上逐漸增加,在40~50℃變化最大;α螺旋含量總體上逐漸降低,60℃變化最大,當溫度達到70℃時約有80%的α螺旋結構被破壞;總巰基含量逐漸降低,50℃時下降最快。
牡蠣,閉殼肌,熱處理,肌原纖維蛋白,理化特性
牡蠣(Oyster)是世界上第一大養殖貝類,也是我國四大養殖貝類之一,是一種珍貴的海產軟體動物[1]。牡蠣肉質鮮美,蛋白質及糖原含量豐富,富含多種維生素及銅、鐵、鋅、碘等微量元素,尤其是牛磺酸含量豐富,具有很高的營養價值[2]。牡蠣可食部位主要包括外套膜、閉殼肌和內臟囊,其中閉殼肌肌原纖維蛋白含量豐富[3],外套膜膠原蛋白含量較高[4]。
肌原纖維蛋白在不同的環境和加工條件下,通常表現出不同的功能特性[5]。濁度可以反映蛋白質的聚集程度。溶液中蛋白質聚集形成顆粒的數目越多、體積越大,濁度就越大[6]。肌原纖維蛋白的聚集程度影響其形成凝膠的結構[7],進而影響肉類的品質。蛋白質的溶解度影響其熱誘導凝膠性質、起泡性以及肉品的保水性[8],同時溶解度可作為制品過熟程度的判斷指標[9]。疏水作用對蛋白質的穩定性、構象和蛋白質功能具有重大意義。由于蛋白質是大分子結構,表面疏水性影響分子間的相互作用,因此對蛋白質的功能具有較大的影響[10]。α螺旋含量和總巰基含量則是反映肌原纖維蛋白理化性質的重要指標。
熱處理是水產品加工中常用的方法,加熱可以引起蛋白質空間結構的變化以及蛋白質的降解[11]。本實驗通過對牡蠣閉殼肌肌原纖維蛋白在加熱過程中的濁度、溶解度、表面疏水性以及α螺旋含量、總巰基含量的變化進行研究,探尋牡蠣蛋白的熱加工特性,以期對牡蠣資源的有效利用和相關產品的開發提供依據。
1 材料與方法
1.1 材料
1.1.1 原料
新鮮大連灣牡蠣(Crassostrea talienwhanensis),市售。
1.1.2 試劑
Na2HPO4、NaH2PO4、NaCl、二硫蘇糖醇(DTT)、MgCl2、無水CuSO4、NaOH、酒石酸鉀鈉、Tris、尿素(U-rea)、1-苯氨基萘-8-磺酸銨(ANS)等均為分析純;蛋白質分子質量標準品,寶生物工程(大連)有限公司。
1.1.3 主要儀器
T25數顯勻漿機,德國IKA;Z-323K冷凍離心機,德國HERMLE;UV-2100型紫外可見分光光度計,尤尼柯(上海)儀器有限公司;pH計,上海鵬順科學儀器有限公司;HH-4數顯恒溫水浴鍋,江蘇省金壇市榮華儀器制造有限公司;JM-250型電泳儀,大連捷邁科貿有限公司;熒光光譜儀,美國PE公司;J-810型圓二色譜儀,日本JASCO公司。
1.2 實驗方法
1.2.1 牡蠣閉殼肌肌原纖維蛋白的提取
牡蠣閉殼肌肌原纖維蛋白的提取參照王耀耀等[12]的方法進行,并根據實際情況進行改進。牡蠣開殼后取閉殼肌洗凈、切碎,加入少量水洗液(10 mmol/L的磷酸鹽緩沖液,pH 7.0,含40 mmol/LNaCl,0.5 mmol/L DTT和1 mmol/L MgCl2)打漿30 s,再加入20倍體積(mL/g)的水洗液,10000 r/min間歇勻漿4 min。所得勻漿物在12000 r/min離心6 min,將所得沉淀按照上述步驟重復處理2次。向第3次所得沉淀中加入10倍體積(mL/g)的提取液(10 mmol/L的磷酸鹽緩沖液,pH 7.0,含0.6 mol/L NaCl),10000 r/min間歇勻漿4 min,然后將勻漿液在13500 r/min離心15 min,所得上清液即為牡蠣閉殼肌肌原纖維蛋白溶液。以上操作均在4℃下進行。
1.2.2 蛋白質濃度的測定
采用雙縮脲法[13]對蛋白質濃度進行測定,用牛血清蛋白(BSA)作為標準蛋白。
1.2.3 牡蠣閉殼肌肌原纖維蛋白的熱處理方法
參照王耀耀等[12]的方法對牡蠣閉殼肌肌原纖維蛋白進行熱處理,并稍作修改。在低于90℃范圍內,固定升溫速率為1.3℃/min,考察溫度點選擇為20、30、40、50、60、70、80和90℃,當溫度達到相應值時立即取出試管并用流水冷卻。
1.2.4 濁度的測定
參照Liu等[14]的方法,將肌原纖維蛋白溶液調整至2 mg/mL,取不同溫度加熱后的樣液各3 mL,在350 nm下測定吸光度,實驗重復3次取平均值。
1.2.5 溶解度的測定
測定濁度后的蛋白溶液在4℃、13500 r/min下離心15 min,取上清液,參照徐幸蓮等[15]方法測定蛋白質溶解度。
1.2.6 表面疏水性的測定
牡蠣閉殼肌肌原纖維蛋白表面疏水性的測定參照Benjakul等[16]的方法進行,使用1-苯氨基萘-8-磺酸銨(ANS)作為熒光探針,并做了一些改進。取不同濃度并進行熱處理后的ANS-蛋白質復合物,在熒光激發波長為383 nm、吸收波長為483 nm下測定其熒光吸收強度。以ANS-蛋白質復合物的熒光強度與蛋白質濃度作圖,用直線斜率來表示牡蠣閉殼肌肌原纖維蛋白的表面疏水性。
1.2.7 α螺旋含量的測定
α螺旋含量的測定參照Wang等[17]的方法進行,并稍作改進。取已調整到一定濃度的肌原纖維蛋白溶液進行加熱處理。加熱處理完畢后,用圓二色譜儀測定各溫度點肌原纖維蛋白溶液的橢圓率。比色皿的光程為0.1 cm。α螺旋結構含量值計算:

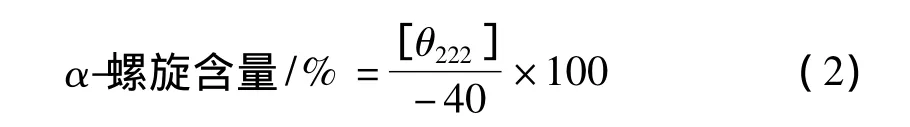
式中[θ]222為222 nm處的摩爾橢圓率,deg·cm2/dmol;[θ]obs為橢圓率,deg;MW為肌原纖維蛋白平均氨基酸殘基分子量,取值為115 g/mol;L為比色皿光程長度,cm;C為肌原纖維蛋白濃度,mg/mL。
1.2.8 總巰基含量的測定
參照Wang等[17]的方法對總巰基含量進行測定。將肌原纖維蛋白溶液稀釋到2 mg/mL。取0.5 mL肌原纖維蛋白溶液加熱處理,然后向其中加入4.5 mL Tris-HCl緩沖液(含8 mol/L尿素,2%SDS和10 mmol/L EDTA,pH 6.8,0.2 mol/L),再加入0.5 mL 10%DTNB,混勻后40℃保溫25 min,在412 nm下測定吸光值。空白為含NaCl(0.6 mol/L)的磷酸鹽緩沖液(10 mmol/L,pH 7.0)。計算總巰基含量:
總巰基含量

式中,A412表示在412 nm時的吸光值;V總表示測定時蛋白質溶液的總體積,mL;13600為摩爾吸光系數,mol/(cm·L);L為光程,cm;V表示蛋白溶液體積,mL;C表示蛋白質溶液的濃度,單位mg/mL。
1.2.9 數據處理
熱處理過程中牡蠣閉殼肌肌原纖維蛋白溶液濁度、溶解度、表面疏水性、α螺旋含量和總巰基含量的變化率分別按照下面的公式進行計算:
某溫度下濁度的變化率=(后一溫度下的濁度值-當前的濁度值)/相鄰點的溫度差值
某溫度下溶解度的變化率=(前一溫度下的蛋白濃度-該溫度下的蛋白濃度)/相鄰點的溫度差值
某溫度下的表面疏水性的變化率=(后一溫度下的表面疏水性-該溫度下的表面疏水性)/相鄰點的溫度差值
某溫度下的α螺旋含量的變化率=(前一溫度下的α螺旋含量-該溫度下的α螺旋含量)/相鄰點的溫度差值
某溫度下的總巰基含量的變化率=(前一溫度下的總巰基含量-該溫度下的總巰基含量)/相鄰點的溫度差值
2 結果與討論
2.1 熱處理對牡蠣閉殼肌肌原纖維蛋白濁度的影響
由圖1可以看出,牡蠣閉殼肌肌原纖維蛋白溶液的濁度隨溫度升高整體呈現增大趨勢。30~44℃時濁度變化不明顯,表明在此溫度范圍內蛋白質沒有發生明顯的變性聚集;44~58℃時濁度增加趨勢較為明顯。Paredi等[18]報道,扇貝肌球蛋白的變性溫度為41.7~55.0℃,而牡蠣肌原纖維蛋白濁度從44℃開始增加,可以推測可能是由于肌球蛋白的變性聚集引起的。當溫度超過58℃,濁度隨溫度升高繼續上升,表明此時蛋白聚集物的結構變得致密,但變化趨勢較44~58℃區間略平緩,說明蛋白質聚集物在生成過程要較蛋白質聚集物變得致密過程中濁度的上升更為明顯。變化率有1個較大的峰值是46℃,表明46℃時牡蠣肌原纖維蛋白濁度變化最為明顯。

圖1 熱處理對牡蠣閉殼肌肌原纖維蛋白濁度的影響
2.2 熱處理對牡蠣閉殼肌肌原纖維蛋白溶解度的影響
由圖2可知,在濃度為2 mg/mL條件下,30~40℃時,牡蠣閉殼肌肌原纖維蛋白溶解度變化不明顯,說明在此溫度范圍內蛋白質未發生明顯變性,而濁度在此溫度范圍內的變化不明顯也可進一步反映出蛋白質變性的情況;40~50℃時,溶解度明顯降低,說明此時蛋白質發生了明顯的變性聚集,濁度在此溫度范圍內也明顯升高,這是由于加熱促使蛋白質空間結構發生變化,疏水基團暴露后發生聚集導致的;當加熱溫度超過50℃,溶解度先緩慢下降后又逐漸上升,反映出在這個溫度范圍內蛋白質的變性情況;變化率的最大峰值為50℃,結合溶解度的變化趨勢,可以進一步表明在40~50℃,溶解度的變化最為明顯,變性程度最大,同時濁度在46℃時變化率達到最高峰,可以推測出46℃可能是牡蠣閉殼肌肌原纖維蛋白的變性溫度。
2.3 熱處理對牡蠣閉殼肌肌原纖維蛋白表面疏水性的影響

圖2 熱處理對牡蠣閉殼肌肌原纖維蛋白溶解度的影響
當溫度低于40℃時,牡蠣閉殼肌肌原纖維蛋白結構相對穩定,表面疏水性略有增加,變化趨勢與溶解度和濁度的變化趨勢相近;40~80℃時,隨著溫度升高,肌原纖維蛋白疏水性氨基酸殘基逐漸暴露,疏水性明顯增加。此溫度范圍內疏水性的增加經歷了2個階段:第1個階段為40~60℃,第2個階段為60~80℃。結合1.3.9中表面疏水性變化率公式,變換率峰值最高時為40℃,可以得出溫度在40~50℃之間時,肌原纖維蛋白的表面疏水性變化最為明顯。這與Benjakul等[16]對魚類肌原纖維表面疏水性的變化趨勢一致。結合肌原纖維蛋白在加熱過程中表面疏水性、濁度、溶解度的變化趨勢可以明顯地反映出蛋白質的變性情況及其變化規律。

圖3 熱處理對牡蠣閉殼肌肌原纖維蛋白表面疏水性的影響
2.4 熱處理對牡蠣閉殼肌肌原纖維蛋白α螺旋含量的影響
當加熱溫度在20~40℃時,牡蠣閉殼肌肌原纖維蛋白的α螺旋含量變化不明顯,約為39%~41%;40~70℃時,α螺旋含量隨著溫度的升高明顯降低,表面蛋白質的空間結構發生了明顯的變化,逐漸完成了從二級結構(α螺旋、β折疊)到三級或四級結構的變化;同時,由于此時蛋白質的部分變性使一些天然態內埋藏的疏水肽段暴露于溶劑中而有效地改變了蛋白的表面性質,從而導致在此溫度范圍內蛋白質的表面疏水性也發生了明顯變化。當加熱溫度升至70℃時,牡蠣閉殼肌肌原纖維蛋白的α螺旋含量降至8%左右,較加熱前約有80%的α螺旋的結構被破壞,而溫度在70~90℃時α螺旋含量隨溫度變化不明顯。變化率峰值最高時為60℃,說明在60℃左右肌原纖維蛋白的α螺旋含量變化最為明顯。以上研究結果與Wang等[17]報道的熱處理對豬肉中肌動球蛋白的α螺旋含量變化趨勢一致。
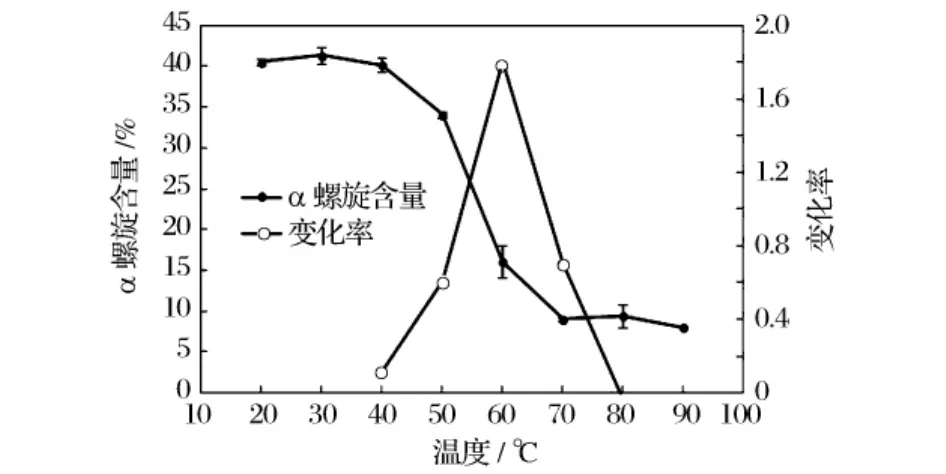
圖4 熱處理對牡蠣閉殼肌肌原纖維蛋白α螺旋含量的影響
2.5 熱處理對牡蠣閉殼肌肌原纖維蛋白總巰基含量的影響
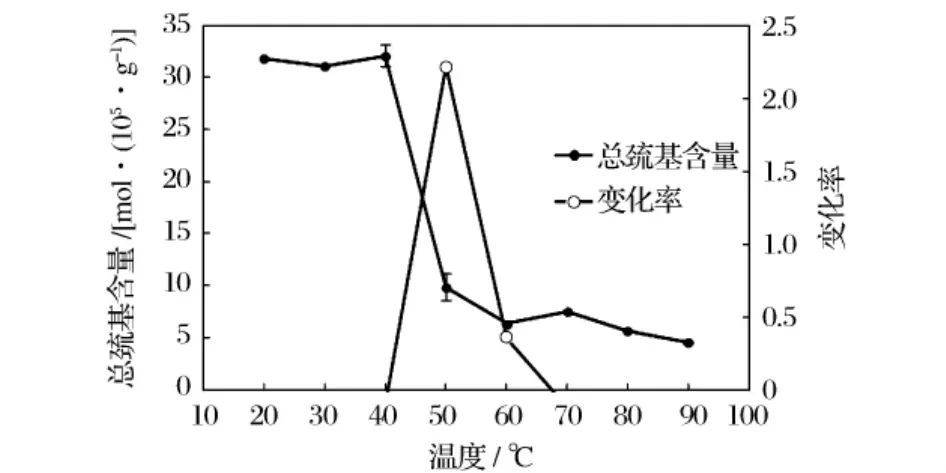
圖5 熱處理對牡蠣閉殼肌肌原纖維蛋白總巰基含量的影響
由圖5可知,牡蠣閉殼肌肌原纖維蛋白在常溫(20℃)下總巰基含量約為33 mol/105g蛋白。20~40℃加熱過程中肌原纖維蛋白的總巰基含量的變化趨勢與濁度、表面疏水性、溶解度、α螺旋含量等的變化趨勢相似。當溫度在40~90℃之間時,總巰基含量逐漸降低,這是由于蛋白質變性使含巰基基團的活性區域暴露,導致巰基更易被氧化,從而引起總巰基含量的下降。其中在40~60℃之間時下降尤其明顯,變化率在50℃存在一個最大峰值,也反映出此溫度范圍內總巰基含量的變化最明顯,60~90℃之間時總巰基含量下降趨勢較40~60℃之間平穩,該結果與姚磊等[19]研究鯽肌原纖維蛋白加熱過程中的總巰基含量變化基本一致。表明牡蠣閉殼肌肌原纖維蛋白從40℃時開始有大分子物質產生,而濁度、表面疏水性、溶解度、α螺旋含量以及總巰基含量也恰好在40℃左右開始發生變化,在40~60℃時之間均表現出較為明顯的變化規律。
3 結論
(1)熱處理溫度在20~40℃時,牡蠣閉殼肌肌原纖維蛋白溶液的濁度、溶解度、表面疏水性、α螺旋含量和總巰基含量均無明顯變化。在溫度高于40℃時,隨著溫度的升高,濁度和表面疏水性整體呈逐漸增加的趨勢,溶解度、α螺旋含量和總巰基含量整體呈逐漸降低的趨勢;
(2)牡蠣閉殼肌肌原纖維蛋白的溶解度在40~50℃之間時變化最大,濁度在46℃條件下變化最大,由此推測其變性溫度為46℃。
[1]葉盛權,鄭賢德,黃甫.牡蠣冷凍加工工藝[J].冷飲與速凍食品工業,2003,9(1):12-13.
[2]董曉偉,姜國良,李立德,等.牡蠣綜合利用的研究進展[J].海洋科學,2004(4):62-65.
[3]Cruz-Romero M,Smiddy M,Hill C.Effects of high pressure treatment on physicochemical characteristics of fresh oysters(Crassostrea gigas)[J].Innovative Food Science and Emerging Technologies,2004(5):161-169.
[4]Mizuta S,Miyagi T,Yoshinaka R.Characterization of the quantitatively major collagen in the mantle of oyster Crassostrea gigas[J].Fisheries Science,2005,71(1):229-235.
[5]羅永康,潘道東,沈慧星,等.蛋白質濃度、pH、離子強度對鰱魚肌原纖維蛋白黏度的影響[J].食品與發酵工業,2004,30(7):52-54.
[6]Thorarinsdottir K A,Arason S,Geirsdottir M,et al.Changes in myofibrillar proteins during processing of salted cod(Gadus morhua)as determined by electrophoresis and differential scanning calorimetry[J].Food Chemistry,2002,77(3):377-385.
[7]費英,韓敏義,楊凌寒,等.pH對肌原纖維蛋白二級結構及其熱誘導凝膠特性的影響[J].中國農業科學,2010,43(1):164-170.
[8]Vani B,Zayas J F.Foaming properties of selected plant and animal proteins[J].Journal of Food Science,1995,60(5):1025-1028.
[9]丁麗敏.蛋白溶解度作為評定豆粕過熟程度指標的研究[J].中國農業大學學報,1998,3(001):105-109.
[10]Sheard P R,Fellows A,Ledward D Aaa,et al.Macromolecular charges Associated with the heat treatment of soya isolate[J].Food Technology,1988,21:55-60.
[11]朱蓓薇.海珍品加工理論與技術的研究[M].北京:科學出版社,2010.
[12]王耀耀,朱蓓薇,董秀萍,等.鮑魚腹足肌原纖維蛋白的組成及其性質[J].大連工業大學學報,2011(3):183-186.
[13]袁道強,黃建華.生物化學實驗和技術[M].北京:中國輕工業出版社,2006.
[14]Liu M N,Foegeding E A,Wang S F,et al.Denaturation and aggregation of chicken myosin isoforms[J].Journal of Agricultural and Food Chemistry,1996,44(6):1435-1440.
[15]徐幸蓮,韓敏義,林麗軍,等.兔骨骼肌肌球蛋白溶液濁度和溶解度研究[J].南京農業大學學報,2003,26(4):93-96.
[16]Benjakul S,Visessanguan W,Ishizaki S,et al.Differences in gelation characteristics of natural actomyosin from two species of bigeye snapper,Priacanthus tayenus and Priacanthus macracanthus[J].Journal of Food Science,2001,66(9):1311-1318.
[17]Wang H,Pato M,Pietrasik Z,etal.Biochemical and physicochemical properties of thermally treated natural actomyosin extracted from normal and PSE pork Longissimus muscle[J].Food Chemistry,2009,113(1):21-27.
[18]Paredi M E,Tomas M C,Crupkin M.Thermal denaturation of myofibrillar proteins of striated and smooth adductor muscles of scallo p(Zyg ochlamy s patag onica).A differential scanning calor imetric study[J].Journal of Agricultural and Food Chemistry,2002,50:830-834.
[19]姚磊,羅永康,沈慧星,等.鯽肌原纖維蛋白加熱過程中理化特性變化規律[J].水產學報,2010(8):1303-1308.
ABSTRACTThe effects of heat treatment on the physiochemical properties changes of myofibrillar proteins from oyster adductor muscle including turbidity,solubility,surface hydrophobicity,α helix content and total sulphydryl content were investigated.The results showed that all the above indicators remained invariable when the heating temperature was 20~40℃.When the temperature was higher than 40℃,obvious changes of the above indicators were obtained.As the temperature rised,the turbidity of the oyster myofibrillar proteins increased gradually and changed remarkably at 46℃.The solubility and surface hydrophobicity both changed obviously during 40~50℃and the denaturation temperature was determined to be 46℃.The α helix content of myofibrillar protein decreased gradually and the most rapid changes occurred at 60℃.About 80%of the α helix was damaged when the temperature increased to 70℃.The total sulphydryl content decreased gradually when the temperature was higher than 40℃,and the most obvious changes were observed at 50℃.
Key wordsoyster,adductor muscle,heat treatment,myofibrillar protein,physiochemical properties
Physiochemical Changes of Myofibrillar Protein from Oyster Adductor Muscle During Heat Treatment
Chen Zheng,Zhu Bei-wei,Li Dong-mei,Jiang Peng-fei,Zhao Xin,Deng Li
(School of Food Science and Technology,Dalian Polytechnic University,National R&D Branch Center for Shellfish Processing(Dalian),Dalian 116034,China)
碩士研究生(李冬梅為通訊作者)。
*國家十二五“863”計劃主題項目新型水產品加工裝備開發與新技術研究(編號:2011AA100803)
2011-12-03,改回日期:2012-02-25

