膜分離純化羅漢果蛋白酶的研究
蘇小建,黃世好,陳廣仁,秦少艷,謝麗霞,黃繼來
(廣西師范大學化學與化工學院,廣西桂林541004)
膜分離純化羅漢果蛋白酶的研究
蘇小建,黃世好,陳廣仁,秦少艷,謝麗霞,黃繼來
(廣西師范大學化學與化工學院,廣西桂林541004)
應用超濾技術對經硫酸銨法濃縮的羅漢果粗酶進行分離純化,采用截留分子量為10萬、5萬和1萬的超濾膜對羅漢果粗酶進行分離,用酪蛋白法和考馬斯亮藍染色法分別測定酶活和蛋白質含量。研究發現酶活與蛋白質主要分布在相對分子量為10萬以上和5萬與1萬之間,相對分子量為10萬以上酶活占總酶活的28.0%,酶比活提純了1.88倍,蛋白質量占總蛋白質量的31.7%;相對分子量為5萬和1萬之間的酶活占總酶活的31.2%,酶比活提純了2.43倍,蛋白質量占總蛋白質量的33.8%。
羅漢果粗酶;膜分離;酶活;硫酸銨法
Abstract:Siraitia Grosvenorii crude enzyme of ammonium sulfate concentration were isolated and purified by Ultrafiltration technique.Then it was separated by using the ultrafiltration membrane whose molecular weight cut off is 10 million,50000 and 10000 separately.After that,it can use Casein and Coomassie brilliant blue method to measure the enzyme activity and protein content.The research found that the enzyme activity and protein mainly were distributed in molecular weight which was more than 10 million or between 50000-10000.Molecular weight of 10 million or more activity in 28.0%of the total activity of the enzyme specific activity was 1.88 times purification,protein 31.7%of the total protein;relative molecular weight of 50000 and 10000 of the total enzyme activity between 31.2%live,enzyme specific activity was 2.43 times purification,protein 33.8%of the total protein.
Key words:Siraitia grosvenorii crude enzyme;membrane separation;enzyme activity;ammonium sulfate method
羅漢果是我國的特有資源,有關羅漢果產品的開發利用呈急劇上升趨勢,但2000年對羅漢果的研究開發與應用主要集中于羅漢果中的甜甙和黃酮[1],而果實中大量的有效成分如蛋白酶、蛋白質、氨基酸等并沒有得到重視和充分利用,相關的文獻報道也很少。據研究[2]表明鮮羅漢果中含有對酪蛋白高水解活性的蛋白酶,蛋白酶是目前工業用酶的三大主要酶制劑之一,是工業酶種中用得最多的一種酶,約占酶總量的60%,在相同條件下,羅漢果蛋白酶活性是木瓜蛋白酶活性的10倍以上,具有很高的開發利用價值。本實驗提高了羅漢果有效成分的利用率和產品附加值,為充分利用優質羅漢果資源開辟一條新的途徑。
1 材料與方法
1.1 材料
羅漢果蛋白酶[3]:由廣西師范大學思特新技術公司提供。
1.2 儀器與設備
SJM-GDM-01型多功能有機膜設備:合肥世杰膜工程有限責任公司;DR2800分光光度計:美國哈希公司;pHS-3C精密pH計:上海精密科學儀器有限公司;LXJ-Ⅱ型離心沉淀機:上海醫用分析儀器廠;TDL-50B型低速臺式大容量離心機:上海安亭科學儀器廠;電熱恒溫水浴鍋:上海醫療器械廠。
1.3 方法
1.3.1 硫酸銨沉淀法[4]
稱取50 g粗酶于燒杯中,加蒸餾水搖勻至完全溶解,將燒杯放在另一裝有冰水的大燒杯里,并置于磁力攪拌器上攪拌,在5min~10min內邊攪拌邊徐徐加入硫酸銨至飽和度為50%,繼續攪拌20 min;3000 r/min離心30 min;棄去上清液,將沉淀懸浮于2倍沉淀物體積的緩沖液中,離心除去殘留的不溶物。得到20 L殘留物濃度為1%左右的羅漢果蛋白酶汁。
1.3.2 蛋白質含量的測定(考馬斯亮藍染色法[5])
1)標準蛋白質溶液:稱取10 μg牛血清白蛋白溶于100 mL蒸餾水中,至標準蛋白質濃度100 μg/mL。
2)樣品測定:取蛋白質溶液樣品1.0 mL于試管中,加入5.0 mL考馬斯亮藍G-250試劑,搖勻,靜置5 min,在595 nm處測定吸光度,記錄A595。根據所測A595,對照牛血清白蛋白標準曲線確定所測蛋白質的濃度。
標準曲線的繪制:取6只試管,按表1加入各試劑。加入考馬斯亮藍G-250蛋白試劑后搖勻,靜置2 min后在595 nm處測定并記錄A595。以不同濃度的牛血清白蛋白(1 μg/mL~10 μg/mL)為橫坐標,A595為縱坐標,作標準曲線。
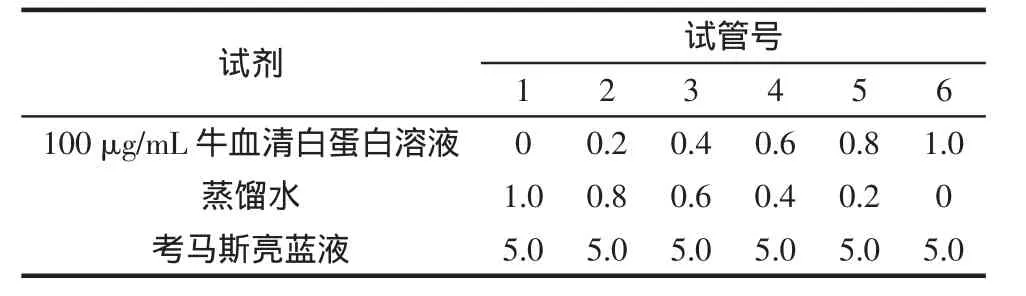
表1 標準曲線溶劑配加表Table 1 Standard curve of solvent with addition of tablemL
1.3.3 羅漢果蛋白酶酶活的測定(酪蛋白法[6])
準確量取10 mL待測樣品于100 mL容量瓶中,加蒸餾水定容(稀釋倍數可示樣品而定,稀釋后固體含量為0.15 mg/mL),搖勻。準確量取1 mL,置具塞試管中于(37±0.2)℃水浴中保溫10 min,精密量取在(37±0.2)℃中保溫的酪蛋白溶液5 mL,迅速加入混勻,同時啟動秒表,準確反應10 min,立即加入三氯醋酸溶液5 mL,搖勻,離心 15 min(4000 r/min),取上清液。另取1 mL樣品溶液,按上述方法交換酪蛋白與三氯醋酸溶液的添加次序進行試驗,取上清液作空白,在595 nm處測定吸光度A。
準確量取酪氨酸標準品50 mg,置于1000 mL容量瓶中,加0.1 mol/L鹽酸定容搖勻,以蒸餾水作空白,在595 nm處測定吸光度As。
2 結果與討論
2.1 試驗數據及處理結果
2.1.1 標準曲線繪制結果
所得的標準曲線在 2.0 μg/mL~10 μg/mL濃度范圍內保持線性關系,結果如圖1。

2.1.2 羅漢果蛋白酶酶活的測定結果
在595 nm處測定吸光度As,經測定得As=0.266。
計算每克羅漢果蛋白酶活力單位表述的公式為:

2.1.3 膜分離前后羅漢果蛋白酶成分的分布
在室溫(23℃)與操作壓力0.05 MPa條件下,把50 g粗酶經硫酸銨法濃縮的羅漢果粗酶溶液依次用切割分子量為10萬、5萬和1萬的濾膜進行滲濾(見圖1),羅漢果蛋白酶溶液則被分為3份(切割分子量為1萬的膜作用是把1萬~5萬濾液濃縮),得到膜分離前后相關數據如表2。
2.2 羅漢果粗酶酶活的分布
酪蛋白法測過膜前及過膜后每段溶液中總酶活的含量,得總酶與酶比活比較與分布見圖2和圖3。

表2 多功能有機膜分離前后的有關數據Table 2 Multifunctional organic membrane separation before and after the relevant data
注:附表中相關數據計算過程為總酶活力(kat)=酶活(kat/mL)×體積(L)× 1000;酶比活(kat/g)= 總酶活力(kat)/總蛋白質含量(g);酶活提純倍數=每一步的酶比活(kat/g)/粗酶比活(kat/g);蛋白質量=蛋白質百分數(%)×總固重。

從圖2和圖3可以看出:粗酶用硫酸銨法濃縮處理后總酶活4412.77 kat,比處理前粗酶的6464.17 kat少了2051.4 kat,損失了31.7%,酶比活168.54 kat/g,提純了1.30倍;再經不同孔徑的超濾膜分離后,相對分子量為10萬以上的總酶為1820.87 kat,占總酶活的28.0%,酶比活為243.46 kat/g,提純了1.88倍;相對分子量為5萬~10萬的總酶為107.48 kat,占總酶活的0.2%,酶比活為15.26 kat/g;相對分子量為1萬~5萬的總酶為2017.13 kat,占總酶活的31.2%,酶比活為297.20 kat/g,提純了2.29倍;可見粗酶經硫酸銨法濃縮再經不同孔徑的超濾膜分離后,酶活主要分布在相對分子量為10萬以上和1萬~5萬之間,而5萬~10萬之間僅有極少量的酶活。超濾分級純化可以很方便的得到羅漢果蛋白酶酶活的相對分子量分布,對羅漢果蛋白酶純化及藥理作用都有指導意義。
3 結論
羅漢果粗酶經硫酸銨法濃縮再經不同孔徑的超濾膜分離后,酶活與蛋白質主要分布在相對分子量為10萬以上和1萬~5萬之間。相對分子量為10萬以上的酶活占總酶活的28.0%,酶比活提純了1.88倍,蛋白質量占總蛋白質量的31.7%;相對分子量為1萬~5萬之間的酶活占總酶活的31.2%,酶比活提純了2.43倍,蛋白質量占總蛋白質量的33.8%;兩者之和占了總酶活的59.2%,占總蛋白質的65.5%,具有很高的開發利用價值。
[1]陳全斌,阮誼波,李曉英,等.廣西科研工作者對羅漢果研究現狀分析[J].廣西輕工業,2007,103(6):14-15
[2]蘇小建,梁成欽,何星存,等.羅漢果蛋白酶的提取方法比較[J].食品工業科技,2007,28(2):157-162
[3]劉國雄.羅漢果蛋白酶的分離純化及性質研究[D].廣西師范大學,2007:27,39-40
[4]汪家政,范明.蛋白質技術手冊[M].北京:科學出版社,2000:65-67
[5]俞建瑛,蔣宇,王善利.生物化學實驗技術[M].北京:化學工業出版社 2005:177-178
[6]施特爾馬赫.酶的測定方法[M].錢嘉淵,譯.北京:中國輕工業出版社,1992:47-48
[7]江信江.黃鱔蛋白酶分離純化、性質與應用研究[D].重慶:西南師范大學,2005:19-20
[8]馬利華,秦衛東,陳學紅,等.膜分離技術純化牛蒡多糖的研究[J].食品工業科技,2009(1):231-233
[9]王學松.現代膜技術及其應用指南[M].北京:化學工業出版社,2005:14-15
Studies on Membrane Separation and Purification of Siraitia Grosvenorii Protease
SU Xiao-jian,HUANG Shi-hao,CHEN Guang-ren,QIN Shao-yan,XIE Li-xia,HUANG Ji-lai
(Guangxi Normal University,Guilin 541004,Guangxi,China)
2012-01-11
廣西環境工程與保護評價重點實驗室項目(200912)
蘇小建(1957—),男(漢),教授級高級工程師,碩士,主要從事天然產物的研究與開發。

