EF-hand對鈣調磷酸酶B同源蛋白2的生物學功能影響
張洪菊 李慶華 王立洪 藺亞妮 常國強 龐天翔
中國醫學科學院北京協和醫學院血液學研究所血液病醫院實驗血液學國家重點實驗室,天津 300020
鈣調磷酸酶B同源蛋白 (calcineurin B homologous protein,CHP)是具有多個 EF-hand 結構的鈣離子(Ca2+)結合蛋白。目前報道該家族擁有3個成員,分別被命名為CHP1、CHP2、CHP3[1]。其中CHP1 廣泛表達于各種組織,CHP3 特異性表達在一些正常組織,而CHP2 與這兩個成員不同,它主要表達在一些腫瘤組織中[2]。最初因發現其在肝癌組織中高表達而命名為肝細胞癌抗原520(hepatocellular carcinoma antigen520,HCA520)[3],因此被認為是一種腫瘤相關抗原。CHP2 已被證明在腫瘤細胞的增殖、轉移等方面具有重要作用[4],目前的研究表明CHP2 主要是通過調節鈉氫離子交換蛋白 1(Na+/H+exchanger 1,NHE1)活性而發揮功能,通過與NHE1 結合而激活NHE1,發揮其調控細胞內離子轉運及細胞酸堿的功能[5-6]。但是,CHP2 作為一個Ca2+結合蛋白,EF-hand是其分子中結合Ca2+的關鍵序列,對CHP2 發揮正常功能具有重要作用,目前國內尚缺乏EF-hand對CHP2 細胞內定位、功能以及與NHE1的相互作用中的影響的報道,本研究將對這些內容進行探討。
1 材料與方法
1.1 實驗試劑及材料
45CaCl2購自美國Dupont-NEN公司。NHE表達缺陷的PS120 細胞系、CHP2 和NHE1的兔抗人多克隆抗體及野生型人NHE1的真核細胞表達質粒pECE均由日本國立循環系統疾病中心研究所饋贈。E.Coli(BL21-star)、LipofectamineTM2000 Reagent kit購自美國Invitrogen公司。DMEM培養基、胎牛血清購自美國GIBCO公司。本實驗中所用到的其他質粒均為本實驗室保存。
1.2 細胞培養
PS120 及相應的轉染子按常規方法在(含25mmol/L NaHCO3、體積分數為10%的小牛血清、50 U/mL青霉素和50 μg/mL鏈霉素)DMEM培養基中培養于37℃,含5%CO2,飽和濕度的培養箱中。
1.3 CHP2 cDNA的克隆及其表達載體的構建
提取人類血液細胞的總RNA,逆轉錄成cDNA,采用PCR擴增CHP2的全長cDNA序列,將其在合適的酶切位點克隆進含有綠色熒光蛋白標記基因的載體pEGFP-N1,對此重組質粒命名為CHP2-GFP。同時采用基于PCR突變的方法,將四個EF-hand的-Z點的氨基酸替換為脂肪族的非極性氨基酸丙氨酸(Ala,A),這些突變EF-hand的重組質粒分別命名為 CHP2-EF1m、CHP2-EF2m、CHP2-EF3m、CHP2-EF4m。
1.4 重組質粒的轉染
應用LipofectamineTM2000將上述重組質粒轉染PS120細胞,轉染完成24 h后利用G418 篩選兩周,采用流式細胞儀,根據GFP熒光標記分選得到含有相關重組質粒的單克隆細胞株。
1.5 重組蛋白的制備
將CHP2 及其突變體的全長cDNA序列克隆到pET11(重組蛋白末端將帶有6個組氨酸的標記)載體中,轉化大腸桿菌 E.Coli(BL21-star)制備重組蛋白 His tagged-CHP2。重組蛋白利用Ni+離子交換型樹脂分離純化重組蛋白。
1.6 SDS-PAGE蛋白質電泳檢測CHP2 蛋白的表達及利用GFP熒光觀察蛋白定位
將分離純化后的重組CHP2 蛋白進行SDS-PAGE凝膠電泳,利用考馬斯亮藍染色法,檢測純化的重組蛋白的分子量及其在聚丙烯酰胺凝膠上的泳動速度。
將共轉染由GFP標記的CHP2 或其突變體重組質粒及野生型人NHE1的真核細胞表達質粒的PS120 細胞采用爬片法培養,待細胞長至合適密度后,采用4%多聚甲醛固定,制片,采用激光共聚焦顯微鏡觀察GFP熒光在細胞內的分布。
1.7 Ca2+結合特征常數的測定
將分離純化得到的CHP2 及其突變體的重組蛋白與不同濃度的45Ca2+在25℃共同孵育60 min。孵育完成后將反應的溶液體系經過0.2 μm的濾膜過濾,以不含重組蛋白的反應溶液體系作為陰性對照,待濾膜干燥后,采用放射性檢測儀計量45Ca2+的在膜上的殘留程度。以加入反應體系的Ca2+含量為橫坐標,以膜上殘留的45Ca2+為縱坐標作圖,制作Ca2+平衡曲線。比較CHP2 野生型及不同的突變體45Ca2+結合特征常數的異同。
1.8 蛋白質免疫共沉淀(Co-Immunoprecipitation,Co-IP)
1.8.1 細胞裂解 收獲過表達NHE1的1 ×107PS120 細胞,用預冷的PBS洗兩次,用細胞刮刮下細胞置于1.5mL離心管里,加入1 mL IP細胞裂解液,之后4 000 r/min離心5min,吸取上清。
1.8.2 免疫沉淀 (IP)將上述的含蛋白提取物的上清液中加入30 μL的Protein G agarose,同時加入 4 μg特異抗體 (抗CHP2 或 NHE1),4℃輕微搖動 1 h,2 000 r/min 離心,棄上清,用預冷的IP細胞裂解液洗沉淀3次,加入2 ×蛋白上樣緩沖液,沸水煮3 min,吸上清。
1.8.3 電泳和轉膜 將所得到的上清上樣,先用SDS-PAGE電泳,再用半干法電轉移至硝酸纖維素膜。再用另一種蛋白的抗體雜交,如果能得到特異的帶,而陰性對照(IgG)沒有帶,證明兩種蛋白相互結合。
1.8.4 蛋白免疫印記 (IB)分別在室溫下用含5%脫脂奶粉的TBST封閉1 h,一抗(抗NHE1 或CHP2)孵育1 h,二抗孵育1 h,ECL化學發光法顯色,每個樣本至少重復3次。
1.9 血清饑餓實驗
相同數量的共表達NHE1/野生型CHP2(NHE1/CHP2)或NHE1/CHP2-EF3m/4m的PS120 細胞接種于培養瓶內,分別觀察在有血清或無血清培養條件下細胞狀態及數量變化。
1.10 統計學方法
采用統計軟件SPSS 11.0 對實驗數據進行分析,計量資料數據以均數±標準差(±s)表示,以P<0.05 為差異有統計學意義。45Ca2+結合平衡采用公式:45Ca2+=最大45Ca2+結合量/(1+Kd-[Ca2+]n)(Kd=Ca2+顯性解離常數,n=Hill系數)計算。
2 結果
2.1 EF-hand調節CHP2 蛋白的構象
經生物信息學方法分析表明CHP2 蛋白結構內含有4個可能的 EF-hand 結構,分別命名為 EF1、EF2、EF3、EF4。 本研究分別成功構建了CHP2 蛋白的4個EF-hand突變體CHP2-EF1m、CHP2-EF2m、CHP2-EF3m、CHP2-EF4m,突變點位于EF-hand的-Z點(圖1A)。將大腸桿菌產物表達純化后得到的CHP2 及其突變體蛋白采用SDS-PAGE檢測,發現已突變的CHP2-EF3m、CHP2-EF4m在凝膠上的電泳速度減慢,表明突變這兩個EF-hand可能使CHP2 蛋白構象的發生改變(圖1B)。結果提示EF-hand3 和EF-hand4 對維持CHP2的正常構象發揮重要的作用。
2.2 CHP2 結合Ca2+平衡曲線的測定
使用膜截留法測定了EF-hand突變對CHP2 鈣結合能力的影響。結果顯示突變EF-hand3 和EF-hand4 中任意一個,CHP2 結合鈣能力下降為正常的1/2;同時突變EF-hand3和EF-hand4,CHP2 不能結合Ca2+(圖2)。證實 CHP2 作為一個鈣結合蛋白,其Ca2+離子的結合依賴于其分子結構中的EF-hand3 和EF-hand4 模體結構。
2.3 Ca2+影響CHP2 和NHE1 蛋白的相互結合
免疫共沉淀實驗表明,在Ca2+存在的條件下,NHE1 和CHP2 能夠得到很好的共沉淀,但當利用螯合劑EDTA剝奪細胞內的Ca2+之后,CHP2 和NHE1的相互結合減少,表明CHP2 結合Ca2+對其與NHE1的結合是至關重要的。見圖3。
2.4 EF-hand3 和EF-hand4 調節CHP2 在細胞膜上的定位
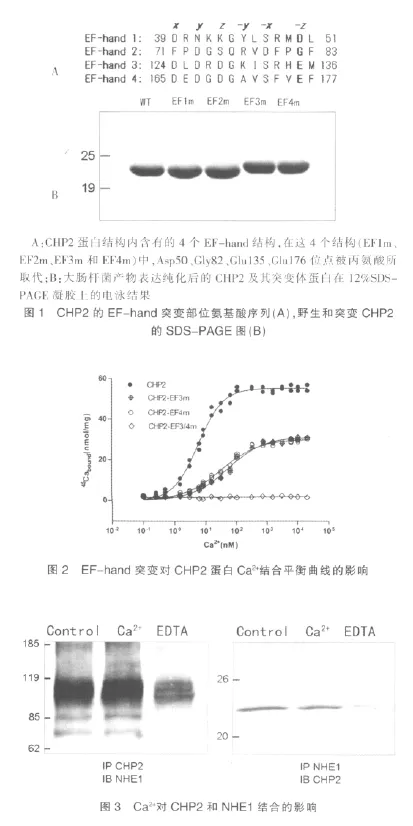
通過激光共聚焦顯微鏡觀察GFP標記的蛋白定位,我量明顯較共表達NHE1/野生型CHP2 組減少,細胞死亡數目增多。見圖5。們可以發現在共轉染NHE1的PS120 細胞中野生型的CHP2蛋白主要定位在細胞膜上,而EF-hand突變的CHP2 蛋白分布在細胞膜的量相對減少(圖4)。當EF-hand被突變,CHP2不能與Ca2+結合,CHP2 與NHE1的結合能力減弱,觀測到其在細胞膜上的定位減少。表明EF-hand是否結合Ca2+能夠影響CHP2 與NHE1的結合及其在細胞膜上定位。
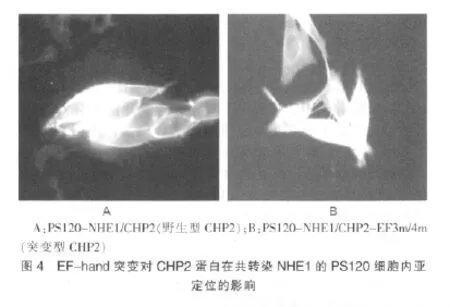
2.5 不同培養條件共表達NHE1/CHP2 或NHE1/CHP2-EF3m/4m的PS120 細胞的生長狀態觀察
在正常有血清培養條件下,共表達NHE1/CHP2 或NHE1/CHP2-EF3m/4m的PS120 細胞的生長狀態無明顯差異,但在去除血清即血清饑餓條件下,筆者發現共表達NHE1/CHP2-EF3m/4m的PS120 細胞隨著培養時間的延長,細胞的存活數
3 討論
Ca2+是參與人體各種生命活動與生理過程的重要離子,是細胞內功能最為廣泛的第二信使[7]。Ca2+作為生命活動中的重要調節因子,在某些細胞信號傳導通路如活化T細胞核因子信號通路(nuclear factor of activated T cells,NFAT)中發揮著著重要的作用[8-9]。CHP2 作為Ca2+結合的蛋白,EF-hand及Ca2+對CHP2 構象、功能和活性的影響尚缺乏報道,值得我們認真研究。
筆者的研究表明,CHP2 蛋白結構中有EF-hand3、EF-hand4這兩個與Ca2+結合的功能性結構。在突變EF-hand3、EF-hand4 以后,CHP2 電泳速度變慢,表明EF-hand對于維持CHP2的正常構象非常重要。免疫共沉淀實驗證明Ca2+影響CHP2 和NHE1的結合,Ca2+的存在促進CHP2 與NHE1 相結合;激光共聚焦顯微鏡觀察發現,在過表達NHE1的PS120細胞內轉染的GFP標記的野生型CHP2 蛋白主要定位在細胞膜上,而EF-hand3、EF-hand4 突變的CHP2 在細胞膜上的亞定位減少,在胞漿中的亞定位增加,提示結合Ca2+及蛋白構象改變對CHP2 細胞內分布有重要影響,在活細胞中證實了突變CHP2的EF-hand后與NHE1的結合減少。
CHP2 在多種腫瘤組織中被發現有異常高表達,如肝癌、卵巢癌、白血病等[3,10-11],提示CHP2 在腫瘤的發生中具有重要作用。CHP2 作為一種腫瘤相關蛋白,也是膜蛋白NHE1的活性調節亞單位,可能通過與NHE1 相互作用在腫瘤發生與發展中發揮重要功能。已有研究證實腫瘤細胞內NHE1 常常處于過度激活的狀態,NHE1的過度激活與腫瘤細胞的異常增殖,遷移與侵襲功能明顯相關[12]。研究表明,CHP2 可結合于NHE1 胞漿部分的近膜區,定位于細胞膜上,激活NHE1,促進離子轉運,升高細胞內的pH值,有利于細胞的生存和增殖,從而減少細胞在血清饑餓的條件下的死亡[13]。本實驗也觀察了血清饑餓條件下共表達NHE1/CHP2 或NHE1/CHP2-EF3m/4m的PS120 細胞的存活狀態,結果顯示CHP2突變組細胞在血清饑餓下隨培養時間的延長細胞存活數目明顯較野生CHP2 組減少,死亡細胞增加,而野生CHP2 組細胞死亡數量明顯較少,與Pang等[13]的研究結果一致,表明EF-hand突變后的CHP2 使細胞抵抗血清饑餓誘導的死亡的能力明顯減弱。本研究結果進一步證明了EF-hand模體結構是CHP2 蛋白結構中的關鍵結構,當其發生突變后CHP2失去Ca2+結合能力,同時也減弱了與其靶蛋白NHE1的正常結合能力,維持細胞在血清饑餓條件下存活的能力也下降。EF-hand的正常結構及Ca2+的結合狀態在CHP2的功能調控中發揮著重要作用。
筆者的研究進一步明確了CHP2 發揮作用的機制,EF-hand的正確結構及與Ca2+的結合,對于NHE1 與CHP2的結合具有重要作用,有助于我們更好地理解CHP2 在腫瘤發生發展中的作用。然而,對于CHP2 在腫瘤中表達的具體調節機制仍然研究有限,如CHP2 上游的基因表達調控模式如何,什么因素開啟了CHP2 蛋白在腫瘤中的異常表達等,這些都值得我們去繼續探索,以進一步明確CHP2 在腫瘤中的重要作用。
[1] Di SF,Vadnagara K,Moe OW,et al.Calcineurin homologous protein:a multifunctional Ca2+-binding protein family [J].Am J Physiol Renal Physiol,2012,303(2):165-179.
[2] Zaun HC,Shrier A,Orlowski J.Calcineurin B homologous protein 3 promotes the biosynthetic maturation,cell surface stability,and optimal transport of the Na+/H+exchanger NHE1 isoform[J].J Biol Chem,2008,283(18):12456-12467.
[3] Wang Y,Han KJ,Pang XW,et al.Large scale identification of human hepatocellularcarcinoma-associatedantigensbyautoantibodies[J].J Immunol,2002,169(2):1102-1109.
[4] Li GD,Zhang X,Li R,et al.CHP2 activates the calcinerurin/nuclear factor of T cells signaling pathway and enhances the oncogenic potential of HEK293 cells[J].J Biol Chem,2008,283(47):32660-32668.
[5] Pang T,Su X,Wakabayashi S,et al.Calcineurin homologous protein as an essential cofactor for Na+/H+exchangers[J].J Biol Chem,2001,276(20):17367-17372.
[6] Ammar YB,Takeda S,Hisamitsu T,et al.Crystal structure of CHP2 complexed with NHE1-cytosolic region and implication for pH regulation[J].EMBO J,2006;25(11):2315-2325.
[7] Bootman MD,Lipp P,Berridge MJ.The organisation and function of local Ca2+signals[J].J Cell Sci,2011,114(12):2213-2222.
[8] Kim MS,Usachev YM.Mitochondrial Ca2+cycling facilitates activation of the transcription factor NFAT in sensory neurons[J].J Neurosci,2009,29:12101-12114.
[9] Crabtree GR,Olson EN.NFAT signaling:choreographing the social lives of cells[J].Cell,2002,109(suppl):67-79.
[10] Jin Q,Kong B,Yang X,et al.Overexpression of CHP2 enhances tumor cell growth,invasion and metastasis in ovarian cancer [J].In Vivo,2007,21(4):593-598.
[11] 李彬,李慶華,馬麗,等.腫瘤相關基因CHP2 在白血病細胞中表達的研究[J].中國實驗血液學雜志,2008,16(4):734-737.
[12] Loo SY,Chang MK,Chua CS,et al.NHE-1:a promising target for novel anti-cancer therapeutics[J].Curr Pharm Des,2012,18(10):1372-1382.
[13] Pang T,Wakabayashi S,Shigekawa M.Expression of calcineurin B homologous protein 2 protects serum deprivation-induced cell death by serum-independent activation of Na+/H+exchanger[J].J Biol Chem,2002,277(46):43771-43777.

