聚腺苷二磷酸核糖糖苷水解酶調(diào)節(jié)癲癇大鼠海馬組織凋亡誘導因子及炎癥因子的研究*
王勝軍, 趙秀鶴, 劉學伍, 張同霞, 陳學蘭, 遲兆富△
(山東大學齊魯醫(yī)院1神經(jīng)內(nèi)科,2藥劑科,山東濟南250012)
聚腺苷二磷酸核糖[poly(adenosine diphosphate ribose),PAR]廣泛存在于細胞中,參與細胞DNA的修復及基因組穩(wěn)定[1]。聚腺苷二磷酸核糖聚合酶[poly(adenosine diphosphate ribose)polymerase,PARP]和聚腺苷二磷酸核糖糖苷水解酶[poly(adenosine diphosphate ribose)glycohydrolase,PARG]是細胞內(nèi)聚腺苷二磷酸核糖基化[poly(ADP-ribosyl)ation]的重要調(diào)節(jié)酶[1],細胞內(nèi)PAR通常由PARP利用煙酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD)合成,然后被PARG迅速降解為腺苷二磷酸核糖。在心力衰竭、腦缺血再灌注及神經(jīng)元興奮毒性損傷等過程中,都發(fā)現(xiàn)PARP過度激活,PAR合成增加,伴有NAD耗竭,細胞死亡信號激活,炎癥因子表達等,最終發(fā)生細胞死亡[2-5]。
癲癇發(fā)作可引起海馬神經(jīng)元死亡及炎癥反應,而癲癇發(fā)作的反復發(fā)生也很可能與之有關[6]。我們發(fā)現(xiàn),癲癇大鼠海馬組織中PARP被過度活化,并通過激活凋亡誘導因子(apoptosis-inducing factor,AIF)及炎癥因子等造成神經(jīng)元損傷[4-5]。近來研究提示,PARG參與調(diào)節(jié)PAR代謝,抑制PARG活性可減少NAD+消耗,減少炎癥因子表達和細胞凋亡,具有一定的神經(jīng)保護作用[7-8]。但到目前為止,PARG是否參與癲癇發(fā)作引起的神經(jīng)元損傷仍未見報道,相關分子機制亦不清楚。本研究將應用海藻氨酸(kainic acid,KA)誘發(fā)的癲癇大鼠模型,探討PARG與癲癇后海馬神經(jīng)元損傷及AIF、腫瘤壞死因子α(tumor necrosis factor-α,TNF-α)、白細胞介素1β(interleukin-1β,IL-1β)表達的關系。
材料和方法
1 材料
成年雄性Wistar大鼠,質(zhì)量(250±50)g,由山東大學實驗動物中心提供。KA、PARP抑制劑3-氨基苯甲酰胺(3-aminobenzamide,3-AB)和 PARG抑制劑單寧酸(gallotannin,GT)購自 Sigma,抗 PAR多克隆抗體購自Alexis Biochemichals,抗AIF單克隆抗體、抗TNF-α單克隆抗體、抗IL-1β多克隆抗體、抗β-actin單克隆抗體、抗組蛋白H1單克隆抗體和HRP標記Ⅱ抗購自Santa Cruz,細胞色素C氧化酶IV亞基(cytochrome C oxidase subunit IV,COX-IV)多克隆抗體購自Biovision。
2 動物模型的制作
腹腔注射苯巴比妥鈉(50 mg/kg)麻醉實驗大鼠,在立體定位儀上,用微量注射器將KA(0.5 μg溶于1 μL生理鹽水中)緩慢注射入大鼠側(cè)腦室(前囟后0.85 mm,側(cè)旁 1.5 mm,深 4.3 mm),應用腦電圖機描記顳葉(前囟后4 mm,左、右側(cè)旁 2 mm)腦電,并觀察大鼠行為變化。對照組采用等量生理鹽水代替KA。藥物干預組大鼠在注射KA 30 min前后都給予腹腔注射3-AB 40 mg/kg或單寧酸30 mg/kg。對照組亦采用等量生理鹽水代替相應藥物。
3 動物分組
實驗(一):癲癇發(fā)作后PAR表達的研究,24只大鼠隨機分為對照組、KA致癇6 h組(KA 6h)、KA致癇+3-氨基苯甲酰胺干預組(KA+3-AB)、KA致癇+單寧酸干預組(KA+GT);實驗(二):單寧酸對癲癇后海馬神經(jīng)元保護的研究,18只大鼠隨機分為對照組、KA致癇72 h組(KA 72h)、KA致癇+單寧酸干預組(KA+GT);實驗(三):單寧酸調(diào)節(jié)AIF的研究,18只大鼠隨機分為對照組、KA致癇24 h組(KA 24h)、KA致癇+單寧酸干預組(KA+GT);實驗(四):單寧酸調(diào)節(jié)炎癥因子表達的研究,18只大鼠隨機分為對照組、KA致癇24 h組(KA 24h)、KA致癇+單寧酸干預組(KA+GT)。
4 大鼠海馬組織Nissl染色及組織學分析
大鼠經(jīng)10%水合氯醛腹腔麻醉,4%多聚甲醛灌注固定后取腦。組織浸蠟包埋,連續(xù)冠狀切片,切片厚度為10 μm,保存?zhèn)溆谩J炃衅撓炛了?%甲苯胺藍室溫下染色,乙醇分色,二甲苯透明,中性樹膠封片。在 Olympus顯微鏡下,觀察大鼠海馬CA1和CA3區(qū)神經(jīng)元的形態(tài)及其分布。海馬神經(jīng)元計數(shù)定義為海馬CA1和CA3區(qū)每0.5 mm長度錐體細胞層中神經(jīng)元數(shù)目。每張切片隨機觀察5個視野,取其平均值。
5 海馬組織蛋白提取及Western blotting
各實驗組大鼠快速斷頭取腦,快速分離海馬,緩沖液洗滌,加入細胞裂解液,冰上孵育,離心后棄上清;沉淀中加入裂解緩沖液,冰浴充分研磨,靜置離心;或于沉淀中加入細胞核裂解液或線粒體分離介質(zhì),冰上孵育后離心,上清為核蛋白提取液,沉淀物為線粒體蛋白。加入蛋白上樣液,沸水煮,-20℃冰箱保存?zhèn)溆谩>郾0纺z電泳,分別配置不同濃度的分離膠和濃縮膠,加入電泳緩沖液,將40 μg蛋白質(zhì)樣品加入樣品孔的底部,在恒壓下電泳約60 min;將電泳凝膠、硝酸纖維素膜、濾紙置于轉(zhuǎn)膜槽,于恒流中電轉(zhuǎn)2 h;將硝酸纖維素膜放入濃度為5%脫脂牛奶中,室溫振蕩2 h;洗滌后,將硝酸纖維素膜放入合理稀釋后的Ⅰ抗溶液中4℃過夜;洗滌后,將硝酸纖維素膜放入合理稀釋后的Ⅱ抗溶液中室溫振蕩1 h;洗滌后,將化學發(fā)光液試劑均勻涂于硝酸纖維素膜,放入X光片夾中于暗室曝光;將X光片顯影、定影;應用數(shù)字凝膠成像系統(tǒng)拍照,將目的蛋白條帶的灰度值與內(nèi)參照的灰度值做比較,計算相對灰度值。
6 統(tǒng)計學處理
結 果
1 實驗大鼠行為學和腦電圖變化
對照組大鼠術后無抽搐發(fā)作行為,KA致癇各組在注射KA 15 min內(nèi)出現(xiàn)咀嚼、點頭等面頸部肌肉的抽搐及單側(cè)或雙側(cè)前肢、后肢陣攣樣運動。對照組大鼠腦電圖表現(xiàn)為基礎波,KA致癇大鼠腦電圖描記到陣發(fā)性或叢集性高幅多棘、多尖波。單寧酸干預組大鼠與KA致癇組大鼠行為學及腦電圖未表現(xiàn)出明顯差別,見圖1。
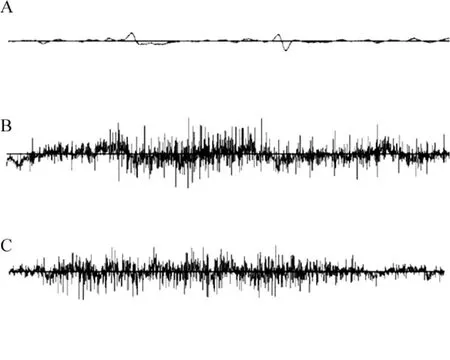
Figure 1.Features of electroencephalogram in different experimental rats.A:slow waves in control group rats;B:rapid waves with high frequency charges in KA treatment rats;C:rapid waves with high frequency charges in gallotannin and KA treatment rats.圖1 各組實驗大鼠腦電圖特征
2 PARG調(diào)節(jié)癲癇大鼠PAR表達
對照組大鼠海馬組織核蛋白中PAR表達較低(0.04±0.01),KA致癇6 h組大鼠海馬組織中的PAR表達顯著增加(0.24±0.03)(P<0.05);PARP抑制劑3-AB干預組中PAR表達減少(0.13±0.02),PARG抑制劑單寧酸干預組中 PAR水平(0.36±0.04)顯著增高(P <0.05),見圖2。
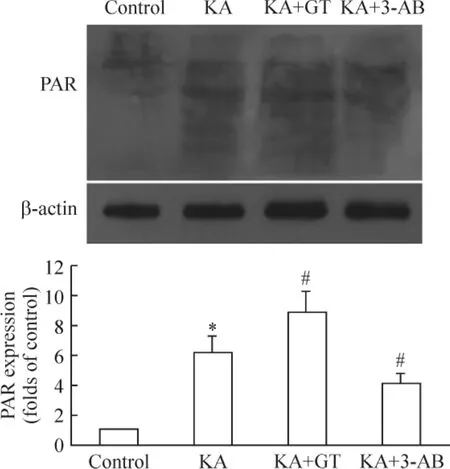
Figure 2.Effect of gallotannin(GT)on PAR expression in rat hippocampus after seizures.±s.n=6.*P<0.05 vs control;#P<0.05 vs KA.圖2 單寧酸對癲癇發(fā)作大鼠海馬PAR表達的影響
3 抑制PARG減輕癲癇大鼠海馬神經(jīng)元損傷
Nissl染色顯示,海馬CA1和CA3區(qū)錐體神經(jīng)元存活數(shù)目KA致癇72 h組(46.13±5.12和63.34±8.11)較對照組(86.25±8.67和125.36±13.74)明顯減少(P<0.05)。KA+GT干預組(67.75±7.58和95.84±10.92)存活神經(jīng)元數(shù)目較KA致癇組顯著增加(P<0.05),見圖3。
4 抑制PARG減少癲癇大鼠海馬線粒體AIF的核轉(zhuǎn)位
對照組大鼠海馬組織核蛋白中僅可檢測到微弱的AIF表達(0.09±0.02),KA致癇24 h組大鼠海馬組織核蛋白中的AIF的含量明顯增加(0.69±0.11,P<0.05),單寧酸干預以后,核蛋白中AIF含量顯著減少(0.35±0.08);與之對應,KA致癇24 h組大鼠海馬組織線粒體蛋白中的AIF的含量(0.31±0.06)較對照組(1.12±0.14)減少(P<0.05),單寧酸干預以后,線粒體蛋白中 AIF含量(0.76±0.11)較KA致癇24 h組增加(P<0.05),見圖4。
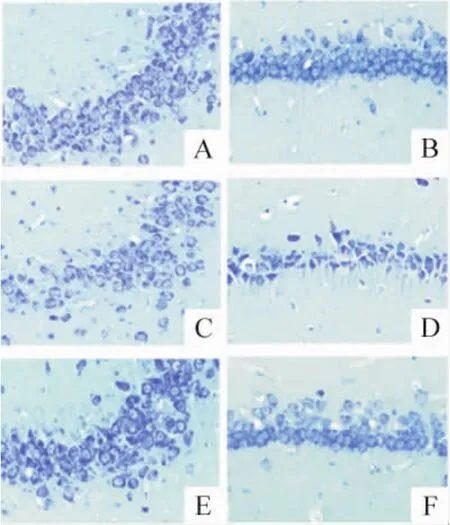
Figure 3.Gallotannin attenuated hippocampal cell death after seizures(Nissl staining,× 200).A,C,E:CA3 subfield;B,D,F(xiàn):CA1 subfield.A,B:control;C,D:KA;E,F(xiàn):KA+GT.圖3 單寧酸減少癲癇大鼠海馬神經(jīng)元的死亡
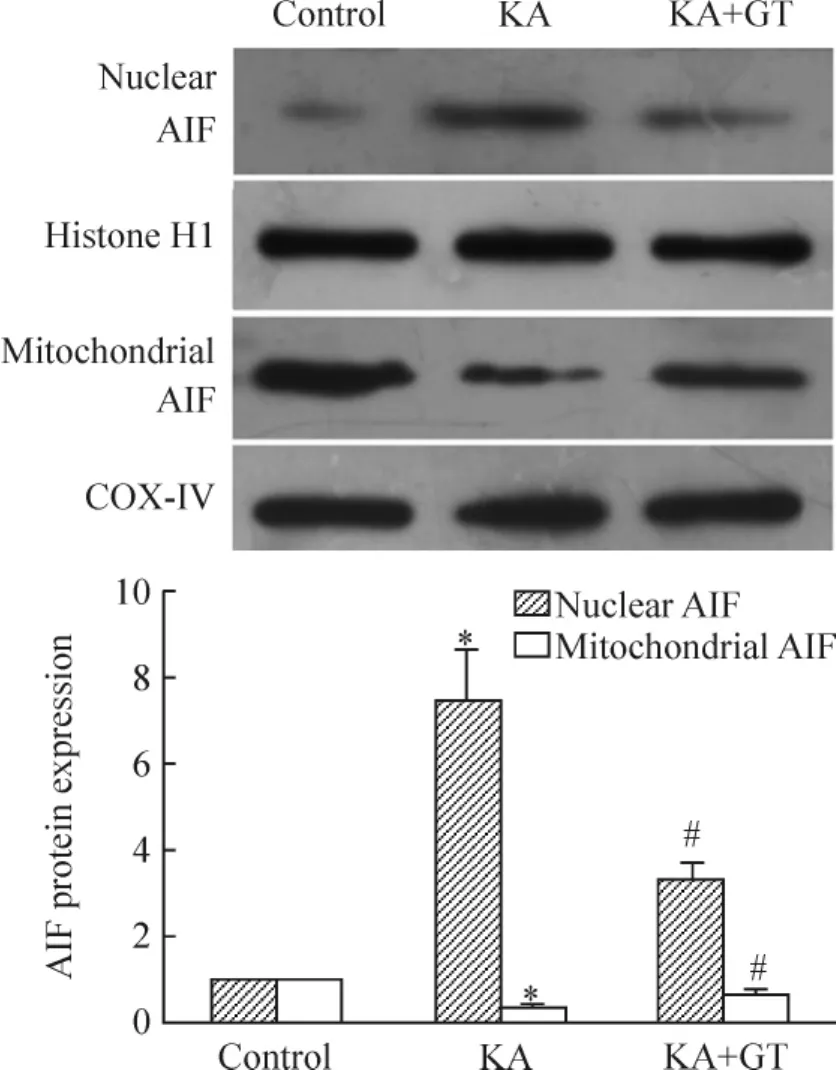
Figure 4.Effect of GT on AIF translocation from mitochondria to nucleus in hippocampus after seizures.±s.n=6.*P<0.05 vs control;#P<0.05 vs KA.圖4 單寧酸對癲癇大鼠海馬線粒體AIF細胞核轉(zhuǎn)位的作用
5 抑制PARG減少癲癇大鼠海馬組織中IL-1β和TNF-α蛋白的表達
對照組大鼠海馬組織中僅有較弱的IL-1β和TNF-α蛋白表達(0.12±0.02和0.17±0.02),KA致癇24 h組大鼠海馬中的IL-1β和TNF-α蛋白的表達(0.95±0.11和0.93±0.13)明顯增加(P<0.05);單寧酸干預后,IL-1β和TNF-α蛋白表達(0.45±0.07和0.39±0.07)明顯降低(P<0.05),見圖5。
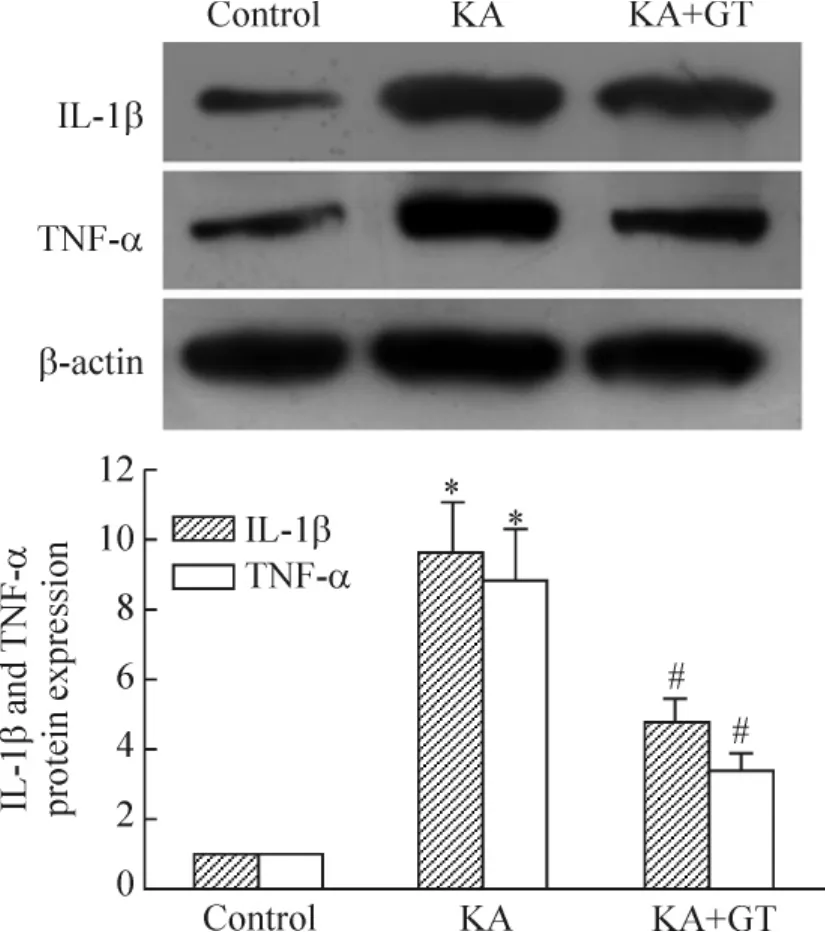
Figure 5.Effect of GT on IL-1β and TNF-α protein expression in hippocampus after seizures.±s.n=6.*P<0.05 vs control;#P<0.05 vs KA.圖5 單寧酸對癲癇大鼠海馬IL-1β與TNF-α表達的作用
討 論
聚腺苷二磷酸核糖基化是細胞內(nèi)一種重要的蛋白修飾方式,PARP催化合成不同分子量的PAR以共價鍵方式與靶蛋白結合,參與DNA修復、細胞凋亡、炎癥反應等生理過程[1]。目前,PARP介導的細胞死亡也被稱為parthanatos(PARP-1-mediated cell death),被認為是不同于壞死、凋亡、自嗜的細胞死亡形式,它與AIF從線粒體釋放移位到細胞核有關[9]。我們先前的研究也證實了調(diào)節(jié)AIF信號通路是PARP抑制劑在癲癇致神經(jīng)損傷過程中發(fā)揮保護作用的重要機制之一[5]。目前,PAR被認為是調(diào)節(jié)parthanatos的重要信號分子,在細胞核內(nèi)合成的PAR可轉(zhuǎn)移到細胞漿作用于線粒體從而誘發(fā)AIF的釋放。最新研究發(fā)現(xiàn),AIF蛋白本身不僅含有DNA結合位點,還含有PAR結合的特異性位點,若PAR結合位點喪失,AIF蛋白則不再被PARP調(diào)節(jié)[10]。
PARG在細胞中存在110 kD和60 kD 2種異構體,前者主要表達于細胞核,與PARG活性關系密切[11]。研究發(fā)現(xiàn),抑制PARG活性具有一定的細胞保護作用,這很可能與減慢細胞PAR降解速度,減少細胞能量消耗有關[8]。此外,PARG還參與調(diào)節(jié)細胞內(nèi)鈣離子水平,而細胞內(nèi)鈣信號與AIF介導的細胞死亡密切相關[1]。最新的研究發(fā)現(xiàn),PARG可調(diào)節(jié)瞬時受體電位通道2引起的細胞鈣超載及AIF介導的細胞死亡[12]。抑制PARG能降低細胞內(nèi)二磷酸腺苷核糖水平,阻斷瞬時受體電位通道2介導的細胞鈣信號及AIF核轉(zhuǎn)位,最終減輕細胞的損傷[12]。不過也有研究發(fā)現(xiàn),細胞敲除PARG基因后,DNA損傷加重,在紫外線損傷下發(fā)生 AIF介導的細胞死亡[13]。本研究提示,PARG抑制劑單寧酸可顯著減輕癲癇發(fā)作造成的大鼠海馬神經(jīng)元損傷,而且單寧酸的神經(jīng)保護作用部分與阻斷AIF信號通路有關。
癲癇發(fā)作可引起腦組織出現(xiàn)明顯的炎癥反應,腦內(nèi)注射針對IL-1β受體拮抗劑表現(xiàn)出明顯的抗驚厥及神經(jīng)元保護作用,炎癥因子被認為與癲癇的發(fā)生頻率、神經(jīng)元存活及膠質(zhì)細胞增生關系密切[6,14]。研究已證實,PARP 可調(diào)節(jié) IL-1β、TNF-α等核轉(zhuǎn)錄因子κB依賴性的基因轉(zhuǎn)錄[2]。我們的研究也發(fā)現(xiàn),抑制PARP活性可減少癲癇大鼠海馬組織核轉(zhuǎn)錄因子κB相關的IL-1β和環(huán)氧化酶2的表達[4]。另外,研究也提示PARG參與調(diào)節(jié)炎癥反應,在脊髓損傷中,抑制PARG可抑制白細胞浸潤及多種炎癥因子的表達[7]。PARG抑制劑單寧酸可調(diào)節(jié)激活蛋白1及分裂原活化蛋白激酶介導的炎癥信號[15]。本研究也提示,單寧酸可調(diào)節(jié)癲癇大鼠海馬組織IL-1β、TNF-α表達,這很可能也是其發(fā)揮神經(jīng)保護作用的重要機制之一。
總之,本研究發(fā)現(xiàn),PARG參與大鼠癲癇致神經(jīng)元損傷過程,單寧酸可明顯減輕癲癇后大鼠海馬神經(jīng)元損傷,參與調(diào)節(jié)AIF由線粒體向細胞核的轉(zhuǎn)位及IL-1β、TNF-α的表達,提示PARG很可能是參與癲癇致神經(jīng)元損傷的重要機制之一。
[1] Malanga M,Althaus FR.The role of poly(ADP-ribose)in the DNA damage signaling network[J].Biochem Cell Biol,2005,83(3):354-364.
[2] Kauppinen TM.Multiple roles for poly(ADP-ribose)polymerase-1 in neurological disease[J].Neurochem Int,2007,50(7-8):954-958.
[3] 朱鐵年,趙瑞景,凌亦凌.多聚(ADP-核糖)聚合酶與細胞損傷[J].中國病理生理雜志,2002,18(1):104-107.
[4] 王勝軍,遲兆富,王樹華,等.PARP調(diào)節(jié)癲癇大鼠海馬轉(zhuǎn)錄因子κB及相關炎癥因子的表達[J].中國病理生理雜志,2010,26(1):86-90.
[5] Wang SJ,Wang SH,Song ZF,et al.Poly(ADP-ribose)polymerase inhibitor is neuroprotective in epileptic rat via apoptosis inducing factor and Akt signaling[J].Neuroreport,2007,18(12):1285-1289.
[6] Vezzani A,Moneta D,Richichi C,et al.Functional role of inflammatory cytokines and antiinflammatory molecules in seizures and epileptogenesis[J].Epilepsia,2002,43(Suppl 5):30-35.
[7] Cuzzocrea S,Genovese T,Mazzon E,et al.Poly(ADP-ribose)glycohydrolase activity mediates post-traumatic inflammatory reaction after experimental spinal cord trauma[J].J Pharmacol Exp Ther,2006,319(1):127-138.
[8] Lu XC,Massuda E,Lin Q,et al.Post-treatment with a novel PARG inhibitor reduces infarct in cerebral ischemia in the rat[J].Brain Res,2003,978(1-2):99-103.
[9] Wang Y,Dawson VL,Dawson TM.Poly(ADP-ribose)signals to mitochondrial AIF:a key event in parthanatos[J].Exp Neurol,2009,218(2):193-202.
[10] Wang Y,Kim NS,Haince JF,et al.Poly(ADP-ribose)(PAR)binding to apoptosis-inducing factor is critical for PAR polymerase-1-dependent cell death(parthanatos)[J].Sci Signal,2011,4(167):ra20.
[11] Cortes U,Tong WM,Coyle DL,et al.Depletion of the 110-kilodalton isoform of poly(ADP-ribose)glycohydrolase increases sensitivity to genotoxic and endotoxic stress in mice[J].Mol Cell Biol,2004,24(16):7163-7178.
[12] Blenn C,Wyrsch P,Bader J,et al.Poly(ADP-ribose)glycohydrolase is an upstream regulator of Ca2+fluxes in oxidative cell death[J].Cell Mol Life Sci,2011,68(8):1455-1466.
[13] Zhou Y,F(xiàn)eng X,Koh DW.Activation of cell death mediated by apoptosis-inducing factor due to the absence of poly(ADP-ribose)glycohydrolase[J].Biochemistry,2011,50(14):2850-2859.
[14] Turrin NP,Rivest S.Innate immune reaction in response to seizures:implications for the neuropathology associated with epilepsy[J].Neurobiol Dis,2004,16(2):321-334.
[15] Erdèlyi K,Kiss A,Bakondi E,et al.Gallotannin inhibits the expression of chemokines and inflammatory cytokines in A549 cells[J].Mol Pharmacol,2005,68(3):895-904.

