熱應激對肉牛血清內分泌激素含量、抗氧化酶活性及生理生化指標的影響
宋小珍 付戴波 瞿明仁 楊食堂 劉道楊 徐振松
(1.江西農業大學動物科學技術學院,南昌 330045;2.江西高安裕豐農牧有限公司,宜春 330800)
在現代畜牧生產中,應激無處不在,引起應激的因素包括環境、飼養管理、運輸、中毒和微生物感染等。而環境因素是應激中對家畜作用最廣泛,甚至是不可避免的。隨著我國畜禽集約化養殖業的不斷發展,應激性疾病尤其是熱應激疾病已經成為我國養殖業中重要疾病之一。南方亞熱帶地區的夏季持續時間長達4個月,極端氣溫高達40℃以上,且潮濕多雨。肉牛屬恒溫動物,無活動性汗腺,因而在南方高溫高濕條件下極易出現熱應激反應。研究表明,高溫高濕環境中,肉牛易出現體溫升高、呼吸頻率加快、食欲下降、腹瀉等現象,嚴重影響肉牛養殖業的經濟效益[1-2]。隨著肉牛集約化、規模化養殖模式的推廣,一些極端環境帶來的經濟損失將越來越嚴重,因此,熱應激對肉牛生產的影響機理成為了一個重要的課題。但目前國內有關熱應激對動物影響的研究大多集中在單胃動物和奶牛上,且已有的報道大多圍繞抗熱應激添加劑對肉牛的作用效果進行研究[3-4],而對熱應激條件下肉牛的生理生化指標變化規律的報道很少。本試驗擬研究熱應激條件下肉牛的生理表現,血清中內分泌激素含量、抗氧化酶活性及其他生化指標的變化,探討熱應激對肉牛的作用機理,為南方夏季肉牛熱應激的防治提供理論依據。
1 材料與方法
1.1 試驗動物
選取9頭8月齡體重(210±20)kg長勢良好、健康無疾病的錦江黃牛,該試驗肉牛由江西高安裕豐農牧有限公司提供。
1.2 試驗飼糧組成及營養水平
試驗肉牛飼糧的精粗比例為4∶6,精料由玉米、豆粕、棉籽粕、麥麩、預混料等組成,其營養水平按照肉牛飼養標準(NY/T 815—2004)[5]設計(表1)。粗料為皇竹草。
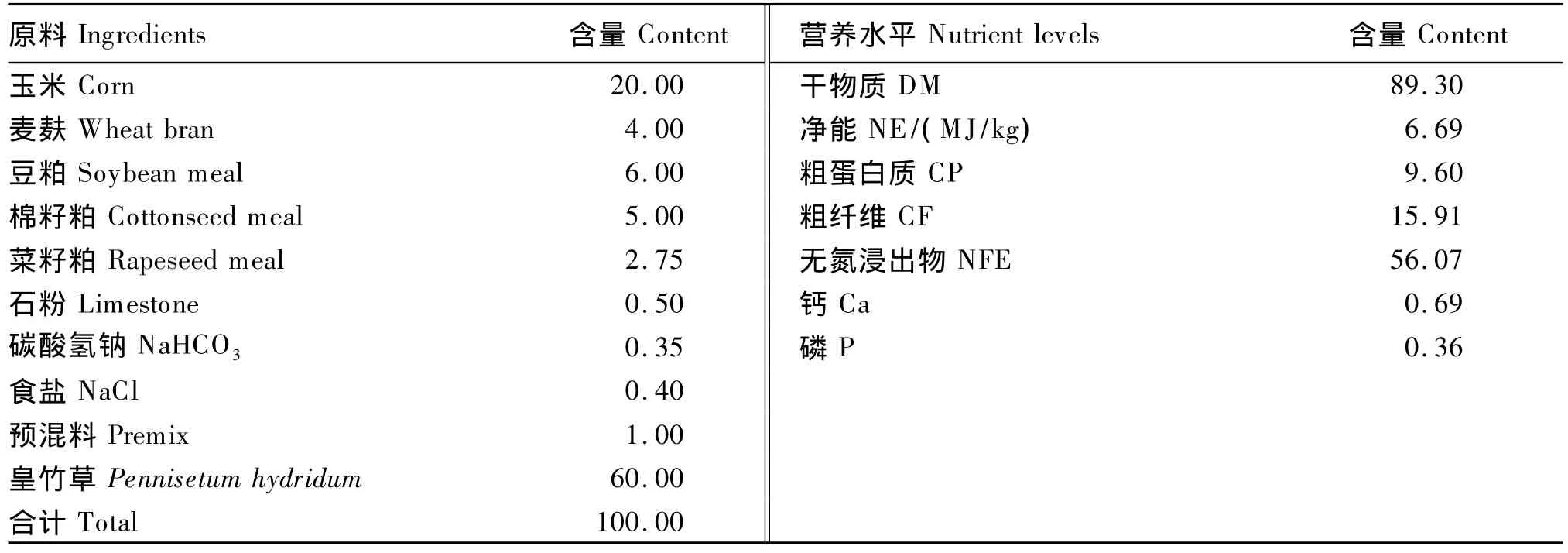
表1 試驗飼糧組成及營養水平Table1 Composition and nutrient levels of the experimental diet %
1.3 試驗設計
試驗分2個不同時期進行,即非熱應激期(春季,2010年5月20日-2010年5月22日)和熱應激期(夏季,2010年7月10日 -2010年9月8日),其中,非熱應激期為3 d,熱應激期為60 d,每個時期的試驗牛為9頭。熱應激期試驗開始時間(第1天)以牛舍溫濕指數(temperature humidity index,THI)連續3 d高于79界定。熱應激期又分為3個階段,即第1階段1~20 d、第2階段21~40 d、第3階段41~60 d。
1.4 飼養管理
試驗牛均分欄飼養,由專人負責,試驗前統一驅除體內外寄生蟲并進行常規免疫,日常管理相同,自由采食和飲水。
1.5 測定項目和方法
1.5.1 牛舍環境溫濕度記錄
試驗全期在試驗牛群的中間和兩端與牛體等高處(距地面約1.5 m)懸掛溫濕度表,記錄08:00、14:00及20:00的溫度和相對濕度。根據Berman[6]報道的方法計算牛舍 THI,計算公式為:
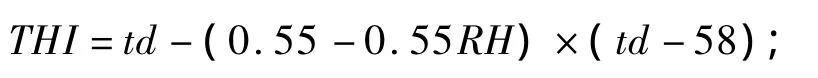
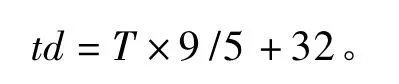
式中:td為華氏溫度(℉),T為攝氏溫度(℃),RH為相對濕度(%)。當牛舍 THI<72時表示未受到熱應激;72≤THI≤79時表示輕度熱應激;79<THI≤88時表示中度熱應激;THI>88時表示高度熱應激。
1.5.2 直腸溫度、呼吸頻率和腹瀉率的測定
在非熱應激期和熱應激期的3個階段,各選3 d測定08:00、14:00、20:00試驗牛的呼吸頻率、直腸溫度。通過觀察試驗牛安靜時胸廓和腹部的運動,用秒表計時,用計數器計數,連續測定10 min,計算呼吸頻率。直腸溫度用獸用體溫計測量。每天觀察并記錄試驗牛的腹瀉情況。
1.5.3 血清制備與指標測定
在非熱應激期第3天和熱應激期第20、40、60天的08:00,對全部試驗牛進行空腹頸靜脈采血。每次每頭牛采集10 mL血樣,分別置于1.5 mL高壓滅菌的離心管中,以3 000 r/min離心15 min,分離血清,在-20℃左右保存待測。血清中三碘甲狀腺原氨酸(T3)、甲狀腺素(T4)和皮質醇(COR)的含量采用放射免疫分析法測定,其他指標由江西省第一附屬醫院血液檢驗科采用西門子ADVIA 2400全自動生化分析儀測定。
1.6 統計方法
使用Excel 2003軟件處理數據,所有數據均采用平均值±標準差表示。采用SPSS 13.0統計軟件中單因素方差分析(One-way ANOVA)中的LSD法進行多重比較。
2 結果與分析
2.1 試驗熱應激情況
牛舍THI能充分反映牛舍環境對牛熱調節的影響。一般認為當環境溫度超過25℃、THI為72及以上時,牛處于熱應激狀態。由表2可知,在試驗設計的非熱應激期,牛舍的日平均溫度為23.50℃,THI平均值為69.03,符合肉牛處在非熱應激狀態的標準;在試驗設計熱應激期的3個階段,牛舍的日平均溫度均高于30℃,THI平均值均高于79,表明這3個階段都使肉牛處于熱應激狀態。
2.2 熱應激對錦江黃牛生理指標的影響
由表3可知,與非熱應激期相比,熱應激期第1階段,試驗牛的直腸溫度顯著升高(P<0.05),而后逐漸恢復正常;呼吸頻率在熱應激期第1、2、3階段分別提高了60.72%、87.08%和36.70%(P<0.05);腹瀉率在熱應激期第1、2、3階段分別增加了 115.52%、133.51%和 92.53%(P<0.05)。
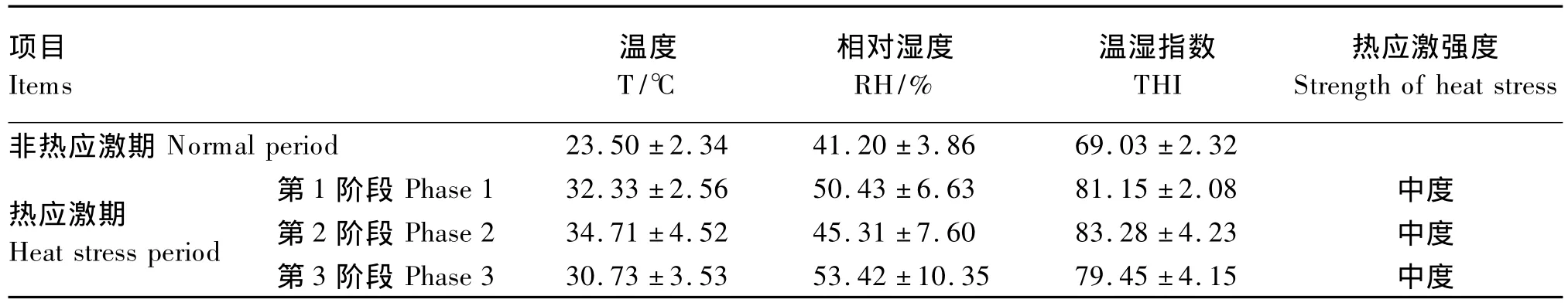
表2 試驗牛舍的溫濕度指標Table2 Temperature and humidity indices of cattle house
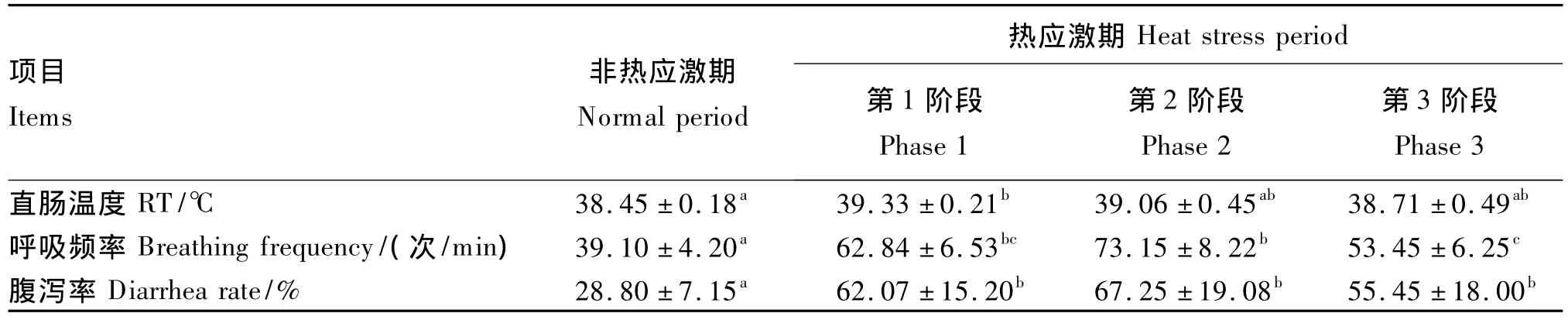
表3 熱應激對肉牛生理指標的影響Table3 Effects of heat stress on physiological indices of beef cattle
2.3 熱應激對錦江黃牛血清生化指標的影響
由表4可知,與非熱應激期相比,在熱應激期第20、40、60天,肉牛血清中 T3含量分別下降了15.65%、23.48%和37.39%(P<0.05);T4含量均差異不顯著(P>0.05);COR含量在熱應激期第20天升高了49.30%(P<0.05),在第40、60天分別升高了15.49%、23.94%(P>0.05);葡萄糖(GLU)含量在熱應激期第20、40、60天分別降低了12.33%(P>0.05)、14.48%(P<0.05)和41.55%(P<0.05);總蛋白(TP)含量在熱應激期第20天差異不顯著(P>0.05),第40、60天分別下降了8.68%和9.20%(P<0.05);球蛋白(GLB)含量在熱應激期第20、60天分別降低了14.37%、11.96%(P<0.05);尿素氮(UN)含量在熱應激期第60天降低了30.93%(P<0.05);白蛋白(ALB)、甘油三酯(TG)、總膽固醇(T-CHO)含量差異不顯著(P>0.05);堿性磷酸酶(ALP)和乳酸脫氫酶(LDH)活性的變化主要表現在熱應激期第40天,其中ALP的活性降低了29.15%(P<0.05),LDH活性升高了15.01%(P<0.05);丙二醛(MDA)含量在熱應激期第20、40天分別升高了 46.21%、67.59%(P<0.05),而第60天時MDA含量差異不顯著(P>0.05);超氧化物歧化酶(SOD)活性在熱應激期第20、40天分別降低了 10.41%、14.41%(P<0.05),而第60天時SOD活性差異不顯著(P>0.05)。
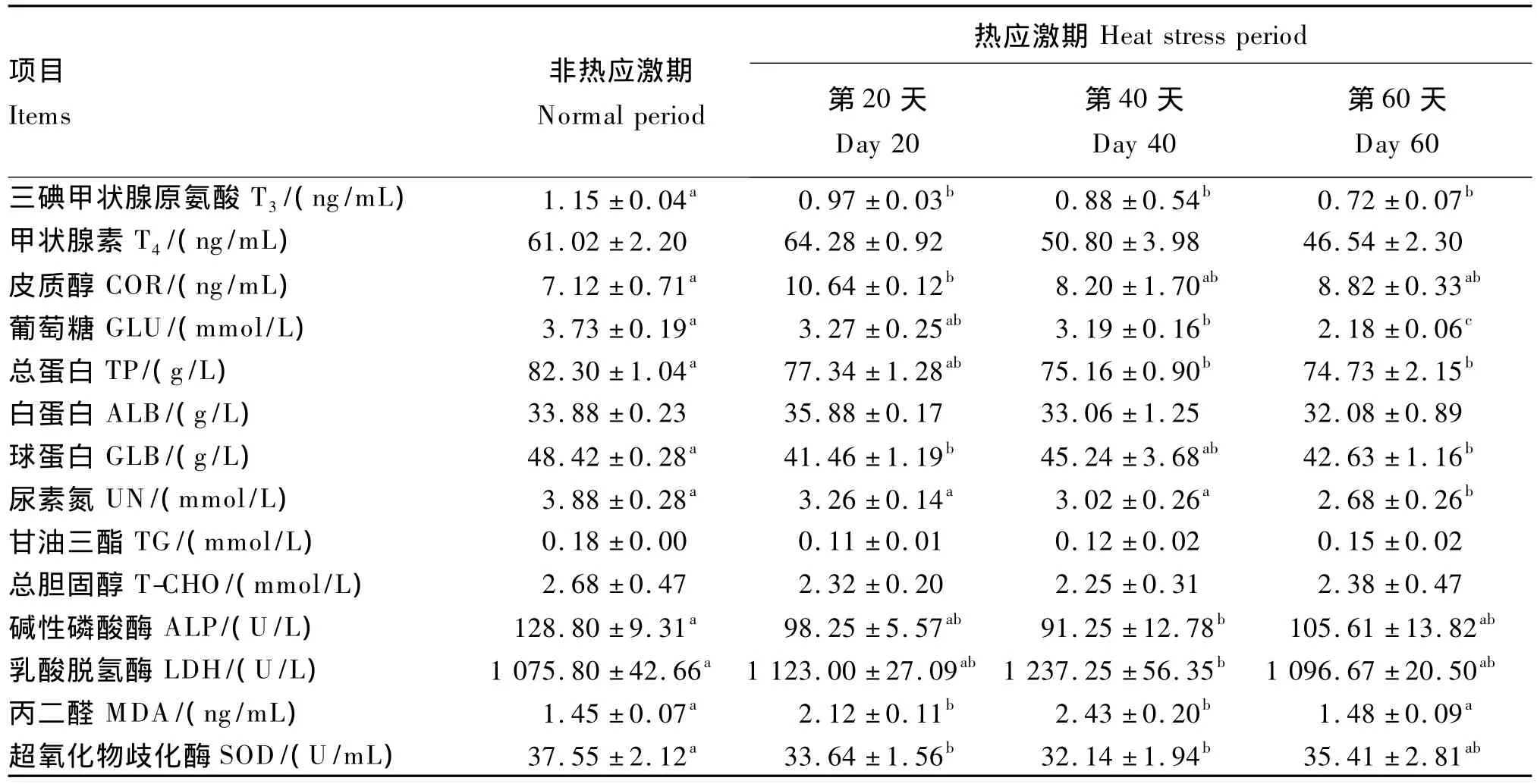
表4 熱應激對肉牛血清生化指標的影響Table4 Effects of heat stress on serum biochemical indices of beef cattle
3 討論
3.1 熱應激時錦江黃牛的生理表現
體溫和呼吸頻率是衡量恒溫動物生理狀況的重要指標,也是衡量熱感受性的指標,可以用來評估熱應激影響程度。本試驗結果表明,熱應激條件下,錦江黃牛的直腸溫度升高,呼吸頻率加快,腹瀉率增加。張瑞光等[7]研究表明,夏季慢性熱應激奶牛直腸溫度和呼吸頻率極顯著高于冬季非熱應激期。史彬林等[8]發現,試驗牛熱應激期間的直腸溫度(39.04℃)和呼吸頻率(63.88次/min)極顯著高于冬季非熱應激期(37.41℃和23.08次/min),表明熱應激對直腸溫度、呼吸頻率具有極顯著影響。這些報道與本試驗研究結果一致。
3.2 熱應激對錦江黃牛血清生化指標的影響
本試驗的結果表明,在熱應激期,試驗牛血清中T3、T4含量下降,COR含量顯著上升。腎上腺是動物體內又一個對環境溫度(尤其是高溫)敏感的內分泌腺。下丘腦-垂體-腎上腺皮質軸(HPA)的激活以及由此引起的糖皮質激素(皮質醇、皮質酮、皮質素)分泌量增加,都是應激反應最重要的特征。COR是腎上腺皮質合成分泌的一種類固醇激素,參與機體多種代謝過程,有利于組織的修復。處于熱應激時肉牛將減弱甲狀腺機能,降低代謝率,減少產熱,從而減少T3和T4的分泌,以增加機體對炎熱環境的適應[9]。因此,血清中T3、T4和COR的含量是衡量熱應激的重要指標。據調查,氣溫在35℃左右,所有品種牛的甲狀腺活動能力均降低20% ~65%[10]。穆玉云[11]報道,高溫下耐熱牛和不耐熱牛的T4含量均下降。
血清代謝產物是反映機體全身或局部代謝變化及判定組織生理功能較為敏感的指標。GLU作為重要的營養性單糖,是動物代謝活動快速供能最有效的營養素。Scharf等[12]報道,急性熱應激時肉牛血清GLU含量會升高,而慢性熱應激時則會降低。血清中TP、ALB、UN含量直接反映了動物機體蛋白質的代謝狀況。蛋白質代謝良好時,血清中TP、ALB、UN含量較低。本試驗研究中,肉牛在夏季因氣候變化所引起的熱應激當屬于慢性熱應激,在該熱應激期的3個階段,試驗牛血液中GLU含量均呈現顯著下降,TP、ALB含量無顯著變化,這說明熱應激對動物GLU代謝的影響更大。
研究表明,熱應激可引起機體自由基增多,從而攻擊細胞膜,破壞體內的抗氧化酶系統,引起組織損傷和疾病的發生[13]。MDA是脂質過氧化鏈式反應的主要終產物,其含量可間接反映機體組織細胞脂質過氧化的程度;而SOD的活性反映機體清除氧自由基的能力。在本試驗研究中,熱應激期試驗牛血清中MDA含量呈現顯著上升,而SOD活性顯著下降,這說明熱應激加速了機體組織的脂質過氧化作用,并導致其抗氧化能力下降。
LDH是糖酵解過程中的關鍵酶,血清中該酶活性與無氧酵解密切相關。動物在熱應激時,首先要保證中樞神經、心臟等重要器官的供氧,而其他組織極可能在缺氧情況下采取無氧酵解方式供能。這種酵解方式雖然能保證機體對能量的需要,且又不過度的增加機體散熱,但卻導致了三磷酸腺苷的減少[14]。本試驗研究顯示,熱應激期試驗牛的血清LDH活性顯著升高,這可能與熱應激后機體無氧酵解增強有關。
此外,本試驗研究還發現,隨著熱應激時間延長,試驗牛的直腸溫度、呼吸頻率、內分泌激素含量、抗氧化酶活性等生理生化指標均逐漸恢復正常,這可能與動物自身的熱適應性調節有關。
4 結論
南方夏季高溫高濕條件下,錦江黃牛易出現熱應激反應,其表現為直腸溫度升高,呼吸頻率加快,血清中T3、T4含量下降、COR含量增加,抗氧化能力降低。但隨著熱應激時間的延長,試驗牛直腸溫度、內分泌激素含量可逐漸恢復正常。
[1]BEATTY D T,BARNES A,TAYIOR E,et a1.Physiological responses of Bos taurus and Bos indicus cattle to prolonged,continuous heat and humidity[J].Journal of Animal Science,2006,84(4):972-985.
[2]MADER T L,DAVIS M S,BROWN-BRANDL T.Environmental factors influencing heat stress in feedlot cattle[J].Journal of Animal Science,2006,84(3):712-719.
[3]SONG X Z,XU J Q,WANG T,et al.Anti-stress Chinese medicine decoction enhanced growth performance and intestinal glucose absorption in heat-stressed pigs by up-regulating the expression of SGLT1,GLUT2 mRNA[J].Livestock Science,2010,128:75-81.
[4]李秋鳳,李建國,韓永利.日糧陰陽離子平衡對高溫環境中奶牛生產性能和血液指標的影響[J].畜牧獸醫學報,2004,35(5):498-504.
[5]中華人民共和國農業部.NY/T 815—2004肉牛飼養標準[S].北京:中國農業出版社,2005.
[6]BERMAN A.Estimates of heat stress relief needs for Holstein dairy cows[J].Journal of Animal Science,2005,83(6):1377-1384.
[7]張瑞光,吳曉鳴,鮑若虹,等.熱應激與非熱應激期福安水牛生理和抗氧化指標分析[J].江西農業大學學報,2010,22(11):136-138.
[8]史彬林,閆素梅.奶牛耐熱評定指標的影響[J].中國奶牛,1996,(2):20-22.
[9]王文娟,汪水平,左福元,等.中藥復方對夏季肉牛的影響:Ⅰ.生產性能、生理指標及血清激素水平和酶活性[J].畜牧獸醫學報,2010,41(10):1260-1267.
[10]韓正康.家畜生理學[M].北京:中國農業出版社,2002.
[11]穆玉云.乳牛耐熱性指標的檢測[J].安徽農業大學學報,1993,20(1):66-71.
[12]SCHARF B,CARROLL J A,RILEY D G,et a1.E-valuation of physiological and blood serum differences in heat tolerant(Romosinuano)and heat-susceptible(Angus)Bos taurus cattle during controlled heat challenge[J].Journal of Animal Science,2010,88(7):2321-2336.
[13]宋小珍,魯琳,劉鳳華,等.高溫應激對仔豬小腸上皮脂質過氧化的動態影響[J].動物營養學報,2008,20(1):75-79.
[14]BURKE N C,SCAGLIA G,SAKER K E,et al.Influence of entophyte consumption and heat stress on intravaginal temperatures,plasma lipid oxidation,blood selenium,and glutathione redox of mononuclear cells in heifers grazing tall fescue[J].Journal of Animal Science,2007,85:2932-2940.

