采用不同載體的玻璃化冷凍對人卵巢組織凍存效果的比較研究
黃麗麗 王文軍 李瑞岐 歐陽能勇 楊冬梓
中山大學孫逸仙紀念醫院生殖中心,廣東廣州 510120
卵巢組織冷凍可以為卵巢早衰或癌癥需要放化療的患者提供恢復生育能力及內分泌功能的可能性[1]。玻璃化冷凍是近年來出現的一種新的冷凍方法,該技術將冷凍對象直接投入液氮中快速降溫,避免冰晶形成,可以繞開組織內不同細胞成分對慢速冷凍參數要求不同的技術障礙,從而提高冷凍保存效果。玻璃化冷凍的降溫速度直接決定冷凍保護劑能否形成玻璃態,而使用的載體是影響降溫速度的最重要因素。雖然目前應用玻璃化方法凍存人卵巢組織已有陸續報道,其中采用的載體包括冷凍管[2]、開放式麥管[3]、最小微滴法[4]以及不銹鋼網篩[5]等,然而究竟何種載體更適合人卵巢組織玻璃化冷凍,需進一步研究。固相表面玻璃化技術(solid-surface vitrification,SSV)是近年新出現的一種簡便有效的玻璃化方法,筆者前期曾成功將其用于玻璃化冷凍人卵巢組織片,并取得了與慢速程序化冷凍相當的效果[6]。本研究的目的是比較固相表面玻璃化冷凍和其他載體相比,對人卵巢組織玻璃化冷凍的效果。
1 材料與方法
1.1 人卵巢組織標本的收集與預處理
卵巢標本取自2011年11月~2012年6月就診于中山大學孫逸仙紀念醫院婦產科、需經腹或行腹腔鏡手術的16例患者,年齡 21~40 歲,平均(32.7±5.9)歲;有規律的月經史,無內分泌紊亂,無放化療史,半年內無激素服用史,且卵巢囊腫直徑<7 cm。其中,良性卵巢囊腫8例,子宮肌瘤5例,宮頸癌3例。所有患者均簽署知情同意書,本研究得到了中山大學孫逸仙紀念醫院倫理委員會的批準。
新鮮卵巢組織浸泡于含10%人血白蛋白+青鏈雙抗的L-15培養液(Gibco公司)中,于體式顯微鏡下去除多余髓質后,切成約5 mm×1 mm×1 mm大小的皮質小條,隨機分配到不同的實驗組:新鮮組(F組)、冷凍管玻璃化組(TV組)、最小微滴玻璃化組(MDS組)、不銹鋼網篩玻璃化組(SLV組)和固相表面玻璃化組(SSV組)。新鮮組直接以4%多聚甲醛液固定。
1.2 玻璃化冷凍和復蘇過程
采用含有20%乙二醇(ethylene glycol,EG)+20%二甲基亞砜(dimethyl sulphoxide,DMSO)的L-15溶液為玻璃化冷凍液。將卵巢組織依次浸泡于4℃25%、50%、75%和100%濃度的玻璃化冷凍液中逐步導入冷凍保護劑后,采用不同載體行玻璃化冷凍:①TV組將卵巢置于含有1 mL 4℃100%玻璃化冷凍液的無菌冷凍管中投入液氮;②MDS組用無菌的巴氏管將卵巢組織直接滴入液氮中;③SLV組將卵巢組織置不銹鋼網篩上投入液氮中;④SSV組將卵巢組織置于已在液氮中預冷的鋁箔上投入液氮中,在液氮面之下將卵巢組織收集入冷凍管中液氮保存。
復蘇時將冷凍管從液氮中取出,靜置10 s,除TV組將冷凍管置于37℃水浴中2~3 min取出卵巢組織外,MDS組、SLV組和SSV組打開冷凍管取出卵巢組織,將其依次轉移到0.5、0.25和0.125 mol/L蔗糖溶液中,洗滌后于37℃培養箱中靜置備用。
1.3 人卵巢皮質片的體外培養
卵巢組織體外培養體系參考文獻[7]。將復蘇的卵巢組織置于嵌入式培養皿Millicell-ORG(Millipore公司)上培養。培養液成分:α-MEM液,2.5%人白蛋白,1%胰島素轉鐵蛋白亞硒酸鈉ITS(含有胰島素、轉鐵蛋白和亞硒酸鈉),500 mIU/mL重組人促卵泡生成素(rhFSH)以及青鏈雙抗。培養10 d,每2天更換新鮮培養液,吸出的培養液用于激素測定。培養結束后所有的卵巢組織用于組織學檢測。
1.4 組織學分析
卵巢組織用4%多聚甲醛固定,石蠟包埋后4 μm連續切片,行HE染色,每10個切片在光鏡下觀察計數一次。原始卵泡和初級卵泡計數以卵母細胞核作為標記,盲法計數每個標本中形態正常的原始卵泡和初級卵泡。參照Gougeon標準[8]進行卵泡分級和卵泡形態評價。
1.5 雌孕激素的測定
將更換的培養液收集于無菌EP管中,置于-20℃冰箱保存,培養結束后統一采用美國全自動化學發光免疫分析系統ACS:180SE測定雌孕激素水平。
1.6 統計學方法
使用SPSS 11.0統計分析軟件,計量資料數據以均數±標準差(±s)表示。采用單因素方差分析和χ2檢驗進行統計學分析組織學結果,對培養液中雌二醇和孕酮的測定采用GLM中重復測量的方差分析。以P<0.05為差異有統計學意義。
2 結果
2.1 卵巢皮質組織學分析結果
冷凍前后的組織切片在光鏡下均可見到形態正常和閉鎖的卵泡(圖1)。凍融后各組卵巢組織中卵泡形態正常率低于F組(P<0.05)。其中,SSV組原始和初級卵泡正常形態率最高(P<0.05),其次為MDS組和SLV組,后兩組之間差異無統計學意義(P>0.05),TV組卵泡正常形態率最低(P<0.05)(表1)。
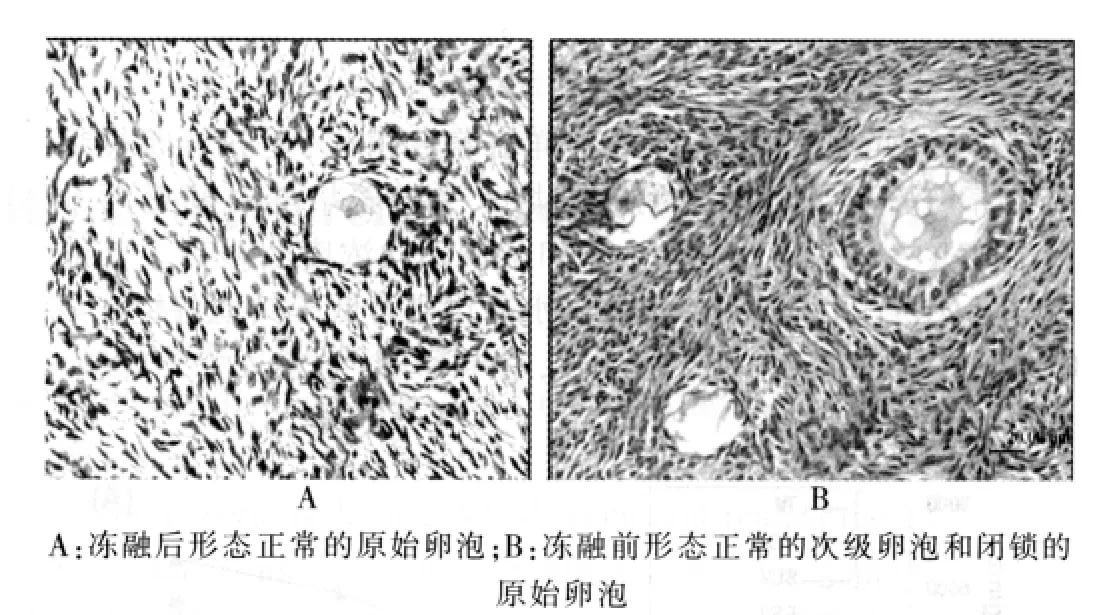
圖1 凍融前后卵巢組織中不同級別的卵泡HE染色(×400)
表1 新鮮組和四組凍融后卵巢組織中原始和初級卵泡的平均正常形態率(±s,%)

表1 新鮮組和四組凍融后卵巢組織中原始和初級卵泡的平均正常形態率(±s,%)
注:F組為新鮮組;TV組為冷凍管組;MDS組為最小微滴組;SLV組為不銹鋼網篩組;SSV組為固相表面玻璃化組;與F組比較,*P<0.05;與TV組比較,#P<0.05;與 SSV組比較,▲P<0.05
組別 原始卵泡 初級卵泡F組TV組MDS組SLV組SSV組90.27±6.02 64.57±11.84*78.36±7.62*#▲77.21±6.51*#▲84.70±5.03*83.56±7.99 59.95±15.27*72.34±9.72*#▲71.60±9.53*#▲79.75±6.54*
2.2 卵巢組織的體外培養
經過體外10 d培養后,各組卵巢皮質的邊緣變圓滑。光鏡下各組卵巢皮質培養后均可見到存活卵泡,見圖2。如圖2所示,與新鮮未培養卵巢組織相比,培養后的各組卵巢組織中原始卵泡所占的比例均下降(P<0.05),生長卵泡(包括初級和次級卵泡)比例均上升(P<0.05)。新鮮未培養組原始卵泡和生長卵泡的比例分別為85.96%和14.04%;TV組培養后為60.66%和33.34%;MDS組培養后為 56.24%和43.76%;SLV組培養后分別為54.79%和45.21%;SSV組培養后為46.0%和54.0%。SSV組凍融組織體外培養后初級卵泡比例明顯高于其他冷凍組(P<0.05),同時原始卵泡所占比例明顯低于其他冷凍組(P<0.05)。TV組培養后兩類卵泡比例與其他各組之間比較,差異均有統計學意義(均P<0.05),培養后MDS組和SLV組的兩級卵泡所占比例組間比較,差異無統計學意義(P>0.05)。
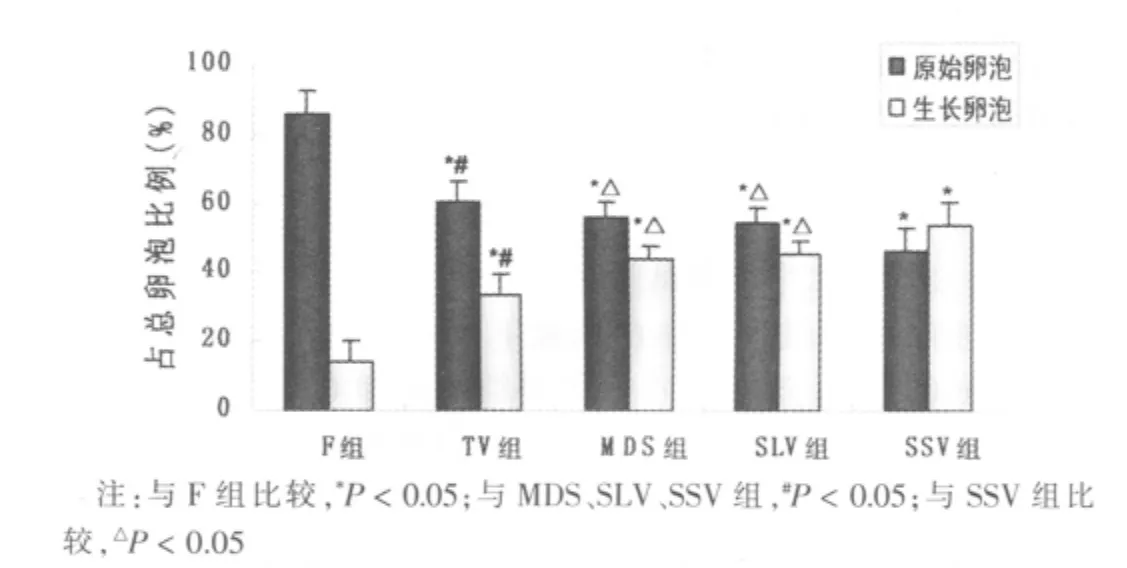
圖2 新鮮組和培養后各玻璃化組卵巢組織中原始卵泡和初級卵泡所占比例
2.3 培養液中激素的測定結果
體外培養的10 d中,與新鮮培養液相比,復蘇后卵巢組織培養液中雌二醇和孕酮的平均水平隨著培養時間逐漸升高(圖3A、3B)。SSV組雌二醇和孕酮平均濃度明顯高于其他組(P<0.05)。TV組的兩種激素水平均顯著低于其他各組(P<0.05)。MDS組與SLV組之間比較,差異無統計學意義(P>0.05)。
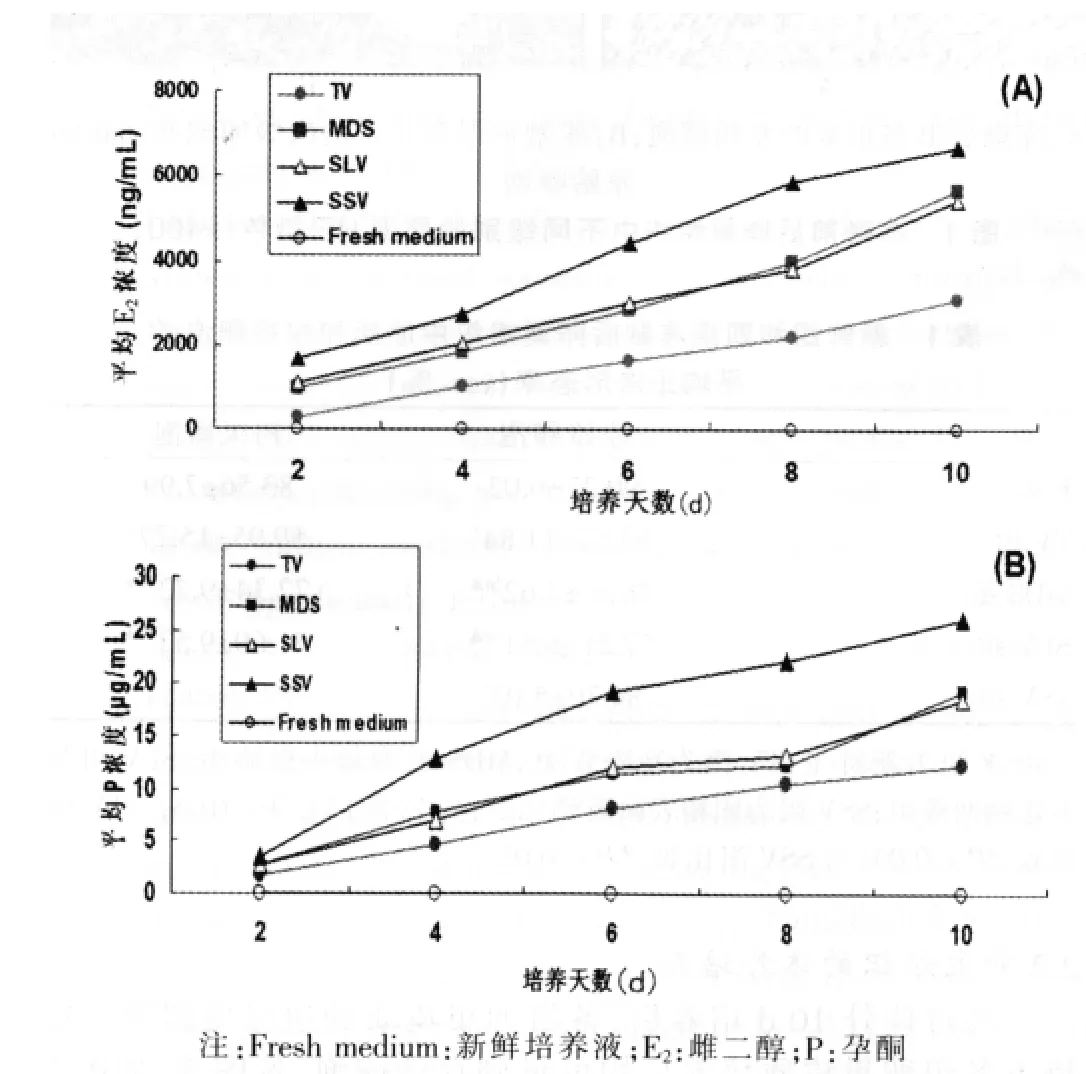
圖3 各玻璃化組卵巢組織體外培養液中雌二醇(A)和孕酮(B)的濃度
3 討論
玻璃化冷凍過程需要一個特殊的載體承載冷凍保護液和組織細胞,對于卵巢組織而言,載體需要一定的容積同時要盡量減少所需冷凍液的體積以提高降溫速度。此外,當組織被浸入液氮中時,沸騰的氮氣包裹在組織周圍,由于其低導熱性形成有效的絕熱區從而減緩了降溫速度[9]。由此可見,載體的選擇要考慮上述多種影響因素。目前已有多種載體被實驗性地應用于玻璃化冷凍過程,如冷凍管(cryovial)、開放式拉長麥管[10]、最小微滴法和不銹鋼網篩等。
冷凍管被應用于卵巢組織的程序化冷凍,但因管壁較厚和所需較多冷凍液,導致降溫速度慢,不能滿足玻璃化形成的需要。在本研究中,冷凍管玻璃化組的正常形態原始卵泡僅為64.57%,凍存效果顯著低于其他組。Yeoman等[4]使用直接微滴法玻璃化冷凍猴子的卵巢組織,復溫后約70.4%的卵泡保存正常形態。本研究中也使用了該方法玻璃化冷凍人卵巢組織,復溫后形態學檢測可見約78.36%的原始卵泡保存了正常形態,低于新鮮組和SSV組;體外培養后,生長卵泡比例增加,但仍低于新鮮組和SSV組,提示直接微滴玻璃化對卵巢組織中原始卵泡的形態及發育潛能存在一定影響。
固相表面玻璃化法是近年新出現的一種有效、簡便的玻璃化技術,曾成功用于玻璃化冷凍牛成熟卵母細胞[11]和羊卵巢組織[12]。與前述各載體相比,SSV法具有其獨特的優勢:首先,由于該方案是直接將組織置于已經在液氮中半懸預冷至-150~-180℃的固相表面,因而可以避免液氮蒸發產生氣泡導致的熱傳導阻滯[13];其次,SSV技術與液氮接觸的相對面積更大,而且可以將冷凍組織所需的冷凍保護劑減至最少,從而提高降溫速度,促進玻璃化的形成[12]。第三,應用此方法可以冷凍較大體積的卵巢組織,能在較短時間內完成大量卵巢皮質的冷凍保存。第四,在SSV方法中,因直接將載有組織的玻璃態微滴浸入37℃復溫溶液中,可以很快復溫,避免冰晶再形成的發生從而減少對組織細胞的損傷。目前在SSV方法中使用的預冷的固相表面材料多報道為鋁箔,主要原因是鋁箔兼具優良的導熱性和延展性,且價格便宜,便于操作。
筆者曾率先將SSV技術用于保存人卵巢組織,并證實其冷凍效果與傳統的程序化冷凍效果相當。在本研究中,進一步將SSV與其他載體(冷凍管、最小微滴法和不銹鋼網篩)相比,探討對解凍后卵巢組織中卵泡形態和體外生長能力及激素分泌功能的影響。結果顯示,解凍后,SSV組約有84.70%的原始卵泡維持了正常的形態,雖稍低于新鮮卵巢組織正常形態率(約90.27%),但與其他文獻報道的冷凍后70%~90%的原始卵泡正常形態率大致相當[14-15]。凍融的卵巢組織培養后原始卵泡比例比新鮮未培養組降低,生長卵泡比例增加。SSV組生長卵泡比例明顯高于其他玻璃化組,培養液中雌二醇和孕酮平均濃度亦高于其他玻璃化組。由此證實SSV技術比冷凍管、最小微滴法和不銹鋼網篩作載體有優越之處,更適合人卵巢組織的有效玻璃化凍存。
[1]Lass A,Silye R,Abrams DC,et al.Follicular density in ovarian biopsy of infertile women:a novel method to assess ovarian reserve [J].Hum Reprod,1997,12:1028-1031.
[2]Jackson PR,Jackson JE,Raney DE.A sterile leakpro of plastic vial for cell cryopreservation in liquid nitrogen:application to parasitic protozoa[J].Cryobiology,1981,18:608-611.
[3]Vajta G,Holm P,Kuwayama M,et al.Open Pulled Straw(OPS)vitrification:a new way to reduce cryoinjuries of bovine ova and embryos[J].Mol Reprod Dev,1998,51:53-58.
[4]Yeoman RR,Wolf DP,Lee DM.Coculture of monkey ovarian tissue increases survival after vitrification and slow-rate freezing[J].Fertil Steril,2005,83(Suppl 1):1248-1254.
[5]彭艷,于叢一,李予,等.慢速冷凍和玻璃化冷凍對人類卵巢組織中卵泡形態的影響[J].中山大學學報:醫學科學版,2007,28(1):70-74.
[6]Huang L,Mo Y,Wang W,et al.Cryopreservation of human ovarian tissue by solid-surface vitrification[J].Eur J Obstet Gynecol Reprod Biol,2008,139(2):193-198.
[7]Scott JE,Carlsson IB,Bavister BD,et al.Human ovarian tissue cultures:extracellular matrix composition,coating density and tissue dimensions[J].Reprod Biomed Online,2004,9(3):287-293.
[8]Gougeon A.Dynamics of follicular growth in the human:a model from preliminary results[J].Hum Reprod,1986,1(2):81-87.
[9]Liebermann J,Nawroth F,Isachenko V,et al.Potential importance of vitrification in reproductive medicine[J].Biol Reprod,2002,67(6):1671-1680.
[10]Vajta G,Holm P,Greve T,et al.Vitrification of porcine embryos using the Open Pulled Straw(OPS) method[J].Acta Vet Scand,1997,38(4):349-352.
[11]Dinnyés A,Dai Y,Jiang S,et al.High developmental rates of vitrified bovine oocytes following parthenogenetic activation,in vitro fertilization,and somatic cell nuclear transfer[J].Biol Reprod,2000,63(2):513-518.
[12]Santos RR,Tharasanit T,Van Haeften T,et al.Vitrification of goat preantral follicles enclosed in ovarian tissue by using conventional and solid-surface vitrification methods[J].Cell Tissue Res,2007,327(1):167-176.
[13]Bagis H,Mercan HO,Cetin S,et al.The effect of equilibration time on survival and development rates of mouse pronuclear-stage embryos vitrified in solid surface(SSV)and convential straws:in vitro and in vivo evaluations[J].Mol Reprod Dev,2005,72(4):494-501.
[14]Donnez J,Dolmans MM,Demylle D,et al.Livebirth after orthotopic transplantation of cryopreserved ovarian tissue[J].Lancet,2004,364(9443):1405-1410.
[15]Meirow D,Levron J,Eldar-Geva T,et al.Pregnancy after transplantation of cryopreserved ovarian tissue in a patient with ovarian failure after chemotherapy[J].N Engl J Med,2005,353(3):318-321.

