濱州地區雞大腸桿菌的分離鑒定及藥敏試驗
齊鳳云 孫少麗(①山東農業大學動物科技學院 271018 山東省濱州第二高級技師學院)
?
濱州地區雞大腸桿菌的分離鑒定及藥敏試驗
齊鳳云①②孫少麗②(①山東農業大學動物科技學院 271018 ②山東省濱州第二高級技師學院)
從濱州地區各養雞場的發病雞中分離出大腸桿菌,經常規方法培養、純化、鏡檢及生理生化鑒定,分離出的18株雞致病性大腸桿菌12株分離株被鑒定出血清型,血清型主要有078、035、036、01、02、05、018。藥敏試驗結果表明:分離的大腸桿菌對氟苯尼考,丁胺卡那霉素,新霉素,慶大霉素敏感,對環丙沙星,強力霉素,諾氟沙星中度敏感,而對紅霉素,青霉素,鏈霉素產生了耐藥。
雞 大腸桿菌 分離鑒定 耐藥
大腸桿菌病是由大腸埃希氏菌(Escherchia Coli)的某些血清型菌株所引起的一類傳染病的總稱。此試驗是采集濱州地區雞的病料進行分離鑒定和耐藥試驗,從而為當地農戶提供幫助,提高經濟效益。
1 材料與方法
1.1 材料
1.1.1 病料來源 病料來源于濱州地區各養殖場及養殖戶送檢的病、死雞,臨床剖檢有典型心包炎、肝周炎、氣囊炎或卵黃性腹膜炎,疑似為大腸桿菌病。
1.1.2 培養基 營養瓊脂、營養肉湯、麥康凱瓊脂均購于上海伯奧生物科技有限公司。微量生化發酵管,購于杭州天和微生物試劑有限公司。
1.1.3 藥敏試紙 紅霉素、環丙沙星、青霉素、氟苯尼考、鏈霉素、慶大霉素、氟呱酸、丁胺卡那霉素、強力霉素、新霉素等10種藥敏試紙片購自杭州天和微生物試劑有限公司。
1.1.4 試驗動物 小鼠購自山東省醫學實驗動物中心。
1.1.5 主要儀器 超凈工作臺,上海市躍進醫療器械一廠;培養箱,上海市躍進醫療器械一廠;高壓蒸汽滅菌器,山東新華醫療股份有限公司;光學顯微鏡、電子天平,上海市躍進醫療器械一廠。
1.2 方法
1.2.1 培養基的制備 血瓊脂平板的制備:按常規法(謝正腸等,1994)制備,加入5%的綿羊血,冷卻后置于4℃冰箱中備用。營養瓊脂平板和麥康凱瓊脂平板的制備:按常規法(謝正腸等,1994)制備,冷卻后于37。C溫箱培養16~24h,檢查無菌后置于4℃冰箱備用。營養肉湯的制備:按常規法(謝正腸等,1994)制備,冷卻后于4℃冰箱中備用。
1.2.2 細菌分離鑒定 選擇疑似大腸桿菌病死雞的病料接種于普通營養瓊脂平板上,經過37℃培養16~24h,然后對可疑菌株再進行操作。
1.2.3 染色鏡檢 按常規步驟進行染色。
1.2.4 病原菌的分離純化及生化試驗 取病料無菌接種于普通營養瓊脂平板上,經過37℃培養18~24h后,觀察結果。選取具有隆起、圓形、光滑、濕潤、半透明的近無色的菌落,分別劃線接種于麥康凱瓊脂和伊紅美蘭瓊脂平板上,置37℃培養18~24h,4℃保存備用。分別作各種糖發酵試驗吲哚試驗、三糖鐵試驗、尿素酶試驗、MR、V-P。
1.2.5 致病力測定 隨機抽取麥康凱上純培養的菌落,接種于營養肉湯中,取24h內培養物作注射液,腹腔接種于健康1日齡小雞,每只小雞注射0.2ml,每株菌注射2只小雞,并作對照。24h內發病并死亡者,判定為高致病力菌株。24~48h內發病并死亡者,判定為中致病力菌株記錄死亡數,48h后死亡者判定為低致病力菌株。然后,從死亡雞的心、肝中回收接種菌。
1.2.6 分離菌的血清型鑒定 (1)抗原的制備。將純培養的被檢驗菌株接種于普通瓊脂斜面小管和普通肉湯小瓶培養基(50ml),于37℃培養24h,期間震蕩肉湯數次。用0.5%石炭酸生理鹽水洗下普通瓊脂斜面小管培養物,然后以2000r/min離心5min,取上懸液以2000r/min離心10min,取沉淀物制成濃稠菌懸液,放于小圓底試管中,再與普通肉湯小瓶培養物一起于121℃高壓2h,4℃保存備用。(2)血清的稀釋。多價血清的配制:將多種大腸埃希氏菌因子凍干血清混合溶解于0.5%石炭酸生理鹽水10ml,裝入小瓶,蓋緊,4℃冰箱保存。單因子血清的配制:將每種大腸埃希氏菌因子血清溶解于5ml 0.5%石炭酸生理鹽水中,置于小瓶,蓋緊,置4℃冰箱保存。(3)玻板凝集反應。取試管己制成的高壓抗原,先與大腸埃希氏菌多價血清進行玻板凝集反應,然后再與大腸埃希氏菌單因子血清進行玻板凝集反應。把高壓抗原和血清各取一鉑金耳置玻板上混勻,0.5min內出現明顯凝集者為“陽性”。同時以高壓抗原與0.5%石炭酸生理鹽水混合物作對照,觀察有無自凝集現象。最終結果判定:以“++”作為被檢抗原的效價終點。
1.2.7 藥敏試驗 接種環挑取適量細菌培養物,以劃線方式將細菌涂布到平皿培養基上,將平皿培養基置于37℃溫箱中培養24h后,觀察效果。判定標準見表1。
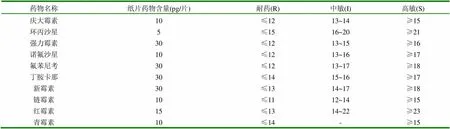
表1 藥敏紙片的種類及判定標準抑菌圈直徑 (mm)
2 結果
2.1 細菌分離鑒定
2.1.1 細菌分離 37℃培養24h后,普通肉湯呈均勻混濁,試管底部有淡白色粘稠沉淀,輕輕搖晃呈云霧狀散開,并有臭糞味。在營養瓊脂平板上,為圓形微凸起,表面光滑濕潤,中等大小,淺灰色半透明菌落,在血液瓊脂上出現邊緣整齊,菌落較大,并有隆起的灰白色菌落,多數不溶血。在麥康凱瓊脂平板上,形成中等大小表面光滑濕潤的粉紅色菌落。在伊紅美藍瓊脂平板上,形成帶有金屬光澤的紫黑色小菌落。
2.1.2 細菌鑒定 從濱州不同的鄉鎮的20多個雞場病例中,共分離到18株疑似大腸桿菌。病死雞心、肝組織及培養物涂片染色鏡檢可見大多數分散排列,兩端鈍圓,偶爾有2~3個連在一起,兩端濃染的革蘭氏陰性短桿菌。分離到的18株菌,各菌均對大多數糖類(葡萄糖、果糖、乳糖、麥芽糖、甘露糖,緩慢發酵蔗糖)產酸產氣,MR試驗陽性,V-P試驗陰性,產生靛基質,三糖鐵底層產酸,尿素酶試驗陰性。見表2。
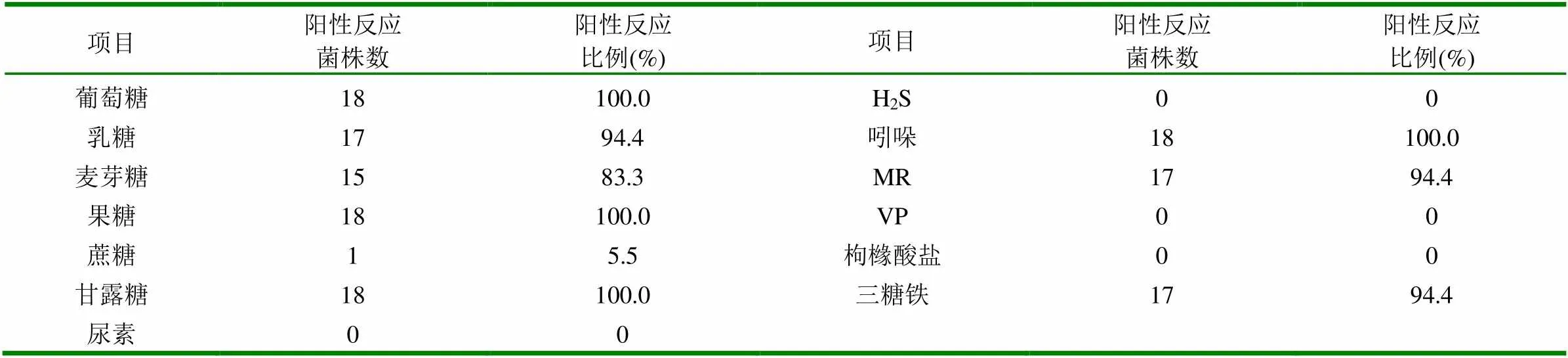
表2 18株分離菌的生化鑒定結果
2.2.3 分離菌株的致病性結果 根據雛雞及小鼠接種大腸桿菌后出現的癥狀、剖檢變化的不同及死亡時間,可以將所分離的大腸桿菌分為3組。強毒組,有10株接種后24h內小鼠及雛雞全部死亡;剖檢呈急性敗血癥變化,死亡雛雞在剖檢時,表現為纖維素性心包炎,心包積液,心包膜心外膜有大量纖維蛋白沉著;氣囊炎,氣囊表面及氣囊中有量黃白色干酪樣滲出物;脾臟腫大、出血肝周炎、肝臟表面被一層薄膜狀的纖維素性滲出物班蓋。中毒組,有5株接種后24h內小鼠及雛雞各死亡2/3,雛雞及小鼠均出現腹瀉,精神沉郁等癥狀。弱毒組,有3株接種后24h內1/3的小鼠及雛雞致死,雛雞、小鼠出現精神沉郁、腹瀉等癥狀。從死亡雞及小鼠肝臟、心血及脾臟回收細菌的染色、生化特性與接種菌一致。
2.2.4 血清型鑒定結果

表3 18株分離菌血清型鑒定結果
從表3中可以看到:18株分離的菌株中,定型菌株有12株,6株未定型。血清型主要有078、035、036、01、02、05、018。其中078共有4株占33.3%,035共有3株占25%為濱州的優勢血清型。
2.2.5 藥敏試驗結果見表4。
由表4可以看出:分離的大腸桿菌對氟苯尼考,丁胺卡那霉素,新霉素,慶大霉素不同方位高度敏感,對環丙沙星,強力霉素,諾氟沙星中度敏感,而對紅霉素,青霉素,鏈霉素產生了耐藥。

表4 濱州地區不同方位分離菌平均抑菌圈直徑 (mm)
3 討論
3.1 病原的特點
試驗結果表明:從8個不同鎮20個雞場分離到的18株菌對大多數糖類產酸產氣,V-P試驗陰性,產生靛基質,MR試驗陽性,三糖鐵底層產酸,尿素酶試驗陰性。這都符合大腸桿菌的特征;分離菌株接種雛雞均具有致病性。其中55.56%的分離菌株具有高致病性,27.78%的分離菌株具有中致病性,16.67%的分離菌株具有低致病性。由此可見,雞大腸桿菌病給生產帶來巨大的損失。
3.2 病原的來源
致病型大腸桿菌優勢血清型在我國不同地區種類差異很大,本次試驗分離的078、035是濱州地區的優勢血清型。同一地區,血清型差異也很大,這可能與雞苗的來源不同有關系。雞苗的大流通可能帶來了大腸桿菌的傳播。
3.3 病原變異的原因
環境中大腸桿菌耐藥性菌株越來越多,這主要是與以下幾種因素有關:首先用藥過程中劑量、選藥、療程不當;其次是嚴重濫用抗生素。現在幾乎所有的養雞戶都在濫用抗菌素的現象。臨床中,抗菌素也能造成雞病,對養雞業造成一定危害。
3.4 影響藥敏結果的因素
(1)培養基:應根據試驗菌的營養需要進行配制。傾注平板時,厚度合適約5~6nm,不可太薄,一般直徑的培養皿90nm,傾注18~20ml培養基為宜。培養基內應盡量避免有抗菌藥物的拮抗物質,如鈣、鎂離子能使氨基糖營類的抗菌活性降低,胸腺嚓陡核普和對氨苯甲酸能拮抗磺胺藥和TMP的活性。(2)細菌接種量:細菌接種量應該穩定,如果太多,抑菌圈就會變小,能產酶的菌株更可破壞藥物的抗菌活性。(3)藥物濃度:抑菌試驗的結果受藥物的濃度和總量直接影響,需精確配制。商品藥應嚴格按照其推薦治療量配制。(4)培養時間:一般培養溫度和時間為37℃ 9~20h,有些抗菌藥擴散慢。如多粘菌素,可將已放好抗菌藥的平板培養基,先置5℃冰箱內2~5h,使抗菌藥預擴散,然后培養在37℃溫箱中,可以延長細菌的生長,而得到較大的抑菌圈。
3.5 防治的藥物
臨床用氟苯尼考、丁胺卡那霉素、慶大霉素、硫酸新霉素可以達到比較好的效果。但隨著耐藥菌株的日益增多,抗生素對大腸桿菌的防治效果越來越差,而且現在藥物用量也越來越大,最后會導致藥物殘留,從而影響家禽產品質量,威脅人類的健康。因此,加強生物安全措施,合理使用疫苗,選擇有效的抗生素,才是控制大腸桿菌最經濟有效的方法。
4 結論
(1)從濱州地區分離到雞致病性大腸桿菌18株菌株,通過O因子血清學鑒定,定型菌株有12株,6株未定型。血清型主要有078、035、036、01、02、05、018。其中078共有4株占33.3%,035共有3株占25%為濱州地區的優勢血清型。(2)藥敏試驗結果表明,分離的大腸桿菌對氟苯尼考,丁胺卡那霉素,新霉素,慶大霉素敏感,對環丙沙星,強力霉素,諾氟沙星中度敏感,而對紅霉素,青霉素,鏈霉素產生了耐藥。(3)致病性試驗中,高致病性菌株有10株,中度致病菌株有5株,低致病性菌株有3株,分別占試驗菌株總數的55.6%、27.8%、16.7%。
[1] 林維慶. 雞大腸桿菌病[J]. 華南農業大學學報,1991, 12(3): 7-13.
[2] 邵華斌等. 湖北省雞大腸桿菌病流行情況調查及病原分離鑒定[J]. 中國獸醫科技, 1998, 28(9):14-15.
[3] 陸承平主編. 獸醫微生物學匯[M]. 第3版. 北京: 中國農業出版社, 2001.215-223.
[4] 丁伯良等. 天津地區雞致病性大腸桿菌血清型分布及其優勢血清型的外膜蛋白型研究[J]. 動物醫學研究進展, 2003, 24(2): 94-96.
[5] 高軒等. 河北省禽病原性大腸桿菌的血清型鑒定[J]. 河北農業大學學報, 1998, 21(1): 56-59. 1996,26(3): 15-17.
[6] Chulasiri,M and O.Suthienkul.Antimicrobial resistance of Escherichia coli isolated from chichens[J].Vet microbion.1989,21,189-194.
[7] Lior, H. Classification of Escherichia coli.In C. L. Gyles(ed). Escherichia coli in Domestic Animals and Humans. CAB.Int’l, Wallingf-Ord, United Kingdom, pp. 1994. 31-72
(2012–02–23)
S858.31
A
1007-1733(2012)05-0004-03

