3.0 T MRI相位對比法評價法樂四聯癥根治術后肺動脈血流動力學的信息
劉 輝,王秋實,梁長虹*,黃美萍,謝兆豐,鄭君惠,譚紹恒
法樂四聯癥(tetralogy of Fallot, TOF)是最常見的紫紺型先天性心臟病,占先天性心臟病的5%~6%[1]。TOF根治術的目的是建立接近正常生理狀態的血流動力學,包括修補室間隔缺損和解除右室流出道梗阻。解除右室流出道梗阻常常累及肺動脈瓣膜、瓣環功能,引起肺動脈返流,導致患者預期壽命較年齡組匹配的正常人群低[2]。因此,術后肺動脈返流的評價成為臨床十分關注的問題。肺動脈血流的無創性檢查中,超聲心動圖是首選檢查方法;但超聲心動圖對返流量的估計為半定量方法,且由于受透聲窗限制,對左、右肺動脈血流顯示可能會受到很大影響。相位對比MRI (phase-contrast MR imaging, PC-MRI) 是一種既能顯示血管解剖結構,又能提供血流方向、血流速率及流量等血流動力學信息的MRI技術。本研究目的是通過3.0 T PCMRI定量測量TOF術后隨訪患者肺動脈血流,與超聲心動圖結果進行相關分析,評價3.0 T PC-MRI定量測量肺動脈返流的準確性,并分析不同手術方式對肺動脈返流的影響。
1 材料與方法
1.1 一般資料
采用3.0 T超導型MR儀(Signa EXCITE HD, GE Medical Systems, Milwaukee, Wisconsin,USA)及荷蘭Philip iE33型超聲診斷儀;專用8通道心臟相控陣線圈;MR兼容呼吸門控、外周門控及相關設備材料。
1.2 檢查對象
2008年3月至2009年2月在廣東省人民醫院于1個月內先后進行了心臟超聲心動圖及心臟MRI檢查,法樂四聯癥根治術后隨訪患者共42例(男26例,女16例,年齡10~51歲,平均年齡18.7歲)。所有患者均沒有進行心臟MRI檢查禁忌證(包括裝有心臟起搏器或其他電子裝置,止血夾等)。其中右室流出道補片組為12例(28.6%),跨瓣環補片組26例(61.9%),帶瓣管道1例(2.4%),手術方式不清楚3例(7.1%)。32例(76.2%)術后心功能評估為Ⅰ級,9例(21.4%)心功能評估為Ⅱ級,1例(2.4%)心功能評估為Ⅲ級。
1.3 MRI檢查序列及方法
MR主要掃描序列相應參數:(1)電影Fiesta掃描序列(TR/TE=最短重復時間/最短回短時間,反轉角45°,帶寬125 kHz,FOV 35 cm×35 cm,矩陣160×224,掃描層厚8.0 mm,層間距0 mm,激勵次數1,相位FOV 0.75-1,掃描時相為20個相位),包括左室垂直長軸、四腔心、右室垂直長軸、多層短軸、三腔心及右室流出道電影。(2)FastCine PC序列(TR自動選擇最小重復時間,TE 最小回波時間,反轉角20°,帶寬31.25 kHz,FOV 40 cm×40 cm,矩陣256×128,掃描層厚 5.0 mm,激勵次數1,流速編碼150 cm/s,并在此基礎上進行適當增加,以避免相位混淆。掃描時相為30個相位)進行主肺動脈血流測量。患者仰臥躺在檢查床上,線圈中心平第三前肋間,頭部先進。其中FastCine PC序列在血流方向上施加速度編碼梯度場,掃描結束后除了可得到傳統幅度圖外,還可得到反映血流信息的相位圖(圖1~3)。
1.4 多普勒超聲檢查方法
多普勒超聲對肺動脈瓣返流程度的評定采用半定量標準,即輕度:舒張期逆向血流局限于肺動脈瓣環;中度:肺動脈主干可見舒張期逆向血流,但不超過肺動脈分支水平;重度:肺動脈分支內也可見舒張期逆向血流。
1.5 MR圖像處理方法
將所有圖像數據傳至AW4.3 MR工作站,使用reportcard軟件進行數據分析。半自動方法勾畫出主肺動脈輪廓。確定感興趣區后,軟件自動計算可得到平均正向血流量[average positive flow, APF, ml/每個心動周期(beat)]、平均反向血流量(average negative flow, ANF, ml/beat)及1個心動周期內的時間-血流曲線。計算肺動脈返流分數(pulmonary regurgitation fraction, PRF)= (ANF/APF)×100%,并按照PRF把返流程度分為輕度(<20%;圖4)、中度(20%~40%;圖5)和重度(>40%;圖6)。
1.6 統計分析
所有數據用SPSS13.0統計軟件進行分析。計量資料用中位數表示。描述性分析采用Explore進行統計學分析。PC-MRI測量肺動脈返流嚴重程度(輕度、中度、重度)與超聲心動圖顯示肺動脈返流嚴重程度(輕度、中度、重度)進行相關分析,關聯程度用Spearman等級相關進行檢驗,計算相關系數rs。對于肺動脈返流嚴重程度分級(輕度、中度、重度),判斷PC-MRI與超聲心動圖比較的符合程度,計算Kappa值,K≤0.4為差,0.4<K<08為較好,優秀K≥0.8為優。PC-MRI測量得到的PRF、肺動脈ANF分別與超聲心動圖測量的肺動脈返流面積進行相關分析,關聯程度用Spearman相關進行檢驗,計算相關系數rs。進行右室流出道補片組與跨瓣環補片組PC-MRI測量得到的PRF及肺動脈ANF比較,采用Mann-Whtiney U檢驗。所有結果P<0.05為差異有統計學意義。
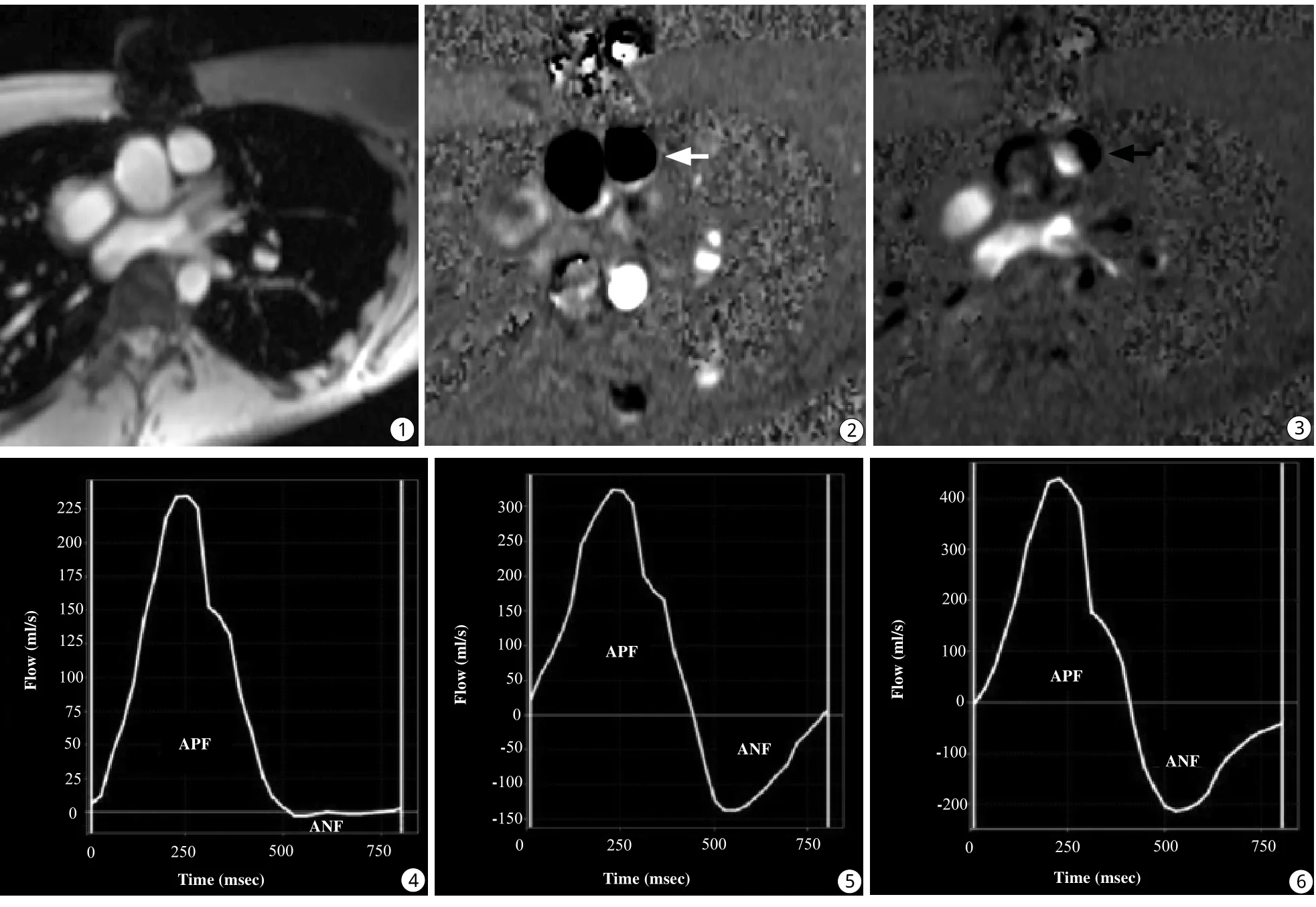
圖1~3 FastCine PC掃描得到同一層面肺動脈的幅度圖(圖1)及收縮期(圖2)、舒張期(圖3)相位圖,收縮期顯示肺動脈前向血流低信號(白箭),舒張期肺動脈內見高信號反向血流(黑箭) 圖4 輕度返流 一個心動周期內肺動脈時間-血流曲線。平均正向血流量(APF)為57.4 ml/beat,平均反向血流量(ANF)為0.9 ml/beat。肺動脈返流分數(PRF)=ANF/APF×100%=1.6%,為輕度返流 圖5 中度返流。APF為83.9 ml/beat,ANF為33.4 ml/beat。PRF= ANF/APF×100%=39.8% 圖6 重度返流。APF為100.5 ml/beat,ANF為60.7 ml/beat。PRF= ANF/APF×100%=60.4%Fig. 1—3 Magnitude image (Fig. 1), phase-velocity image in systole (Fig. 2) and in diastole (Fig. 3) shows pulmonary artery in cross section. on a phase-velocity imaging during systole, antegrade flow of the pulmonary artery shows low signal intensity(white arrow), high signal intensity on phase image is indicative of retrograde pulmonary regurgitation flow (black arrow) during diastole. Fig. 4 Mild PR graph illustrates flow (in milliliters per second) versus time (in milliseconds) during phase-contrast imaging. Average positive flow (APF) was 57.4 ml/beat, average negative flow (ANF) was 0.9 ml/beat, Pulmonary regurgitation fraction (PRF) was the ratio of ANF (regurgitation) to APF. In this case, the severity of PR was mild. Fig. 5 Moderate PR. In this case , APF was 83.95 ml/beat, ANF was 33.4 ml/beat, PRF was 39.8%. Fig. 6 Severe PR. In this case, APF was 100.5 ml/beat ,ANF was 60.7 ml/beat, PRF was 60.4%.
2 結果
對肺動脈返流嚴重程度(輕度、中度、重度)的測量,超聲心動圖顯示輕度肺動脈返流10例(23.8%),中度32例(76.2%),無重度肺動脈返流;而MRI分別顯示輕度、中度、重度肺動脈返流分別為10例(23.8%),8例(19.0%)及24例(57.1%);PC-MRI與超聲心動圖結果具有明顯正相關性(rs=0.606,P<0.01)(表1)。把肺動脈返流分為輕度及中重度2組,PC-MRI與超聲心動圖的符合程度為K=0.606 (P<0.001),兩者的符合程度較好。MRI能進一步把中度及重度肺動脈返流識別出來。
PC-MRI測量PRF與超聲心動圖測量的肺動脈返流面積具有正相關關系(PRF中位數為45.57%,超聲心電圖測量肺動脈返流面積中位數為4.6 cm2),但相關性并不密切 (rs=0.438,P=0.004)。PC-MRI測量肺動脈ANF (中位數為38.05 ml/beat)與超聲心動圖測量的肺動脈返流面積具有明顯正相關性 (rs=0.559,P<0.01)。
右室流出道補片組及跨瓣環補片組PRF中位數分別為7.96%、48.60%,與右室流出道補片組相比,跨瓣環補片組的PRF更高(U=52.000,P=0.001)。兩組肺動脈ANF中位數分別為5.45 ml/beat、45.70 ml/beat,跨瓣環補片組ANF更多 (U=55.000,P=0.002)。

表1 PC-MRI與超聲心動圖測量肺動脈返流嚴重程度(例)Tab. 1 the severity of PR measured by PC-MRI and echocardiography(cases)
3 討論
TOF是以包括肺動脈狹窄、主動脈騎跨、室間隔缺損及右心室肥厚病理改變為特征的先天性心臟病,是最常見的紫紺型先天性心臟病,約占紫紺型先天性心臟病的50%。隨著外科技術水平的逐步提高,出生后幾個月內進行的根治性手術死亡率低,已經成為治療TOF切實可行的手段[3]。TOF根治術手術方式主要是修補室間隔缺損,解除右室流出道梗阻及重建右室流出道(包括右室流出道補片擴大或跨瓣環補片擴大)。但TOF手術后并發癥、殘余病變可能會成為影響預后的嚴重問題,因此術后密切隨訪以早期發現問題并進行及時臨床干預成為必須。在TOF根治術后隨訪中,理想的影像檢查手段最好能夠全面、準確提供以下信息:(1)殘余解剖結構異常:殘余室間隔缺損,殘余肺動脈狹窄,右室流出道動脈瘤;(2)判斷肺動脈狹窄程度;(3)測量肺動脈返流量;(4)測量雙側心室大小及功能[4]。
心導管術是一種有創傷性檢查方法,不適于TOF術后的常規隨訪。無創性檢查方法成為TOF術后隨訪的重要方向之一。超聲心動圖是TOF根治術后隨訪最常用、最主要的無創性檢查方法。但該檢查方法由于受透聲窗限制,尤其是肺內氣體和胸壁骨骼的干擾,顯示心底血管及分支、右室大小和功能能力欠佳;血流動力學方面主要提供血流方向及流速,不能準確提供流量信息[5-6]。因此在TOF術后隨訪中測量右心室大小、功能,判斷肺動脈返流量的準確性受到一定的限制。MRI可進行心血管系統的無創性成像,不受成像平面及透聲窗影響,能提供解剖結構及心臟功能的高質量圖像,MR流動分析技術為無創性檢測肺動脈血流動力學變化提供了一種行之有效的新方法。
文獻報道TOF術后幾乎每例患者都存在返流,出現重度肺動脈返流比例更高達30%以上[7]。其原因多由于跨瓣環補片手術擴寬了原來的肺動脈瓣環,導致了肺動脈瓣關閉不全,也有學者認為術中為了疏通右室流出道,需切除流出道大塊肌束,引起漏斗部擴張,導致支撐肺動脈瓣的肌柱失去穩定性,從而形成肺動脈瓣關閉不全而產生返流[8]。本組PCMRI顯示所有患者均有不同程度返流,輕度、中度及重度肺動脈返流分別為占總數的23.8%,19.0%及57.1%與文獻報道相符。
目前,超聲心動圖對肺動脈瓣返流程度的評價多采用半定量標準,按照舒張期逆向返流束的位置判斷返流的程度,但沒有準確的定量指標。在本研究中,通過超聲心動圖的半定量指標與PC-MRI結果的比較,發現兩者在判斷肺動脈返流嚴重程度上具有很好的相關性,在區別輕度與中重度肺動脈返流上,兩種檢查具有較好一致性(k=0.606,P<0.01)。但超聲心動圖不能更進一步準確區分中度與重度肺動脈返流,而PC-MRI則可完成這一步分析。這也提示,當超聲心動圖檢查判斷肺動脈返流結果為輕度時,其診斷是較為可靠的,但其結果為中度肺動脈返流時,可能需要進一步進行PC-MRI檢查,以判斷其真實返流程度。已經有文獻證實,PC-MRI是測量肺動脈血流動力學信息的準確工具[9-10]。本研究結果顯示,PC-MRI測量肺動脈ANF與超聲心動圖測量的肺動脈返流面積具有明顯正相關性,這種相關性從理論上可以闡明,PC-MRI測量的肺動脈ANF與超聲心動圖測量的肺動脈返流面積均僅測量反向血流量,可簡單理解為前者為反向肺動脈血流的容積概念,而后者為面積概念,因此兩者具有相關性也就有據可查。這也提示能否進一步以超聲心動圖的返流面積作為判斷肺動脈返流程度的定量指標?PCMRI測量PRF與超聲心動圖測量的肺動脈返流面積具有正相關關系,但相關性并不密切,這可能是由于PRF反應的是肺動脈反向血流與正向血流之比的緣故。
在右室流出道重建術中,常使用自體心包補片進行右室流出道補片(無瓣環或肺動脈干狹窄)或跨瓣環補片(流出道狹窄,同時有瓣環或肺動脈干狹窄),部分患者置入帶瓣管道連接右室流出道及肺動脈。本組右室流出道補片組為12例(28.6%),跨瓣環補片組26例(61.9%),占總數的絕大多數。兩組PRF中位數分別為7.96%、48.60%,跨瓣環補片組的PRF更高;兩組肺動脈ANF中位數分別為5.45、45.70 ml/beat,跨瓣環補片組ANF更多(P<0.05)。肺動脈瓣環實質上是肌肉組織,具有收縮作用,能夠防止肺動脈返流發生,跨瓣環補片手術一方面擴寬了原來的肺動脈瓣環,同時也破壞了瓣環的收縮功能,因而常發生重度肺動脈返流。僅右室流出道補片則可最大程度的保留瓣環功能,對防止發生肺動脈返流起著一定程度的積極作用。Geva等[11]比較了帶瓣管道組與跨瓣環補片組肺動脈返流差異,也得到了類似的結果。這些結果說明,在這3種右室流出道重建術中,跨瓣環補片所引起的肺動脈返流程度更為嚴重,PC-MRI能夠從血流動力學改變方面解釋這些解剖學結構的變化。
綜上所述,3.0 T PC-MRI測量肺動脈返流嚴重程度與超聲心動圖有很好相關性,同時可提供定量測量信息。3.0 T PC-MRI能準確反映右室流出道補片及跨瓣環補片手術所致肺動脈血流動力學差異。
[References]
[1] Hoffman JI. Incidence of congenital heart disease: I.Postnatal incidence. Pediatr Cardiol, 1995, 16(3): 103-113.
[2] Murphy JG, Gersh BJ, Mair DD, et al. Long-term outcome in patients undergoing surgical repair of tetralogy of Fallot.N Engl J Med, 1993, 329(9): 593-599.
[3] Tamesberger MI, Lechner E, Mair R, et al. Early primary repair of tetralogy of Fallot in neonates and infants less than four months of age. Ann Thorac Surg, 2008, 86(6):1928-1936.
[4] Helbing WA, de Roos A. Clinical applications of cardiac magnetic resonance imaging after repair of tetralogy of Fallot. Pediatric Cardiology, 2000, 21(1): 70-79.
[5] Marx GR, Geva T. MRI and echocardiography in children:how do they compare? Semin Roentgenol, 1998, 33(3):281-292.
[6] Finsterer J, Stollberger C. Cardiac MRI versus echocardiography in assessing noncompaction in children without neuromuscular disease. Pediatr Radiol, 2006,36(7): 720-723.
[7] Borowski A, Ghodsizad A, Litmathe J, et al. Severe pulmonary regurgitation late after total repair of tetralogy of Fallot: surgical considerations. Pediatric Cardiology,2004, 25(5): 466-471.
[8] Vliegen HW, van Straten A, de Roos A, et al. Magnetic resonance imaging to assess the hemodynamic effects of pulmonary valve replacement in adults late after repair of tetralogy of fallot. Circulation, 2002, 106(13): 1703-1707.
[9] Lei XY, Shen YM, Guo YM, et al. Measurement of pulmonary flow velocity:a comparison of doppler ultrasound and MRI. J Pract Radiol, 2006, 22(1): 27-29.雷曉燕, 沈亞梅, 郭佑民, 等. 肺動脈流速的MRI測量與多普勒超聲比較研究. 實用放射學雜志, 2006, 22(1):27-29.
[10] Chang SX, Kong XQ, Feng GS, et al. Hemodynamics of pulmonary arterial quantitative analysis:a comparative study of simultaneous phase-contrast MR imaging and cardiac catheterization study. Chin J Radiol, 2001,35(6):426.常時新, 孔祥泉, 馮敢生, 等. MR相位速度圖及心導管檢查對肺動脈血液動力學的對比研究. 中華放射學雜志, 2001, 35(6): 426.
[11] Geva T, Sandweiss BM, Gauvreau K, et al. Factors associated with impaired clinical status in long-term survivors of tetralogy of Fallot repair evaluated by magnetic resonance imaging. J Am Coll Cardiol, 2004,43(6): 1068-1074.

