頭孢噻呋鈉在成年麻鴨體內的藥代動力學研究
徐 俊,曹芳元,徐 敏,祝 圓,邱銀生
(武漢工業學院動物科學與營養工程學院,武漢 430023)
頭孢噻呋具有廣譜殺菌作用,對革蘭氏陽性、革蘭氏陰性包括產 β-內酰胺酶菌株均有效[1]。頭孢噻呋在豬、牛、馬等家畜體內的藥動學已有研究[2-3],牛、豬等肌內注射頭孢噻呋后,吸收迅速,血液和組織中藥物濃度高,有效血藥濃度維持時間長,消除緩慢,半衰期長。頭孢噻呋在家禽體內的藥動學研究較少,已見頭孢噻呋在雛鴨體內的藥動學研究報道[4]。本試驗采用 HPLC 法[5]檢測血漿中的頭孢噻呋濃度,研究頭孢噻呋鈉在成年麻鴨體內的藥動學特征,為頭孢噻呋鈉在成年麻鴨的合理應用提供科學依據。
1 材料和方法
1.1 材料
1.1.1 藥品與試劑 脫呋喃甲酰頭孢噻呋(DFC)標準品(Sigma-Aldrich公司);注射用頭孢噻呋鈉凍干粉(齊魯動物保健品有限公司,批號1002005.1);二硫赤蘚糖醇(DTE,Sigma公司);三氟乙酸(TFA,國藥集團化學試劑有限公司);乙腈、甲醇(色譜純,天津市科密歐化學試劑有限公司);醋酸銨、硼砂(分析純,天津市科密歐化學試劑有限公司)。
1.1.2 實驗動物 30只成年麻鴨購自武漢市黃陂區某鴨場,雌雄兼有,飼喂不含任何抗菌藥物的全價飼料。預飼一周后,體重在(1.6±0.2)kg,從中選取無臨床癥狀的健康鴨24只,供藥動學試驗用。
1.1.3 儀器設備 Waters 1525型高效液相色譜儀;Waters 2489型紫外/可見光檢測器;BF-S 2500C型固相萃取儀(北京八方世紀科技有限公司);TGL-16C型高速離心機(上海安亭科學儀器廠)。
1.2 方法
1.2.1 給藥方法及樣品采集 24只健康的成年麻鴨隨機分為3組,試驗前禁食12 h,按2 mg/kg劑量單次靜脈注射、肌內注射和灌服給藥。給藥后5、10、15 min 和0.5、1、1.5、2、4、6、8、10、12、24 h 采取鴨翼根靜脈血樣3 mL,置于肝素鈉抗凝管中,離心分離得到血漿,置于-20℃冰箱保存待測。
1.2.2 色譜條件 色譜柱為Waters Symmetry C18柱(5μm,150 mm ×4.6 mm);檢測波長為 266 nm;流動相由乙腈(A)和0.1%TFA(B)組成,采用梯度洗脫,洗脫程序見表1。柱溫30℃,進樣量20 μL。
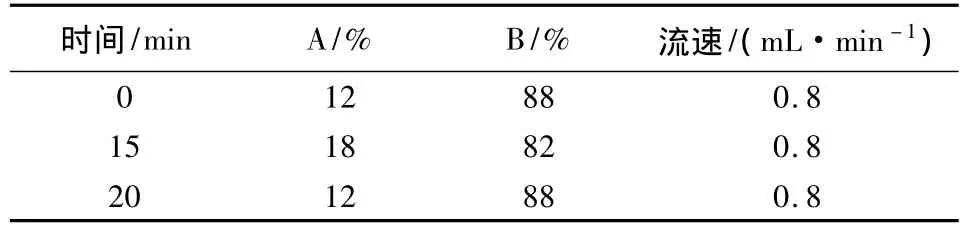
表1 梯度洗脫程序
1.2.3 血漿樣品的預處理 取血漿樣品1 mL于離心管中,加入7 mL 0.4%DTE-硼酸鹽緩沖液,充分振蕩混合,在50℃水浴30 min。水浴結束后,取出冷卻至常溫,離心取上清液備用。用3 mL甲醇對Oasis HLB SPE小柱進行潤洗活化,再用3 mL超純水沖洗平衡小柱。上述提取上清液過柱,調節流速讓其緩慢通過小柱,棄掉流出液。用3 mL超純水淋洗小柱,流出液棄掉。最后用2 mL乙腈-乙酸(體積比2∶3)洗脫液洗脫小柱,收集洗脫液,50℃水浴并用氮氣流吹干。加1 mL 0.05%醋酸銨水溶液溶解,渦旋震蕩后超聲清洗5 min,用0.22 μm濾膜過濾后,取20 μL進樣。
1.2.4 標準曲線及最低檢測限 稱取DFC標準品適量,用0.05%醋酸銨水溶液配制成40 μg/mL DFC標準液,取空白血漿1 mL,分別加入一定體積的DFC標準液,使得血漿中藥物濃度分別為0.25、0.5、1.0、2.5、5.0、10.0、20.0 μg/mL,按“1.2.3”的方法處理,取20 μL進行 HPLC檢測。將添加的DFC濃度與測得的峰面積進行回歸,計算回歸方程和相關系數。以信/噪比(S/N)=3時的最低藥物濃度為最低檢測限。
1.2.5 精密度的測定 取適量的 DFC標準液(40 μg/mL),稀釋成0.5、2.5、10.0 μg/mL DFC 標準液,各濃度標準液在同1 d內重復測定5次,連續測定3 d,計算色譜峰面積的日內、日間相對偏差(RSD)。
1.2.6 回收率的測定 取空白血漿1 mL,添加適量40 μg/mL DFC標準液,使得血漿中藥物濃度分別為 0.5,2.5,10.0 μg/mL,按“1.2.3”方法處理后,所測得的峰面積與同等濃度的標準溶液峰面積的比值,計算藥物提取回收率,每一濃度重復5次。
1.2.7 藥動學參數計算 血藥濃度-時間數據用DAS(Drug and Statistics)軟件進行房室模型擬合,求得藥動學參數。
2 試驗結果
2.1 色譜圖 采用梯度洗脫,DFC的保留時間約為13.2 min。色譜圖可見基線較平穩,且藥物峰與血漿中其他組分分離良好,雜峰不干擾藥物峰(圖1)。
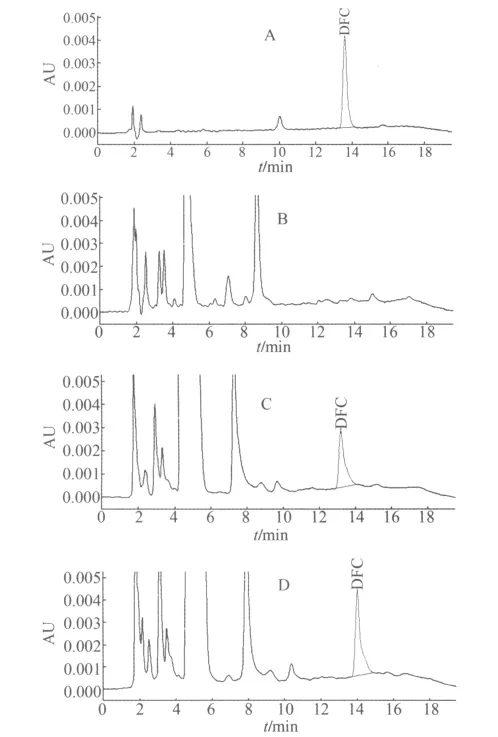
圖1 標液、空白樣品、添加樣品和實際樣品得到的色譜圖
2.2 標準曲線及最低檢測限 結果顯示,在0.25~20 μg/mL范圍內藥物濃度與峰面積的線性關系良好,r=0.9997,回歸方程為 y=11495.54x+3786。本試驗條件下,DFC的最低檢出濃度為0.1 μg/mL。
2.3 精密度的測定結果 測定不同濃度DFC的峰面積,求出其日內和日間RSD(表2)。結果表明,儀器檢測的日內和日間精密度良好。
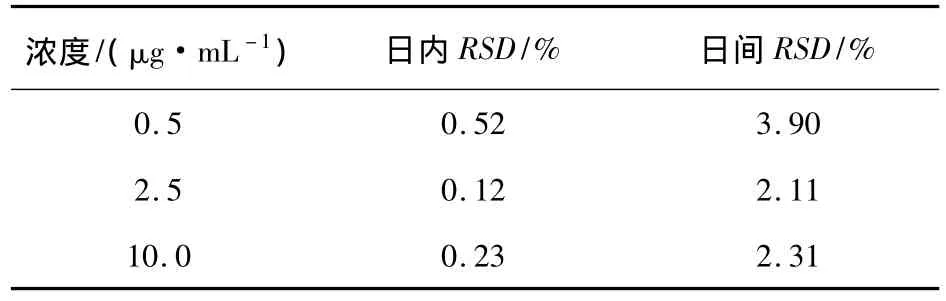
表2 精密度的測定結果(n=5)
2.4 回收率的測定結果 血漿中 DFC濃度在0.25 ~20μg/mL 范圍內,回收率為 84.7% ~91.9%,RSD 為5.35% ~6.55%(表3)。
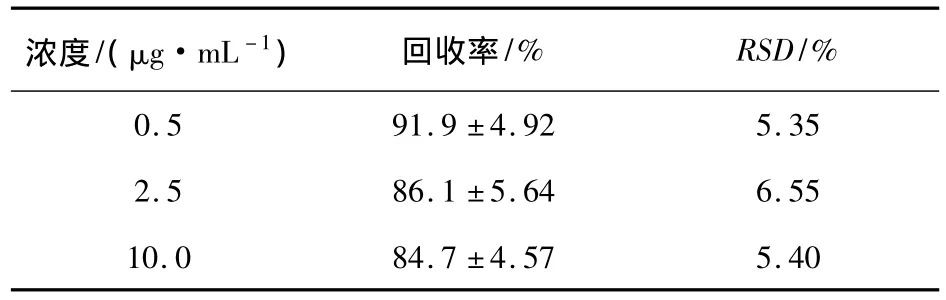
表3 回收率的測定結果(n=5)
2.5 血藥經時數據與血液藥動學參數
2.5.1 血藥經時數據 肌內注射、靜脈注射和內服頭孢噻呋鈉后的血藥經時曲線見圖2。
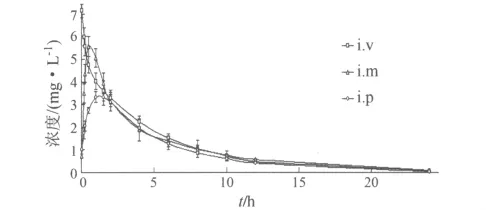
圖2 單次給藥后的血藥濃度經時曲線(2 mg/kg,n=8)
2.5.2 血液藥動學參數 單劑量2 mg/kg肌注頭孢噻呋的生物利用度為99.22% ,內服的生物利用度為79.25% 。藥動學參數見表4。
3 討論
頭孢噻呋在體內生成一級代謝物脫呋喃甲酰頭孢噻呋(DFC)。頭孢噻呋在奶牛、豬的代謝研究顯示,在這一過程中β-內酰胺環未受破壞,DFC抗菌活性與頭孢噻呋相似[6-7]。頭孢噻呋在動物體內主要以代謝物DFC的形式存在,已報道的頭孢噻呋藥動學研究中檢測物質也為DFC[4-5]。本試驗檢測方法利用DTE切斷DFC與蛋白的結合,固相萃取柱凈化后進行HPLC檢測,操作簡便、結果可靠。HPLC檢測以梯度洗脫的方式進行,該條件下DFC峰與樣品中其他雜質峰分離效果好,基線平穩且峰形良好。樣品預處理后日內、日間平均相對標準差均低于10%,符合生物樣品分析要求。

表4 靜脈注射、肌內注射與內服頭孢噻呋(2 mg/kg)后的血液動力學參數
現普遍認為頭孢噻呋內服吸收較少,臨床使用的頭孢噻呋也僅有注射制劑。本試驗研究表明,成年麻鴨內服頭孢噻呋后,吸收較為迅速,血中藥物濃度較高,有效血藥濃度維持時間長,生物利用度達到79.25%,說明該藥可以被麻鴨內服吸收;肌內注射后,吸收迅速,血中藥物濃度高,生物利用度達到99.22%。劉明春等[4]也曾報道雛鴨內服頭孢噻呋吸收良好,生物利用度達到89.54%;Amer等[8]報道30日齡的雞單次內服10 mg/kg時,血藥峰濃度達為(27.83 ±1.28)μg/mL,達峰時間(2.39 ±0.07)h。
Ritter等[9]報道大鼠、牛和豬內服頭孢噻呋后,約55%的藥物會由尿液排泄,30%由消化道及糞便排泄,吸收藥物在體內充分代謝后的產物以DFC為主,其中牛的總代謝產物中DFC占87%。在本實驗中,盡管不能準確判斷DFC是由體內代謝還是測定時轉化所得,但是由于DFC與頭孢噻呋的抗菌活性相似[10],可以認為鴨內服頭孢噻呋后可發揮抗菌效果。
綜上所述,建議在獸醫臨床治療鴨的急性感染性病例時,優先采用肌內注射給藥,若需群體給藥時也可以采取混飲或混飼給藥方式。
[1]焦 陽,劉明春,陳曉慧,等.頭孢噻呋的體外抗菌后效應研究[J].中國獸醫雜志,2008,44(2):90-91.
[2]Brown S A,Chester S T,Robb E J.Effects of age on the pharmacokinetics of single dose ceftiofur sodium administered intramuscularly or intravenously to cattle[J].Journal of Veterinary Pharmacology and Therapeutics,1996,19(1):32-38.
[3]Brown S A,Hanson B J,Mignot A,et al.Comparison of plasma pharmacokinetics and bioavailability of ceftiofur sodium and ceftiofur hydrochloride in pigs after a single intramuscular injection[J].Journal of Veterinary Pharmacology and Therapeutics,1999,22(1):35-40.
[4]劉明春,焦 陽,李 杰,等.頭孢噻呋在雛鴨體內的血液動力學及生物利用度研究[J].沈陽農業大學學報,2010,41(3):346~349.
[5]李長流,俞道進,馬玉芳,等.豬血漿中去呋喃甲酰基頭孢噻呋濃度的HPLC測定[J].福建農林大學學報(自然科學版),2010,39(1):58-62.
[6]Jaglan P S,Yein F S,Hornish R E,et al.Depletion of intramuscularly injected ceftiofur from the milk of dairy cattle[J].Journal of Dairy Science,1992,75(7):1870-1876.
[7]Gilbertson T J,Roof R D,Nappier J L,et al.Disposition of ceftiofur sodium in swine following intramuscular treatment[J].Journal of Agricultural and Food Chemistry,1995,43(1):229-234.
[8]Amer A M,Fahim E M,Ibrahim R K.Effect of aflatoxicosis on the kinetic behaviour of ceftiofur in chickens[J].Research in Veterinary Science,1998,65(2):115-118.
[9]Ritter L,Kirby G,Cerniglia C.WHO Food-Additives Series[R].1996:59.
[10] Salmon S A,Watts J L,Yancey R J.In vitro activity of ceftiofur and its primary metabolite,desfuroylceftiofur,against organisms of veterinary importance[J].Journal of Dairy Science,1996,8(3):332-336.

