高糖環境下豚鼠膀胱ICCs細胞形態的改變
范勇洪
(平頂山市第一人民醫院泌尿外科 河南 平頂山 467000)
目前研究認為ICCs可能是膀胱慢波活動的起搏器和傳導者。去除了神經和體液等干擾因素后離體膀胱平滑肌條,仍可以發生自發性興奮和收縮[1]。因此推測:DCP發病是否與膀胱ICCs樣細胞的改變有關。離體的ICCs細胞在高糖環境下變化尚未見報道。本研究通過體外培養、熒光負載的方法來觀察高糖環境對ICCs細胞形態學變化,以探討DCP功能改變的細胞生物學基礎。
1 材料與方法
1.1 主要材料與試劑
12只健康豚鼠。激光共聚焦顯微鏡META 510,膠原酶V(Sigma公司),Fluo-4 AM,葡萄糖,標準胎牛血清。
1.2 方法
1.2.1 豚鼠膀胱ICCs細胞的體外培養 脫臼處死豚鼠,無菌手術取出其膀胱,取肌層并剪成碎塊,膠原酶V消化后,制成無糖DMEM細胞懸液,接種于培養皿中,37℃培養箱中靜置培養24h,棄去皿中培養液,分別加入含5、10、15mmol/L葡萄糖的高糖DMEM細胞培養液,分別培養24、72h。
1.2.2 激光共聚焦顯微鏡觀察 Fluo-4AM工作液加入培養好ICCs細胞培養皿中,入培養箱內孵育40min,除去細胞外熒光染料,室溫下避光靜置10min。染色好Cajal間質細胞置于激光共聚焦顯微鏡下觀察。每個樣本隨機選60個ICCs細胞,掃描記錄成象。用META自帶分析軟件測量細胞長度,獲得熒光背景下每個細胞長度值。
1.3 統計學處理
2 結果
2.1 ICCs細胞形態學觀察
膠原酶消化后的細胞貼壁生長,倒置顯微鏡下可見典型的ICCs細胞,形態基本一致,以胞體為中心的向相反方向延伸的兩個長突起,可有分枝(圖1)。
2.2 免疫熒光染色
ICCs細胞Fluo-4AM熒光染色,共聚焦顯微鏡下400倍視野可見不同葡萄糖濃度、不同培養時間段的ICCs細胞,隨葡萄糖濃度的增加和培養時間的延長,ICCs細胞明顯出現胞體縮小的現象(圖2)。
2.3 ICCs細胞形態結果
參照McClosky[2]的方法,激光共聚焦掃描記錄ICCs細胞圖片,用META自帶分析軟件測量細胞長度值,統計學分析。組間比較:24h組和72h組對比,隨葡萄糖濃度增高,ICC細胞長度明顯縮短(P<0.01)。組內比較:5mmol/L組細胞長度無差異(P>0.05)。10mmol/L組隨培養時間延長細胞長度增長(P<0.01)。15mmol/L組隨培養時間延長細胞長度縮短(P<0.01)。
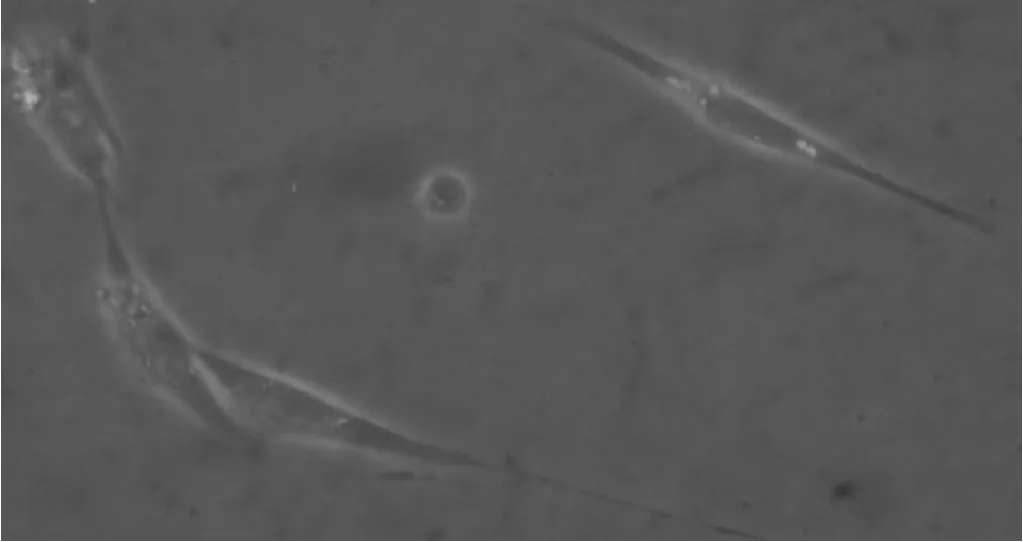
圖1 倒置顯微鏡下ICC樣細胞(×40)
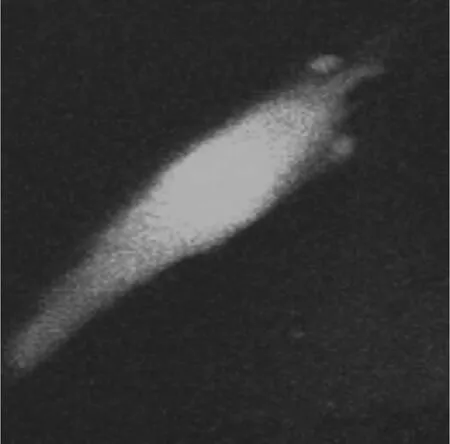
圖2-A ICC樣細胞5mol/24h(×400)
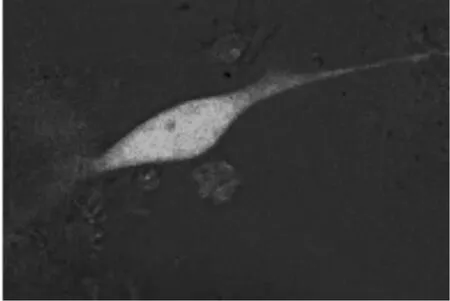
圖2-B ICC樣細胞15mol/72h(×400)
表1 不同濃度不同時間段細胞長度值比較[(單位μm),()]
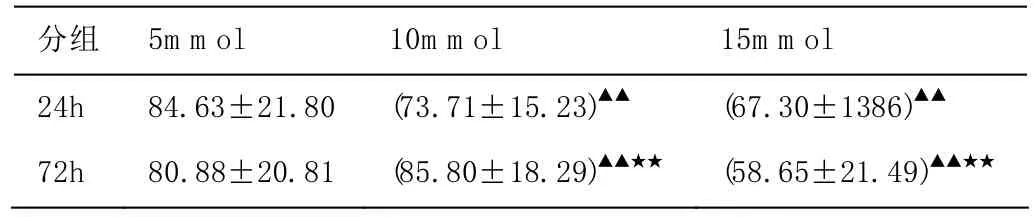
表1 不同濃度不同時間段細胞長度值比較[(單位μm),()]
注:▲▲P<0.01同一濃度間比較;★★P<0.01同一時間間比較
分組 5m m ol 10m m ol 15m m ol 24h 84.63±21.80 (73.71±15.23)▲▲ (67.30±1386)▲▲72h 80.88±20.81 (85.80±18.29)▲▲★★ (58.65±21.49)▲▲★★
3 討論
糖尿病造成多系統病變。DCP是其最常見癥狀。該病病因復雜,研究發現DCP存在逼尿肌肌細胞[3]病變、神經退化,突觸和神經遞質改變、多種因子、受體分布和含量異常[4]等,但仍無法合理解釋DCP的發病機制。眾多研究結果顯示ICCs是膀胱慢波活動的起搏器和傳導者,為我們研究DCP發病機制提供了新的思路。活體內高糖對豚鼠膀胱ICCs的數量、形態及其超微結構有影響我們前期已經證實,但離體的豚鼠膀胱ICCs在單因素高糖環境中的改變目前尚未見報導。
本研研究通過對離體的豚鼠ICCs細胞培養,觀察高糖環境下ICCs細胞形態的變化。結果顯示5mmol/L濃度環境下ICCs細胞長度無明顯差異。當葡萄糖濃度升高和培養時間延長,ICCs細胞長度明顯縮短,只有10mmoL/72h組細胞長度增長。數據分析顯示:正常生理濃度的葡萄糖對ICCs并無影響。10mol/L組24h細胞長度明顯縮短,72h又增長,可能是高糖刺激ICCs短時間抑制了ICCs的生理功能。隨培養時間延長細胞功能恢復胞內超微結構如內質網擴張、線粒體腫脹、胞質內空泡形成等,致使ICCs細胞體積增大,長度增長,造成其生理功能異常改變。15mol/L組胞體明顯縮短,并隨培養時間延長胞體進一步變小,可能是過高濃度的糖對ICCs直接造成破壞,隨培養時間延長過高濃度的糖環境持續破壞,線粒體發生腫脹、空泡樣變甚至溶解,內質網擴張,粗面內質網發生脫顆粒,胞質廣泛溶解等,導致ICCs細胞進一步縮小縮短致使其結構、功能異常。
本研究結果提示,高糖環境與DCP中ICCs功能改變有重要關系。高濃度長時間的影響,致使ICCs內部結構破壞,進而造成形態改變,導致其作為起搏功能及控制肌細胞運動的結構、功能異常,導致膀胱逼尿肌收縮能力異常,臨床出現DCP癥狀。ICCs形態結構的變化可能是DCP發生的重要病理基礎之一。
[1]Jiang HH,SongB,Lu GS,et al.Loss of ryanodine receptor calcium release channel expression associated with overactive urinary bladder smooth muscle contractions in adetrusor instability model[J].BJU Int,2005,96(3):428~433.
[2]McCloskey KD.Characterization of outward currents in interstitial cells from the guinea pig bladder[J].J Urol,2005,173(1):296~301.
[3]Andersson KE,Arner A.Urinary bladder contraction and relaxation:physiology and pathophysiology[J].Physiol Rev,2004,84:935~986.
[4]Asano T, Saito Y,KawakamI M,et al.Clinical Pharmacology Study Group. Erythrocytic sorbitol contents in diabetic patients correlate with blood aldose reductase protein contents and plasma glucose level, and are normalized by the potent aldose reductase inhibitor fidarestat(SNK-860)[J].Diabetes Comp lications,2004,18(6):336~342.

