絲膠對(duì)碳酸鈣晶體生長(zhǎng)的調(diào)控作用研究
丁 少,王海龍,須蘇菊,孔祥東
(浙江理工大學(xué) a. 材料與紡織學(xué)院;b. 生命科學(xué)學(xué)院,杭州 310018)
絲膠對(duì)碳酸鈣晶體生長(zhǎng)的調(diào)控作用研究
丁 少a,王海龍b,須蘇菊b,孔祥東b
(浙江理工大學(xué) a. 材料與紡織學(xué)院;b. 生命科學(xué)學(xué)院,杭州 310018)
以水溶性絲膠為有機(jī)模板調(diào)控碳酸鈣晶體生長(zhǎng),探討了絲膠質(zhì)量濃度差異對(duì)晶體生長(zhǎng)的影響作用。采用場(chǎng)發(fā)射掃描電鏡(FESEM)、X射線衍射(XRD)、紅外光譜(FTIR)對(duì)所制備的樣品進(jìn)行表征。結(jié)果表明:通過(guò)控制絲膠質(zhì)量濃度可調(diào)控碳酸鈣的晶體生長(zhǎng),引起晶體形貌與尺寸的顯著變化,并抑制碳酸鈣特定晶面的生長(zhǎng)。制備了刺球狀碳酸鈣和片層結(jié)構(gòu)組裝而成的類正方體碳酸鈣,并對(duì)其形成機(jī)理進(jìn)行了初步探討,結(jié)果表明絲膠與無(wú)機(jī)晶體之間存在復(fù)雜的相互作用,絲膠對(duì)碳酸鈣晶體的生長(zhǎng)具有調(diào)制作用。
碳酸鈣;絲膠;生物礦化;調(diào)控
碳酸鈣是一種重要的無(wú)機(jī)非金屬材料,主要存在于天然礦藏及貝殼、珊瑚、珍珠等生物礦物中,在橡膠、塑料、造紙、涂料、食品等領(lǐng)域具有重要應(yīng)用。近年來(lái),由于碳酸鈣具有優(yōu)異的生物學(xué)特性,在藥物緩釋載體、生物傳感器、骨修復(fù)材料等新興領(lǐng)域逐漸得到利用。碳酸鈣納米材料及特殊結(jié)構(gòu)、形貌具有特殊應(yīng)用。碳酸鈣含有3種無(wú)水晶型,分別是球霰石、文石和方解石,其穩(wěn)定性依次遞增[1]。球霰石、文石、方解石分別屬于六方晶系、正交晶系、三方晶系,分別具有六角形結(jié)構(gòu)、正交結(jié)構(gòu)、菱形結(jié)構(gòu),通常分別組裝成球形顆粒、針狀顆粒、立方體顆粒[2]。目前,多種有機(jī)物質(zhì)被用做調(diào)控碳酸鈣等生物礦物合成的有機(jī)模板。這些有機(jī)物質(zhì)按照相對(duì)分子質(zhì)量和來(lái)源主要分為三類:人工合成高聚物,如聚氨基酸類[3]、PAA[4]等;低分子有機(jī)物,如 EDTA[5]、醇類[6]、氨基酸[7]等;生物大分子,如殼聚糖[8]、磷脂[9]、蛋白質(zhì)[10-14]等。在自然界中,蛋白質(zhì)是一種重要的生物礦化模板分子,因此人們對(duì)蛋白質(zhì)調(diào)控碳酸鈣合成進(jìn)行了廣泛的研究。
絲膠是一種可溶性蛋白,處于蠶絲的外層,對(duì)絲素起到保護(hù)作用[12]。絲膠由于具有很好的保水性、生物相容性和降解性等,因此在工業(yè)上被廣泛應(yīng)用于化妝品、生物材料領(lǐng)域[15-18]。
本研究利用絲膠作為有機(jī)模板來(lái)合成碳酸鈣復(fù)合材料,分析絲膠質(zhì)量濃度對(duì)碳酸鈣晶型和形貌的影響,并探討絲膠對(duì)碳酸鈣晶體生長(zhǎng)的影響作用。
1 材料和方法
1.1 試劑及儀器
試劑:無(wú)水氯化鈣、碳酸鈉、氫氧化鈉、無(wú)水乙醇等(分析純,杭州米克化學(xué)試劑有限公司),絲膠粉(相對(duì)分子質(zhì)量為10~20 kDa,湖州奧特絲生物化工有限公司)。
儀器:恒溫加熱磁力攪拌器(上海梅穎浦儀器儀表制造有限公司),循環(huán)水式多用真空泵(河南省太康科教器材廠),恒流泵(上海嘉鵬科技有限公司),電熱恒溫鼓風(fēng)干燥箱(上海一恒科技有限公司)。
1.2 碳酸鈣合成
在20 ℃時(shí),將10 mL的0.2 mol/L氯化鈣溶液加入80 mL絲膠溶液(絲膠溶液質(zhì)量濃度分別為0 g/L,0.5、1、1.5 g/L)中,然后輕微攪拌30 min,得到絲膠與氯化鈣的混合溶液;氫氧化鈉調(diào)節(jié)pH值至8后,用恒流泵將10 mL的0.2 mol/L碳酸鈉溶液滴入上述混合溶液中,當(dāng)碳酸鈉全部滴加完成時(shí),即反應(yīng)時(shí)間為5 min,經(jīng)過(guò)抽濾得到固體產(chǎn)物,用去離子水充分洗滌后,將固體產(chǎn)物在37 ℃下用烘箱干燥24 h。
1.3 碳酸鈣表征
1.3.1 X射線衍射(XRD)測(cè)定
研究樣品的晶型,使用X 射線粉末衍射儀(ARL XTRA, Thermo Electron)對(duì)粉末樣品進(jìn)行分析,采用Cu Kα射線(λ=1.540 56 ?),角度范圍為2θ=20°~70°,掃描速度為4(°)/min。
1.3.2 紅外吸收光譜(FTIR)分析
樣品與溴化鉀混合的質(zhì)量比約為1∶100,用傅立葉變換紅外光譜儀(Nicolet 5700, Thermo Electron)對(duì)樣品的化學(xué)基團(tuán)進(jìn)行分析,分辨率為4 cm-1,掃描范圍為4 000 cm-1~400 cm-1。
1.3.3 掃描電子顯微鏡(SEM)觀察
觀察樣品的形態(tài)和微觀結(jié)構(gòu),ULTRATM55場(chǎng)發(fā)射掃描電子顯微鏡(FESEM)的加速電壓為2 kV。
2 結(jié)果與討論
2.1 不同質(zhì)量濃度絲膠溶液中合成的碳酸鈣晶體的掃描電鏡圖
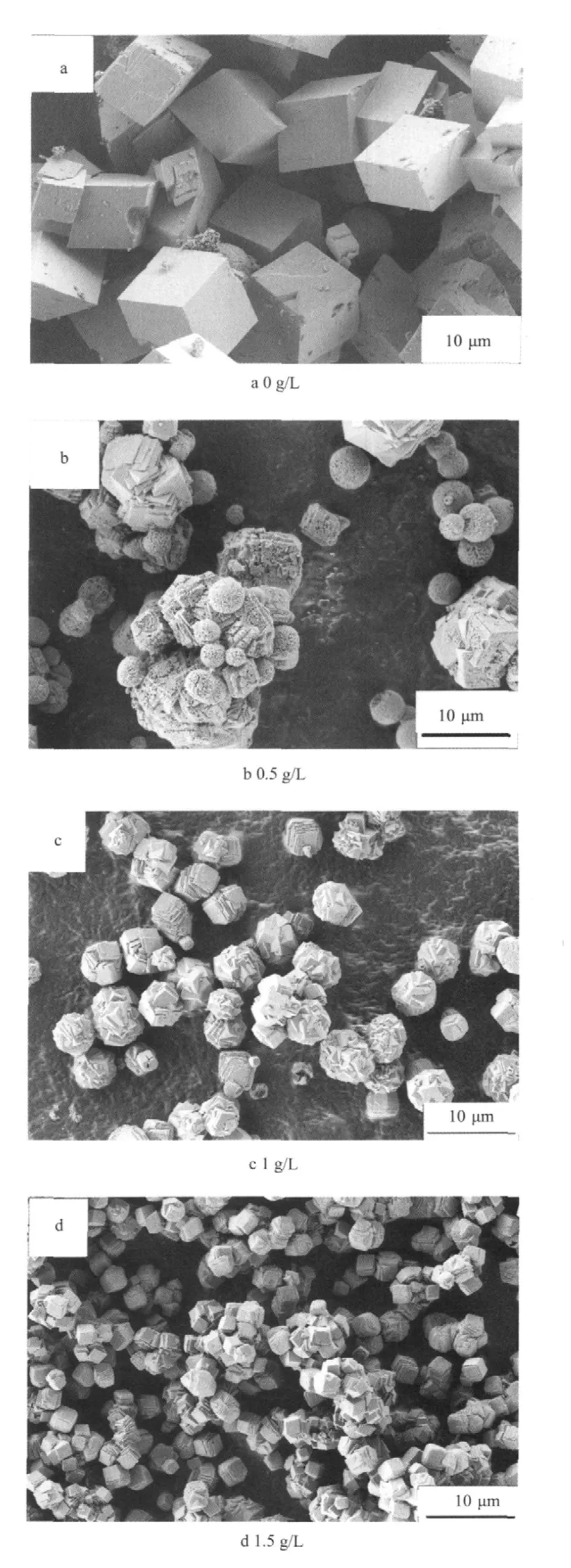
圖1 不同質(zhì)量濃度絲膠溶液中合成的碳酸鈣FESEM圖Fig.1 SEM images of the Calcium carbonate obtained at different sericin concentration
圖1為在20 ℃、不同質(zhì)量濃度絲膠溶液中制備得到中碳酸鈣FESEM圖。從圖1可見(jiàn),不同質(zhì)量濃度絲膠溶液中制備的碳酸鈣晶體形貌有明顯的區(qū)別。從圖1a可以看出,在純水中得到碳酸鈣晶體是規(guī)則的斜方六面體,晶體尺寸為8~10 μm;當(dāng)絲膠質(zhì)量濃度為0.5 g/L時(shí),碳酸鈣晶體呈現(xiàn)多種形貌,有球狀、類正方體及無(wú)規(guī)則的碳酸鈣;當(dāng)絲膠質(zhì)量濃度增加到1 g/L時(shí),制備的碳酸鈣晶體主要是由小的菱形晶體相互嵌合形成的刺球狀顆粒(直徑5~10 μm)、片層結(jié)構(gòu)組裝成的類正方體碳酸鈣,尺寸約為5 μm;當(dāng)絲膠質(zhì)量濃度進(jìn)一步增加到1.5 g/L時(shí),碳酸鈣晶體具有片層狀結(jié)構(gòu)組裝成的類正方體,尺寸3~4 μm,且尺寸比較均一。
絲膠主要的氨基酸組成為絲氨酸(33.43 %)、天門冬氨酸(16.71 %)、甘氨酸(13.49 %),其分子側(cè)鏈上含有大量羥基、羧基和氨基等極性基團(tuán)[19],因此絲膠分子能夠與碳酸鈣之間形成復(fù)雜的相互作用,如氫鍵、螯合作用、靜電作用等。隨著絲膠蛋白質(zhì)量濃度的增加,絲膠蛋白與碳酸鈣之間相互作用方式存在較大差異,使得碳酸鈣在絲膠分子特定區(qū)域里成核和生長(zhǎng)時(shí)會(huì)受到強(qiáng)烈的影響。當(dāng)絲膠質(zhì)量濃度逐漸增大時(shí),絲膠分子之間的相互作用增大,靜電引力增大,氫鍵作用力大大降低了正電性基團(tuán)的排斥,鈣離子在溶液中的過(guò)飽和度增加,成核活化能降低,有利于碳酸鈣晶體的成核結(jié)晶,因此,碳酸鈣生長(zhǎng)結(jié)晶趨向于更為有序的結(jié)構(gòu)。此外,絲膠能夠吸附在碳酸鈣晶體的特定晶面上,而晶面上絲膠質(zhì)量濃度高導(dǎo)致此晶面上的生長(zhǎng)速率低,從而造成各個(gè)晶面生長(zhǎng)速率不同,因此絲膠質(zhì)量濃度增加,晶面上絲膠密度也在增加,晶體形貌與尺寸也隨之發(fā)生變化[20]。
2.2 不同質(zhì)量濃度絲膠溶液中合成的碳酸鈣晶體的XRD圖譜
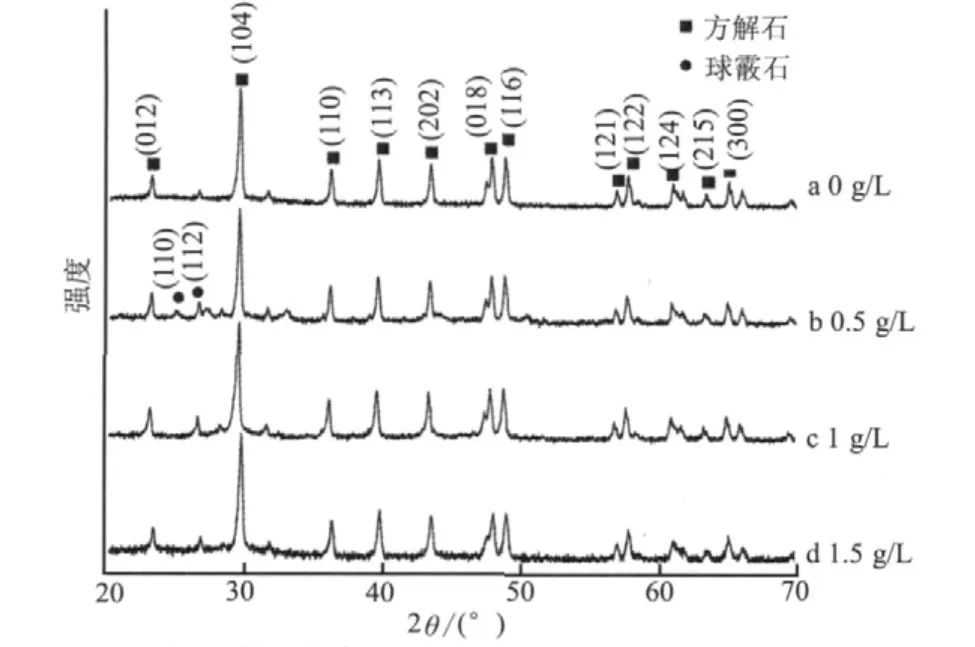
圖2 不同質(zhì)量濃度絲膠溶液中合成的碳酸鈣XRD譜圖Fig. 2 XRD spectra of the Calcium carbonate obtained at different sericin concentration
圖2為不同絲膠質(zhì)量濃度下得到的碳酸鈣晶體的XRD圖譜。從圖2a可以看出,當(dāng)溶液中不含絲膠時(shí),生成的碳酸鈣出現(xiàn)了(104)、(202)、(018)、(116)、(113)等特征衍射峰,與方解石的標(biāo)準(zhǔn)圖譜(JCPDS 47-1743)完全一致;同時(shí)樣品中還出現(xiàn)了球霰石(112)面衍射峰,表明所制備的碳酸鈣主要為結(jié)晶良好的方解石晶體,并伴有極少量的球霰石晶體。當(dāng)絲膠質(zhì)量濃度為0.5 g/L時(shí)(圖2b),得到的碳酸鈣晶體主要是方解石,同時(shí)還出現(xiàn)了球霰石(JCPDS 33-0268)(110)、(112)面衍射峰,說(shuō)明制備的碳酸鈣中還含有少量球霰石;結(jié)合(圖1b)SEM結(jié)果,樣品中球霰石的數(shù)量顯著高于未經(jīng)絲膠蛋白調(diào)控的碳酸鈣樣品。圖 2 c、d 中,隨著絲膠質(zhì)量濃度逐漸增加,所制備的碳酸鈣的晶型與絲膠質(zhì)量濃度為0.5 g/L時(shí)基本相同,均為球霰石和方解石混合晶型,但是球霰石的(110)面消失了,說(shuō)明絲膠質(zhì)量濃度增加后可抑制球霰石(110)面的生長(zhǎng)。結(jié)合FESEM結(jié)果可知,絲膠對(duì)碳酸鈣晶體的晶型僅有一定的影響作用,它對(duì)碳酸鈣晶體生長(zhǎng)的影響作用主要表現(xiàn)為對(duì)晶體生物礦化方式的控制,引起晶體尺寸和形貌的變化。
2.3 不同質(zhì)量濃度絲膠溶液中合成的碳酸鈣晶體的FTIR圖譜
圖3為在不同絲膠質(zhì)量濃度下生成的碳酸鈣晶體的紅外光圖譜。從圖3a可知,所得的碳酸鈣在712、875和1 420 cm-1處有強(qiáng)的吸收峰,它們分別是方解石晶體中CO32-基團(tuán)的O―C―O面內(nèi)彎曲振動(dòng)峰,O―C―O面外彎曲振動(dòng)峰和C―O反對(duì)稱伸縮振動(dòng)峰[21],在1 082 cm-1處出現(xiàn)了微弱的紅外吸收峰,這是CO32-基團(tuán)中C―O對(duì)稱伸縮振動(dòng)峰,說(shuō)明碳酸鈣晶體是有方解石和球霰石組成的混合晶體,而圖3b、c、d中除了出現(xiàn)以上4個(gè)峰外,在1 654 cm-1處也出現(xiàn)了微弱的吸收峰,1 654 cm-1處是絲膠蛋白紅外吸收光譜中酰胺Ⅰ鍵的酰胺基的CO伸縮振動(dòng)特征峰[22],說(shuō)明絲膠與碳酸鈣之間存在一定的化學(xué)相互作用,這與XRD結(jié)果是一致的。

圖3 在不同絲膠質(zhì)量濃度下生成的碳酸鈣晶體的FTIR譜圖Fig.3 FTIR spectra of the Calcium carbonate obtained at different sericin protein concentration
3 結(jié) 語(yǔ)
本研究通過(guò)簡(jiǎn)單的共沉淀方法,在溫和條件下以絲膠為模板調(diào)控合成了刺球狀碳酸鈣和片層結(jié)構(gòu)的類正方體碳酸鈣。結(jié)果表明,隨著絲膠質(zhì)量濃度的增加,絲膠可對(duì)生成的碳酸鈣形貌和尺寸產(chǎn)生顯著影響,并抑制碳酸鈣特定晶面的生長(zhǎng)。絲膠與無(wú)機(jī)晶體之間存在復(fù)雜的相互作用,絲膠對(duì)碳酸鈣晶體的生長(zhǎng)具有調(diào)制作用,本研究為仿生合成新型材料提供了一定的參考。
[1] KONTOYANNIS C G, VAGENAS N V. Calcium carbonate phase analysis using XRD and FT-Raman spectroscopy [J].The Analyst, 2000, 125(2): 251-255.
[2] FLATEN E M, SEIERSTEN M, ANDREASSEN J P.Induction time studies of calcium carbonate in ethylene glycol and water [J]. Chemical Engineering Research and Design, 2010, 88(12): 1659-1668.
[3] AJIKUMAR P K, LOW B J M, VALIYAVEETTIL S. Role of soluble polymers on the preparation of functional thin fi lms of calcium carbonate [J]. Surface and Coatings Technology,2005, 198: 227-230.
[4] CHENG B. Preparation of monodispersed cubic calcium carbonate particles via precipitation reaction [J]. Materials Letters, 2004, 58(10): 1565-1570.
[5] FENG B, YONG A K, AN H. Effect of various factors on the particle size of calcium carbonate formed in a precipitation process [J]. Materials Science and Engineering:A, 2007, 445-446: 170-179.
[6] FLATEN E M, SEIERSTEN M, ANDREASSEN J P. Polymorphism and morphology of calcium carbonate precipitated in mixed solvents of ethylene glycol and water[J]. Journal of Crystal Growth, 2009, 311(13): 3533-3538.
[7] TONG H, MA W T, Wang L L, et al. Control over the crystal phase, shape, size and aggregation of calcium carbonate via a l-aspartic acid inducing process [J]. Biomaterials, 2004,25(17): 3923-3929.
[8] LIANG P. The effect of carboxymethyl chitosan on the precipitation of calcium carbonate [J]. Journal of Crystal Growth, 2004, 261(4): 571-576.
[9] XIAO J W, WANG Z N, TANG Y C, et al. Biomimetic mineralization of CaCO3on a phospholipid monolayer:From an amorphous calcium carbonate precursor to calcite via vaterite [J]. Langmuir, 2010, 26(7): 4977-4983.
[10] YANG H Y, YAO W G, YANG L, et al. The self-assembly of CaCO3crystals in the presence of protein [J]. Journal of Crystal Growth, 2009, 311(9): 2682-2688.
[11] CHENG C, SHAO Z Z, VOLLRATH F. Silk fibroinregulated crystallization of calcium carbonate [J]. Advanced Functional Materials, 2008, 18: 2172-2179.
[12] 沈彤. 絲素蛋白調(diào)控磷酸鈣生物礦化的研究進(jìn)展[J]. 絲綢,2010,47(7):23-26.SHEN Tong. Development of current researches on biomineralization of calcium phosphate regulated by silk fi broin[J]. Journal of Silk, 2010, 47(7): 23-26.
[13] 薛輝,蔡玉榮,姚菊明. 微乳液法制備多孔中空羥基磷灰石微球的研究[J]. 浙江理工大學(xué)學(xué)報(bào),2011,28(3):338-342.XUE Hui, CAI Yurong, YAO Juming. Study on porous hydroxyapatite microsphere with an internal cavity by emulsion method[J]. Journal of Zhejiang Sci-Tech University, 2011, 28(3): 338-342.
[14] CAO Z B, CHEN X, YAO J R, et al. The preparation of regenerated silk fi broin microspheres [J]. Soft Matter, 2007,3(7): 910-915.
[15] CAPAR G, AYGUN S, GECIT M. Treatment of silk production wastewaters by membrane processes for sericin recovery [J]. Journal of Membrane Science, 2008, 325(2):920-931.
[16] CHO K. Preparation of self-assembled silk sericin nanoparticles [J]. International Journal of Biological Macromolecules, 2003, 32(1-2): 36-42.
[17] ZHANG Y Q, MA Y, XIA Y Y, et al. Silk sericin-insulin bioconjugates: Synthesis, characterization and biological activity [J]. Journal of Controlled Release, 2006, 115(3):307-15.
[18] MANDAL B B, PRIYA A S, KUNDU S C. Novel silk sericin/gelatin 3-D scaffolds and 2-D fi lms: Fabrication and characterization for potential tissue engineering applications[J]. Acta Biomaterialia, 2009, 5(8): 3007-3020.
[19] DASH B C, MANDAL B B, KUNDU S C. Silk gland sericin protein membranes: Fabrication and characterization for potential biotechnological applications [J]. Journal of Biotechnology, 2009, 144: 321-329.
[20] SHEN F H, FENG Q L, WANG C M. The modulation of collagen on crystal morphology of calcium carbonate [J].Journal of Crystal Growth, 2002, 242(1-2): 239-244.
[21] ANDERSEN F. Infrared spectra of amorphous and crystalline calcium carbonate [J]. Acta Chemica Scandinavica, 1991, 45: 1018-1024.
[22] CAI Y R, JIN J, MEI D P, et al. Effect of silk sericin on assembly of hydroxyapatite nanocrystals into enamel prismlike structure [J]. Journal of Materials Chemistry, 2009,19(32): 5751-5751.
Study on the regulation and control of silk sericin on the crystal formation of Calcium Carbonate
DING Shaoa, WANG Hai-longb, XU Su-jub, KONG Xiang-dongb
(a.College of Materials and Textile; b.College of Life Sciences, Zhejiang Sci-Tech University, Hangzhou 310018, China)
This study uses silk sericin as organic template to regulate the crystal formation of calcium carbonate in the presence of protein, discusses the mass concentration of silk sericin on the crystal growth. The obtained samples are characterized by fi eld emission scanning electron microscopy (FESEM), X-ray diffraction (XRD), infrared spectroscopy(FTIR). The result shows that controlling the the mass concentration of silk sericin can regulate the crystal growth of calcium carbonate, significantly change the appearance and size of crystal and restrain the specific crystal growth of calcium carbonate. Cube-like calcium carbonate formed by thorn spherical calcium carbonate aggregates and lamellar structure was prepared, the formation mechanism of which is discussed preliminarily. The result shows that interaction between silk sericin and mineral crystal was very complex and silk sericin had a signi fi cant effect on the formation of calcium carbonate crystal.
Calcium carbonate; Silk sericin; Biomineralization; Crystal formation; Regulate and control
TS149
A
1001-7003(2012)06-0008-04
2011-09-07;
2012-05-20
國(guó)家自然科學(xué)基金資助項(xiàng)目(50942023、510021 39);浙江省教育廳科研計(jì)劃重點(diǎn)項(xiàng)目(20070340)
丁少(1986- ),碩士研究生,研究方向?yàn)樯锏V化與生物材料。通訊作者:孔祥東,副研究員,kongxiang dong@gmail.com。

