天然和熱處理大豆蛋白穩定乳液的性質研究
王金梅 夏 寧,2 楊 娟 楊曉泉
(華南理工大學輕工與食品學院食物蛋白中心1,廣州 510640)
(廣西大學輕工與食品工程學院2,南寧 530004)
天然和熱處理大豆蛋白穩定乳液的性質研究
王金梅1夏 寧1,2楊 娟1楊曉泉1
(華南理工大學輕工與食品學院食物蛋白中心1,廣州 510640)
(廣西大學輕工與食品工程學院2,南寧 530004)
熱處理(90、120℃)修飾的大豆分離蛋白用于制備水包油(O/W)乳液,并對天然和熱處理蛋白乳液的粒徑、微結構、絮凝率和分層穩定性進行表征。熱處理蛋白的水力學半徑隨蛋白濃度和加熱溫度的增加而增加,證實了可溶性聚集體的產生。乳液粒徑和分層穩定性受離子強度、聚集體粒徑影響。低離子強度下(0 mmol/L),與天然蛋白相比,熱處理蛋白乳液粒徑較大,20 d放置后未發生分層。離子強度的增加(100 mmol/L)導致天然蛋白乳液粒徑明顯增大;而熱處理蛋白乳液則表現出較高耐鹽性,體現在更小的粒徑、絮凝率和分層指數。與90℃熱處理相比,120℃熱處理減小了乳液液滴的粒徑和絮凝。
大豆蛋白 熱處理 蛋白聚集 乳化活性 乳液穩定性
蛋白質具有兩親性質,常被作為乳化劑廣泛應用于乳液體系中。通常認為,蛋白通過在油水界面上的吸附降低界面自由能,在液滴表面形成具有一定強度的凝膠化界面層來維持乳液的穩定[1]。但在加工過程和貨架期內會發生液滴間的相互作用,隨之出現液滴的絮凝和聚結,進而引起脂肪上浮、蛋白沉淀、質感粗糙等失穩現象,嚴重影響了乳液的質構特性及口感[2]。蛋白結構性質(分子尺寸、分子柔性、表面疏水性等)與環境因素(離子強度、pH等)強烈影響蛋白的乳化性質,且液滴尺度、連續相黏度和絮凝物的尺度和結構等因素影響乳液穩定性(特別是分層穩定性)[3]。
熱處理是食品加工中不可缺少的處理操作,如熱殺菌,已廣泛用于修飾蛋白的結構、理化和功能性質。高于蛋白變性溫度的熱處理誘導了球蛋白的部分展開,伴隨著大分子質量聚集體的形成。聚集程度受蛋白濃度,處理溫度等因素影響。熱誘導的結構破壞使分子內部的疏水基團暴露于分子表面,增強了蛋白的界面活性[4]。依據蛋白結構展開和聚集體尺寸不同,熱處理不同程度的影響了蛋白的起泡性和泡沫穩定性[5]。目前,熱變性蛋白穩定乳液的研究相對較少[5]。研究證實,熱處理可以改善乳清蛋白的乳化活性和乳液穩定性[6]。
大豆蛋白因具有良好的營養價值和功能性質已廣泛用于食品體系中。如何修飾大豆蛋白結構來改善其功能性質備受研究者關注。目前,用來修飾大豆蛋白結構的熱處理基本低于100℃。95℃熱處理可以有效的提高大豆蛋白的乳化能力及乳液凍融穩定性[7-8],但研究未考察蛋白聚集對乳化能力的影響。最近,噴射蒸煮熱處理(120℃)被證實可以明顯改善醇/熱變性大豆蛋白的溶解性,并明顯提高蛋白的乳化活性[9-10]。基于此,本試驗對不同濃度的大豆分離蛋白溶液進行熱處理(90、120℃),形成具有不同聚集程度的變性蛋白,并對不同離子強度下(0、100 mmol/L),天然和熱處理蛋白乳液的粒徑、微結構、絮凝率和分層穩定性進行表征和分析,以期為功能性大豆蛋白的加工生產提供理論依據。
1 材料與方法
1.1 材料與設備
低溫脫脂豆粕:山東禹王公司;尼羅紅和尼羅藍:Sigma公司;牛血清白蛋白:北京鼎國試劑公司;金龍魚玉米油:市售;其他試劑均為分析純。
手提式高溫滅菌鍋:上海三申醫療器械有限公司;CR22G型冷凍離心機:日本HITACHI公司;Dumas定氮儀:法國Elementar公司;T25高速剪切機:德國IKA公司;M-110EH-30高壓微射流納米均質機:美國MFIC公司;Nanosizer粒度分布儀、Mastersize2000粒度分布儀:英國Malvern公司;激光共聚焦顯微鏡:德國Leica公司。
1.2 試驗方法
1.2.1 大豆分離蛋白的制備及熱處理
采用堿溶酸沉方法制備大豆分離蛋白(SPI),以料液比1∶10向低溫脫脂豆粕加入純水,調至pH 8.0,室溫攪拌2 h后10 000×g離心20 min。將上清液調至pH 4.5進行酸沉,經過離心 (10 000×g,10 min)后的蛋白沉淀重新溶于純水中,調至pH中性后進行透析、凍干。由Dumas方法測得SPI的蛋白質量分數為(85.79 ±0.70)%(N × 5.71)。
稱取一定量SPI溶于濃度5 mmol/L磷酸緩沖液(pH 7.0)至設定的蛋白質量濃度(1~6 mg/mL),室溫攪拌2 h后密封于帶蓋瓶中進行熱處理(90、120℃,20 min),其中,90℃熱處理采用水浴方式,120℃熱處理采用高溫蒸汽滅菌方式進行。熱處理后,樣品迅速冷卻備用。
1.2.2 蛋白的水力學半徑
采用動態光散射技術(DLS)測定天然和熱處理SPI的平均水力學半徑。使用5 mmol/L磷酸緩沖液將樣品溶液稀釋至1 mg/mL,經0.22 μm濾膜過濾后置于樣品池。背散射技術(光散射角度為173°)用于降低灰塵的影響。通過檢測光散射強度隨時間變化計算自相關函數,根據斯托克斯-愛因斯坦方程計算出平均水力學半徑(Rh)。
1.2.3 乳液的制備
將一定量天然和熱處理SPI與玉米油混合,調節混合物的離子強度至設定值(0、100 mmol/L),并加入0.02%疊氮鈉抑制微生物生長。常溫下,混合物經預乳化(5 000 r/min,2 min)后進行微射流處理二次(50 MPa),制備成蛋白質量分數為0.5%,油含量為10%的乳液。
1.2.4 乳液粒度的測定
采用Mastersizer 2000粒度分布儀測定乳狀液滴的粒徑大小。參數設置為:顆粒折射率:1.520;顆粒吸收率:0.001;分散劑:水;分散劑折射率:1.330。試驗采用d43,即體積平均直徑表征液滴粒度的大小。乳液的絮凝率(FD)=(d43-d43SDS)/d43SDS×100%[10],其中 d43SDS為加入 SDS 所測得的 d43。
1.2.5 乳液的微結構觀察
采用激光共聚焦方法觀察乳液的微結構。1 mL樣品中加入混合染料40 μL(0.02%尼羅紅和0.1%尼羅藍混合液),充分混合均勻。樣品固定于激光共聚焦顯微鏡載物臺上,物鏡(×100)觀察之后初調聚焦平面。選擇488 nm的Ar離子和633 nm的He/Ne離子激光預掃描,采集熒光圖像,掃描密度為1 024×1 024。使用LAS AF Lite軟件進行圖像處理。
1.2.6 乳液的分層穩定性
取10 mL新鮮乳液至乳析管中,置于室溫,定期測量乳狀液分層后樣品底部清液層的高度。乳液的分層指數=清液層高度(HS)/樣品的總高度(HT)×100%。
2 結果與討論
2.1 熱誘導大豆蛋白聚集體的形成
差示熱量掃描量熱儀(DSC)測定蛋白變性程度的結果顯示,90、120℃熱處理均使SPI發生完全變性(數據未列出)。高于變性溫度的熱處理誘導大豆蛋白去折疊和聚集的發生已被廣泛認識。首先,應該指出,低離子強度下的熱處理未對蛋白溶解度產生明顯影響,即未生成不溶性聚集體(數據未列出),這可能與β-伴大豆球蛋白抑制大豆球蛋白不溶性熱聚集體的形成有關[11]。天然和熱處理蛋白的水力學半徑(Rh)用來評價可溶性聚集體的尺度,見圖1。熱處理蛋白的Rh高于天然蛋白,且隨蛋白質量濃度增加而增加,說明蛋白聚集現象的發生。120℃熱處理導致蛋白粒徑進一步增加,表明較高溫度處理利于大尺度聚集體的形成。
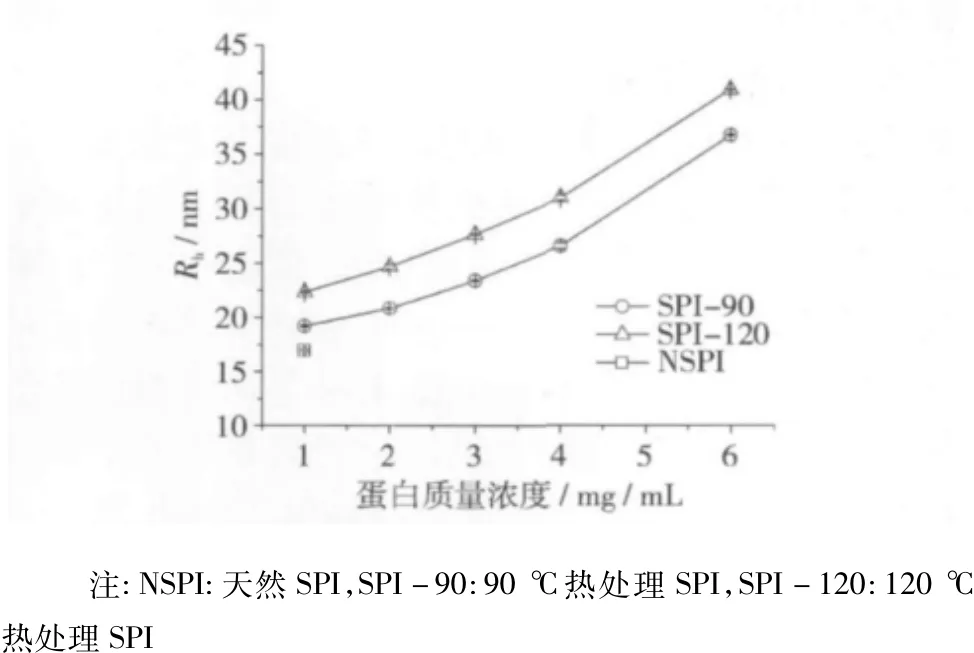
圖1 天然和熱處理大豆蛋白的水力學半徑(Rh)
2.2 乳液液滴粒度及微結構
基于蛋白結構決定其功能性質的認識,熱處理修飾的大豆蛋白可能具有不同的乳化能力。蛋白乳液的液滴粒徑和微結構用于評價蛋白聚集對乳液性質的影響。圖2為天然和熱處理蛋白乳液的體積平均直徑d43。在0 mmol/L下,天然蛋白表現了最低的d43,蛋白的熱處理增加了乳液的粒徑。90℃熱處理蛋白乳液的d43隨著蛋白濃度的增加而逐漸增加,而120℃處理蛋白乳液的d43不依據蛋白粒徑的增大而變化,且始終低于90℃熱處理蛋白(圖2a),說明120℃熱處理蛋白擁有較高的乳化性。這可能與蛋白在油水界面上的較易吸附有關。

圖2 不同離子強度下天然和熱處理蛋白乳液的液滴粒徑大小(d43)
理論上理解,蛋白的熱處理導致大量疏水基團的暴露,使蛋白分子與水的不相容性增強,進而增強了蛋白的乳化能力。這與乳液粒徑結果不一致,熱處理蛋白中可溶性聚集體的出現可能與之相關。高壓均質乳化時,乳化劑減小界面張力和抑制油滴的重新聚結的能力決定了液滴的粒徑大小[12-13]。有報道稱[14],由于大粒徑分子具有較高的對流傳質速度,高壓均質時產生的巨大湍流可以促進蛋白聚集體在界面上優先吸附。之后,由于聚集體的空間位阻作用,導致蛋白分子不能很好的覆蓋油滴,阻止油滴的重新聚結,最終表現為較大的液滴粒徑[12-13]。研究報道,蛋黃的熱處理也導致了乳液粒徑的增加。乳液液滴粒徑的溫度依賴性(90、120℃)可能與不同蛋白結構變化和分子重排有關[12-13]。
蛋白乳液的粒徑受離子強度強烈影響。一般認為,離子強度的增加通過改變蛋白分子表面的電荷來改變蛋白在油水界面的吸附,進而影響乳化效果。同時,鹽離子對乳液液滴表面電荷的屏蔽可能加速液滴之間的絮凝。NaCl的加入(100 mmol/L)使天然和熱處理蛋白乳液的粒徑明顯增大,其中天然蛋白乳液呈現了最大的d43值,而熱處理蛋白乳液擁有較低的液滴粒徑,特別是120℃熱處理修飾的蛋白,這個蛋白乳液粒徑受聚集程度影響較小(圖2b)。這些結果說明了蛋白的熱處理明顯提高了乳液的離子強度耐受性,特別對于較高溫度(120℃)熱處理而言。
CLSM技術用于直觀觀察乳液的微結構,見圖3。在0 mmol/L離子強度下,天然和熱處理蛋白都形成了穩定均一的乳液體系,體積分布集中于0.1~2 μm。與天然蛋白相比,熱處理蛋白乳液出現了較大粒徑的油滴。90℃熱處理蛋白乳液的油滴大小隨著蛋白聚集程度的提高而變大,大粒徑分布峰的出現同樣證實了乳液粒徑的增加。120℃熱處理蛋白乳液出現較小的液滴。上述結果與液滴粒徑變化一致(圖2a)。值得注意的是,100 mmol/L下,天然蛋白乳液的共聚焦圖片中出現了更大尺度的油滴,且油滴大小不均一,同時伴隨著一定程度絮凝的發生。對于熱處理蛋白乳液,大片的液滴絮凝出現在視野中,且液滴之間存在大范圍的黑色區域,表明液滴之間發生了強烈的橋聯絮凝,但仍可見較小尺度的油滴絮凝在一起并未發生強烈的聚結現象,即大尺度油滴的形成。

圖3 在不同離子強度下天然和熱處理蛋白乳液的CLSM圖片
由乳液微結構可知(圖3),100 mmol/L離子強度下,天然和熱處理蛋白乳液液滴間發生了強烈的絮凝。乳液的絮凝率用于定量評價不同樣品絮凝的差異,見圖4。熱處理蛋白乳液的絮凝率明顯小于天然蛋白,且隨加熱溫度增加而略微減小,隨蛋白濃度的增加變化不明顯。通常認為,蛋白乳液絮凝主要由液滴界面層上發生的吸引和排斥相互作用所控制。提高液滴的抗絮凝能力可以通過增強液滴間的靜電和空間排斥來實現[12]。目前已知,高于蛋白變性溫度的熱處理誘導了蛋白去折疊,隨之發生的蛋白表面疏水性的增加提高了蛋白的界面活性,增加了其在界面的吸附。有報道證實大豆乳液液滴間的蛋白聚集體在乳化時可以吸附到界面上,增加了界面蛋白吸附量[15],由此產生的空間排斥在一定程度上抑絮凝,使乳液對外界環境不敏感。
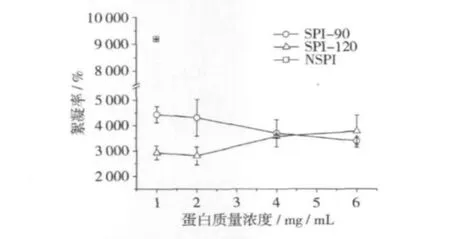
圖4 100 mmol/L離子強度下天然和熱處理蛋白乳液的絮凝率
2.3 乳液分層穩定性
乳液液滴間的絮凝、聚結會加速乳液的分層,樣品底部出現透明的水析層。在0 mmol/L下,乳液經室溫靜置20 d后,未出現明顯的分層現象,說明了良好的乳液穩定性。圖5為100 mmol/L下,天然和熱處理蛋白乳液的分層指數隨放置時間變化的情況。新鮮制備的天然蛋白乳液未發生明顯乳析,室溫放置12 h后慢慢出現脂肪上浮,且隨儲藏時間延長而逐漸增加,放置20 d后,分層指數高于60%;熱處理蛋白乳液在制備后30 min就出現明顯的乳析現象,室溫放置2 d之內迅速增加,最終分層指數明顯小于天然蛋白乳液。熱處理改善分層穩定性涉及的機理可能是,天然蛋白乳液形成的絮凝物是以開放的結構存在,水分子包裹其中,而熱處理蛋白乳液液滴可以自由的環繞彼此,進而更緊密的結合在一起,在油滴表面形成牢固緊密的結構,一定程度上抑制了乳液的分層。熱變性蛋黃的乳化性質研究結果支持了這一推斷[12-13]。另外,最初乳液分層速度隨蛋白聚集程度增加(蛋白濃度增加)而增加,且120℃熱處理表現了更小的分層速度(數據未列出),但放置后未發現分層指數的差別。本試驗未發現乳液絮凝率與分層速度之間的相關性。

圖5 100 mmol/L離子強度下天然和熱處理蛋白穩定乳液的分層指數變化
3 結論
大豆蛋白的熱處理誘導了可溶性聚集體的生成,且聚集體粒徑受蛋白質濃度、加熱溫度影響。在不同離子強度下,蛋白聚集程度影響了乳液的粒徑、微結構和分層穩定性。在0 mmol/L下,熱處理蛋白乳液的液滴粒徑較天然蛋白輕微增加,無明顯絮凝發生,長期放置無明顯分層。在100 mmol/L下,天然蛋白乳液出現大尺度的液滴,而蛋白的熱處理顯著減小了乳液的絮凝率,證實了其具有較強的鹽耐受性,特別對于120℃熱處理而言。熱處理蛋白乳液制備后快速分層,形成結構緊密的絮凝體,明顯改善了乳液的分層穩定性。這些理解將有利于拓展熱處理蛋白在真實乳液食品體系中的應用。
[1]Graham D E,Phillips M C.Proteins at liquid interfaces.III.Molecular structures of adsorbed films[J].Journal of Colloid Interface Science,1979,70:427 -439
[2]McClements D J.Food emulsions:principles,practice,and techniques[M].Boca Raton:CRC Press.2005
[3]Dickinson E.Flocculation of protein-stabilized oil-in-water emulsions [J].Colloids and Surfaces B:Biointerfaces,2010,81:130 -140
[4]Croguennec T,Renault A,Beaufils S,et al.Interfacial properties of heat- treated ovalbumin[J].Journal of Colloid Interface Science,2007,315:627 -636
[5]Nicolai T,Britten M,Schmitt C.β - Lactoglobulin and WPI aggregates:formation,structure and applications[J].Food Hydrocolloids,2011,25:1945 -1962
[6]Dybowska B E.Whey protein-stabilized emulsion properties in relation to thermal modification of the continuous phase[J].Journal of Food Engineering,2011,104:81 -88
[7]Palazolo G G,Sorgentini D A,Wagner J R.Emulsifying properties and surface behavior of native and denatured whey soy proteins in comparison with other proteins.Creaming stability of oil- in - water emulsions[J].Journal of the American Oil Chemists’Society,2004,81:625 -632
[8]Palazolo G G,Sobral P A,Wagner J R.Freeze-thaw stability of oil-in-water emulsions prepared with native and thermally - denatured soybean isolates[J].Food Hydrocolloids,2011,25:398 -409
[9]Wang H,Wang T,Johnson L A.Effect of alkali on the refunctionalization of soy protein by hydrothermal cooking[J].Journal of the American Oil Chemists’Society,2005,82:451 -456
[10]Zheng H G,Yang X Q,Tang C H,et al.Preparation of soluble soybean protein aggregates(SSPA)from insoluble soybean protein concentrates(SPC)and its functional properties[J].Food Research International,2008,41:154 - 164
[11]Damodaran S,Kinsella J E.Effect of conglycinin on the thermal aggregation of glycinin [J].Journal of Agricultural and Food Chemistry,1982,30:812 -817
[12]Guilmineau F,Kulozik U.Impact of a thermal treatment on the emulsifying properties of egg yolk.Part 1:Effect of the heating time [J].Food Hydrocolloids,2006,20:1105 -1113
[13]Guilmineau F,Kulozik U.Impact of a thermal treatment on the emulsifying properties of egg yolk.Part 2:Effect of the environmental conditions [J].Food Hydrocolloids,2006,20:1114-1123
[14]Walstra P.Formation of emulsions[M].//P Becher.Encyclopedia of emulsion technology:Basic theory.New York:Marcel Dekker Inc.,1983,57 -127
[15]Keerati-u-rai M,Corredig M.Heat-induced changes in oil-in-water emulsions stabilized by soy protein isolate[J].Food Hydrocolloids,2009,23:2141 -2148.
Characterization of Oil-in-Water Emulsion Stabilized by Native and Heat-Treated Soy Protein
Wang Jinmei1Xia Ning1,2Yang Juan1Yang Xiaoquan1
(College of Light Industry and Food Sciences,South China University of Technology1,Guangzhou 510640)
(Department of Light Industry and Food Engineering,Guangxi University2,Nanning 530004)
Heat treatments(90 and 120 ℃)were used to modify the emulsifying properties,and the droplet size,microstructure,and creaming stability of emulsion stabilized by native and heat- treated proteins were investigated and compared.Upon heat treatment,the hydraulic radius of protein gradually increased with increasing protein concentrations and heating temperature due to the formation of soluble aggregates.The droplet size and creaming stability of emulsion depended on ionic strength and degree of protein aggregation.At low ionic strength,heat- treated protein emulsion had higher droplet size as compared to native protein emulsion,without creaming after 20 day storage.The addition of salt(100 mmol/L)resulted in the increase in droplet size of emulsion,especially native protein emulsion.However,emulsion stabilized by heat- treated SPI exhibited a decreased salt sensitivity,as evidenced by lower droplet size,flocculation degree,and creaming index.Compared to heat treatment at 90 ℃,higher heating temperature(120℃)slightly decreased the droplet size and flocculation degree of emulsion.
soy protein,heat treatment,protein aggregation,emulsifying ability,emulsion stability
TS201.1
A
1003-0174(2012)09-0016-05
國家自然科學基金(21076087)
2011-12-22
王金梅,女,1982年出生,博士,植物蛋白加工與利用
楊曉泉,男,1965年出生,教授,博士生導師,植物蛋白加工與利用

