響應面法優化米渣發泡蛋白制備工藝的研究
吳雨靜 杜先鋒
(安徽農業大學茶與食品科技學院,合肥 230036)
響應面法優化米渣發泡蛋白制備工藝的研究
吳雨靜 杜先鋒
(安徽農業大學茶與食品科技學院,合肥 230036)
米渣經脫糖,酶解,脫色,噴霧干燥制得乳黃色,無異味,蛋白含量高,發泡性能良好的蛋白發泡粉。在單因素試驗的基礎上,選擇對發泡力影響較大的3個因素(加酶量,酶解時間,料液比)進行響應面試驗,通過SAS軟件分析,對中性蛋白酶酶解米渣的條件進行優化。并通過高效液相凝膠色譜和掃描電鏡從微觀層面解釋了發泡粉發泡性能增加的機理。結果表明,最佳酶解條件為:加酶量1.33%,酶解時間2.16 h,料液比1∶10。理論預測最大發泡力為277 mL,經驗證,酶解液最大發泡力為275 mL。
米渣 酶解 中性蛋白酶 發泡粉
米渣是淀粉糖生產過程中的副產品,即以大米為原料,經淀粉酶高溫液化處理并經板框壓濾除去糖類物質而得到的殘渣,其蛋白質質量分數約為40%~60%[1]。大米蛋白作為優質的谷物蛋白[2],非常適宜用來開發蛋白發泡粉。但由于高溫作用,米渣中的蛋白質通過二硫鍵連接成了高分子聚集體[3],相對分子質量增大,并含有較多的疏水性氨基酸,從而變性米渣蛋白的溶解性很差,因此相應的物化功能的應用也受到限制。目前大多是采用蛋白酶對米渣蛋白進行水解,使其釋放出更多的—COOH和—NH2,從而增大蛋白質分子的極性,促使蛋白質的溶解性得到增加,同時其溶液的膠體性質也得到增強,從而表現出一定的乳化和發泡性能[4]。
目前國內研究較多的是大豆蛋白的酶法水解[5-7],而關于酶法水解大米蛋白制取食用發泡粉的研究報道只有少數。阮暉等[8]用堿性蛋白酶對大米濃縮蛋白進行改性,獲得了發泡力為162%的發泡蛋白。胡中澤[9]采用胃蛋白酶對早秈米進行水解,獲得了發泡性能良好的發泡粉。
良好的發泡性不僅需要增加蛋白質的溶解性,而且也需要提高其疏水性,使親水和疏水達到良好的平衡[10]。不同的蛋白酶具有不同的酶切位點,其修飾后的蛋白質的結構變化也不相同,暴露的疏水基團的多少也不相同。由于蛋白質分子表面暴露的疏水性氨基酸越多,蛋白質的發泡性就越強[11],所以可以選擇作用位點為芳香族疏水性氨基酸羧基端的中性蛋白酶[12]對米渣蛋白進行水解,對含有疏水性氨基酸的肽鍵進行裂解,如 His-Leu,Ala-Phe,Gly-Phe,提高溶解性的同時也增加了疏水性氨基酸的暴露,改善發泡性能,從而可以制備蛋白發泡粉。夏建秋等[6]將中性蛋白酶用于大豆蛋白發泡粉的生產,工藝成熟,產品質量優良,也說明了利用中性蛋白酶酶解米渣制備蛋白發泡粉的可行性。同時中性蛋白酶作用條件溫和,價格低,安全性高。
在以上研究的基礎上,本試驗以淀粉糖生產的副產品米渣為原料,使用中性蛋白酶酶法改性米渣蛋白制備食用發泡粉,采用響應面分析法優化了制備米渣蛋白發泡粉的工藝條件,并通過高效液相凝膠色譜法和掃描電鏡手段從分子結構層面上探討了酶解米渣蛋白質發泡性能增加的機理。
1 材料與方法
1.1 材料
1.1.1 主要試驗材料
米渣:合肥錦泰糖業有限公司;中性蛋白酶(酶活270 000 U/g):蘇州維邦生物科技有限公司;糖化酶(酶活15 000 U/g):蘇州維邦生物科技有限公司;糖用活性炭:江蘇竹溪活性炭有限公司;細胞色素C(Mr12 500)、桿菌酶(Mr1 450)、乙氨酸-乙氨酸-乙氨酸-酪氨酸-精氨酸(Mr451)、乙氨酸-乙氨酸-乙氨酸(Mr189)(分子質量校正曲線所用標準品):上海恒遠生物科技有限公司。
1.1.2 試驗儀器與設備
DF-101T型集熱式恒溫磁力攪拌器:鞏義市予華儀器有限責任公司;TD5A-WS臺式低速離心機:湘儀離心機儀器有限公司;SKD-200凱氏定氮儀:上海沛歐分析儀器有限公司;JJ-2B型組織搗碎機:金壇市國旺實驗儀器廠;DZF-6050型真空干燥箱:上海三發科學儀器有限公司;OPD-8噴霧干燥機:上海大川原乾燥設備有限公司;LFT-3型精密過濾機:特威藥化設備有限公司;Waters600高效液相色譜儀(配2487紫外檢測器和含有GPC數據處理軟件的色譜工作站):美國沃特斯儀器公司;Sirion 200場發射掃描電子顯微鏡:美國FEI公司。
1.2 試驗方法
1.2.1 米渣蛋白發泡粉的制備工藝流程
米渣經脫糖,中性蛋白酶酶解,脫色,噴霧干燥等主要步驟制得蛋白發泡粉,工藝流程如圖1。
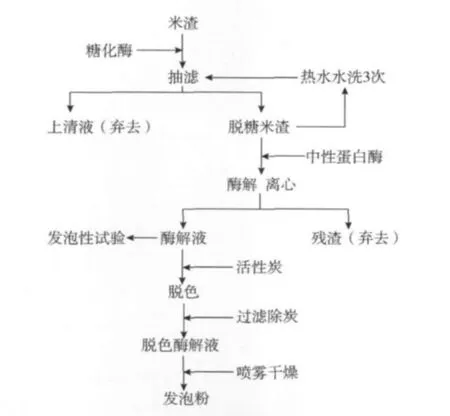
圖1 蛋白發泡粉的制備工藝流程
1.2.2 米渣脫糖方法
取米渣20 g,按30 U/g加入糖化酶,反應溫度50 ℃,pH 4.6,時間 3 h,固液比 1∶5。反應結束后抽濾,再將抽濾后的米渣用90℃熱水水洗30 min,再抽濾。熱水洗3次。將抽濾后的米渣于50℃真空干燥箱中干燥,備用。
1.2.3 中性蛋白酶酶解米渣方法
取米渣20 g于燒杯中,按照試驗設計的料液比加入定量的蒸餾水,保鮮膜封口,置于恒溫水浴鍋中保溫至設定的溫度。用0.5 mol/L的NaOH調pH至設定值。再加入一定量的中性蛋白酶,反應過程中持續攪拌,并維持恒定的pH。反應結束后,沸水浴10 min,滅酶。冷卻后離心15 min,棄去殘渣,得酶解液。
1.2.4 活性炭脫色方法
取1.2.3中所得酶解液100 mL于燒杯中,置于恒溫水浴鍋中保溫至50℃,并調節至pH 6.5,保鮮膜封口。加入4%的活性炭,脫色30 min。用硅藻土做助濾層,抽濾除去活性炭,得脫色后的酶解液。中試時用精密過濾機除去活性炭。
1.2.5 噴霧干燥方法
將1.2.4制得的脫色后的酶解液進行噴霧干燥。進口溫度220℃,出口溫度90℃。
1.2.6 總氮含量的測定
按照GB/T 5009.5規定的方法測定。
1.2.7 發泡性測定方法[13]
量取1.2.3中所得酶解液100 mL于組織攪拌機中,以10 000 r/min的速度攪打2 min,攪打結束后,將其轉移至500 mL的量筒中,讀出泡沫的高度,此體積即為發泡力(單位是mL)。

1.2.8 發泡粉相對分子質量分布的測定
凝膠色譜法:色譜條件:色譜柱 TSKgel2000 SWXL300 mm ×7.8 mm;流動相:乙腈/水/三氟乙酸,45/55/0.1(體積比);檢測波長:UV220 nm;流速:0.5 mL/min;柱溫:30 ℃;進樣體積:10 μL。
樣品制備:稱取發泡粉20.0 mg于10 mL容量瓶中用流動相定容至刻度,超聲震蕩10 min,用微孔濾膜過濾后進樣。
1.2.9 發泡粉微觀形態觀察
采用場發射掃描電子顯微鏡觀察發泡粉的微觀形態。
剪取靜電雙面膠帶置于掃描電鏡載物臺上,然后挑取少量發泡粉灑在雙面膠帶上,并輕輕晃動使其分布均勻,再用吸耳球吹去多余的發泡粉,使發泡粉盡量不堆積在一起,放入鍍金器中進行噴碳鍍金。電子槍加速為20 kV,且在不同的放大倍數下掃描和拍照。
1.3 試驗設計
1.3.1 中性蛋白酶酶解液發泡力的單因素試驗
選取加酶量即酶與底物比(E∶S)、酶解時間、料液比、pH、溫度5個因素,考察酶解液發泡力的變化趨勢。
1.3.2 中性蛋白酶酶解液發泡力的響應面試驗
在單因素的基礎上,選擇加酶量、酶解時間、料液比3個因素進行響應面試驗。選取的因素與水平見表1。
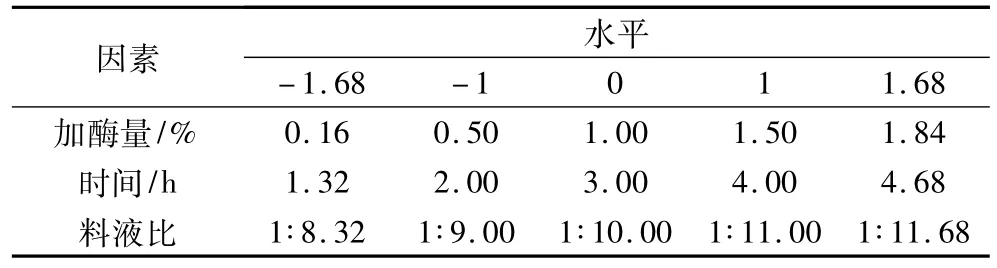
表1 二次正交中心組合設計因素水平編碼表
1.4 數據處理
試驗數據采用SAS分析軟件處理。
2 結果與分析
2.1 發泡力單因素試驗
2.1.1 加酶量對發泡力的影響
固定酶解條件:酶解時間3 h,溫度40℃,料液比 1∶10,pH 7.0 。分別選擇加酶量 0.5%、1.0%、1.5%、2.0%、2.5%、3.0%6 個水平進行試驗,考察加酶量對發泡力的影響,結果如圖2。
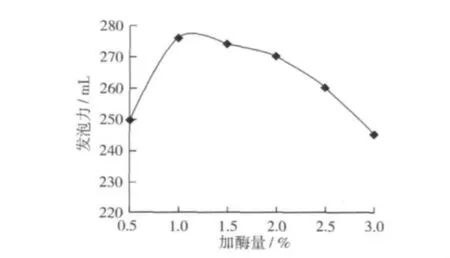
圖2 加酶量對發泡力的影響
由圖2可以看出,加酶量對發泡力的影響較大,整體趨勢是隨著加酶量的增加,發泡力先增大后減小。加酶量過少(0.5%)和過多(3.0%),酶解液的發泡力都很低,當加酶量在1.0%~2.5%時,發泡力比較高,1.0%時發泡力最高,所以后續的單因素試驗都選擇1.0%的加酶量。
2.1.2 酶解時間對發泡力的影響
固定酶解條件:加酶量1.0%,料液比1∶10,溫度40 ℃,pH 7.0。分別選擇酶解時間 0.5,1,2,3,4,5 h 6個水平進行試驗,考察酶解時間對發泡力的影響,結果如圖3。
由圖3可知,酶解時間對發泡力的影響也較顯著。前3個小時發泡力隨著時間的增加逐漸升高,當時間到達3 h時,發泡力達到最大,之后,再隨著時間的增加,發泡力開始逐漸下降。可見3 h時,在固定條件下,發泡力達到最佳水平。所以后續試驗選擇酶解時間為3 h。

圖3 酶解時間對發泡力的影響
2.1.3 料液比對發泡力的影響
固定酶解條件:加酶量1.0%,酶解時間3 h,溫度 40 ℃,pH 7.0。分別選擇料液比 1∶6,1∶7,1∶8,1∶9,1∶10,1∶11,1∶12 共 7 個水平進行試驗,考察料液比對發泡力的影響,結果如圖4。
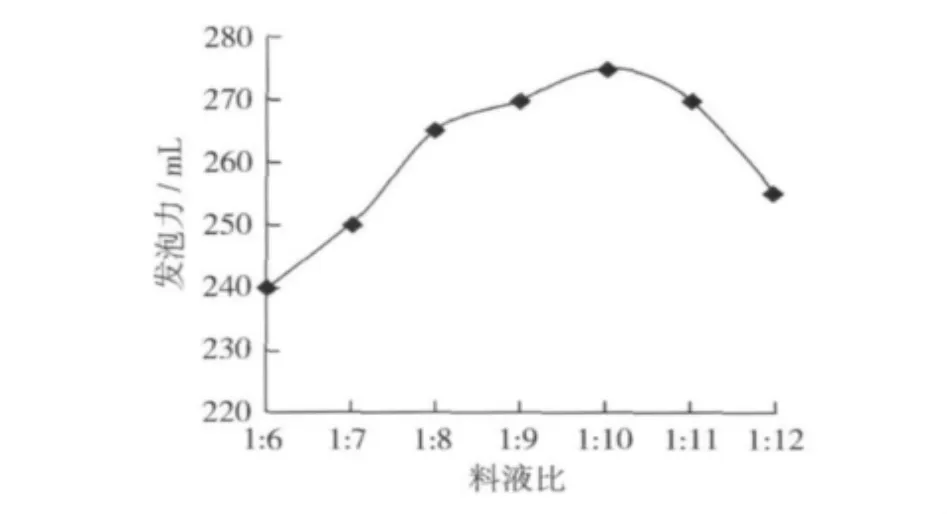
圖4 料液比對發泡力的影響
由圖4可以看出,料液比對發泡力也有較大影響。發泡力隨料液比的變化趨勢是先升高后降低。當料液比為1∶10時,發泡力最高。所以選擇1∶10為最佳料液比。
2.1.4 pH 對發泡力的影響
固定酶解條件:加酶量1.0%,酶解時間3 h,料液比1∶10,溫度40℃。由于所用中性蛋白酶的最適pH 為6.5~7.5,所以分別選擇 pH 6.50,6.75,7.00,7.25,7.50共5個水平進行試驗,考察pH對發泡力的影響,結果如圖5。
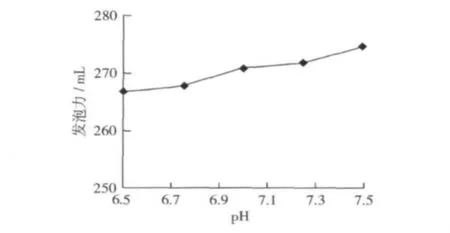
圖5 pH對發泡力的影響
由圖5可以看出,在酶的最適pH范圍內,發泡力隨pH增大而升高,但其變化幅度不大。說明在pH 6.5~7.5范圍內,pH對發泡力的影響不大。當pH 7.5時,發泡力最大,所以選擇pH 7.5作為酶解的最佳pH水平。
2.1.5 溫度對發泡力的影響
固定酶解條件:加酶量1.0%,酶解時間3 h,料液比1∶10,pH 7.5。由于所用中性蛋白酶的最適溫度范圍為40~60℃,所以分別選擇隨溫度為40,45,50,55,60℃ 5個水平進行試驗,考察溫度對發泡力的影響,結果如圖6。
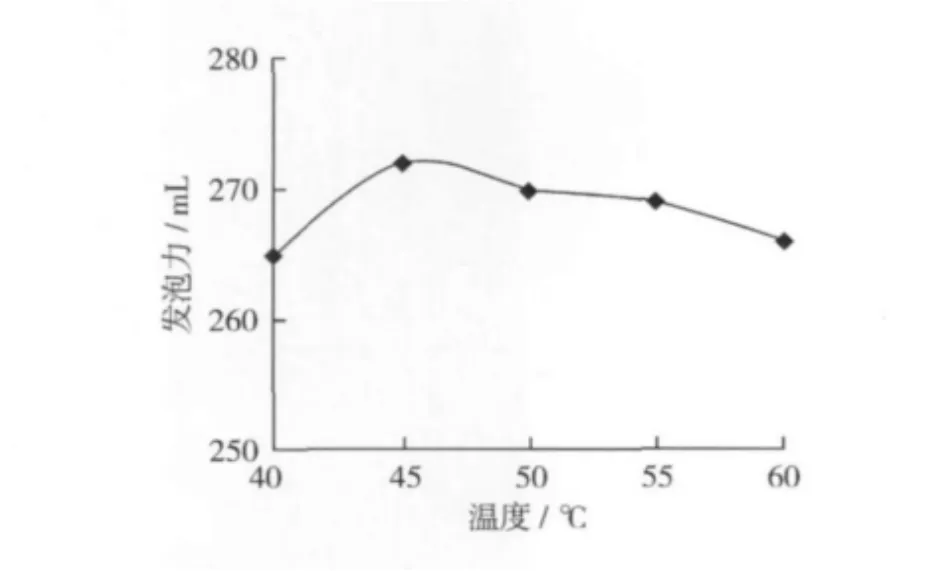
圖6 溫度對發泡力的影響
由圖6可知,在酶的最適溫度范圍內,隨著溫度的升高,發泡力在265~272 mL范圍內變化,可見,在40~60℃范圍內,發泡力受溫度的影響不大。選擇單因素的最佳值45℃作為酶解的最優溫度條件。
2.2 響應面試驗
2.2.1 回歸方程的建立與顯著性分析
在單因素試驗的基礎上,選定酶解pH 7.5,酶解溫度45℃,并以發泡力作為指標,選擇加酶量、酶解時間、料液比這3個對發泡力影響較大的因素進行響應面試驗。根據二次正交中心組合試驗設計,選擇23個處理組,試驗結果見表2。
運用SAS數據統計分析軟件對試驗數據進行多元回歸擬合,得到回歸方程,以及回歸方程方差分析表。Y= -596.35+136.25X1+73.91X2+143.16X3-32.36X12-17.50X1X2-X1X3-9.86X22-0.50X2X3-7.21X32
由表3 可知,失擬項 F1=0.29 < F0.05(5,13)=3.03,P=0.91 >0.05,即失擬是不顯著的,說明不存在影響試驗的其他不可忽略的因素;回歸項F2=11.64 > F0.01(9,13)=4.19,P=0.0001 < 0.01,即響應面回歸模型極顯著,說明該模型擬合度較好,試驗誤差小。其中一次項,二次項都達到了極顯著水平,交互作用也達到了顯著水平。模型的相關系數R2為88.96%,表示約89%的發泡性變化可以用此模型來解釋,所以可以用此模型對發泡力進行分析和預測。

表2 二次正交中心組合設計及結果
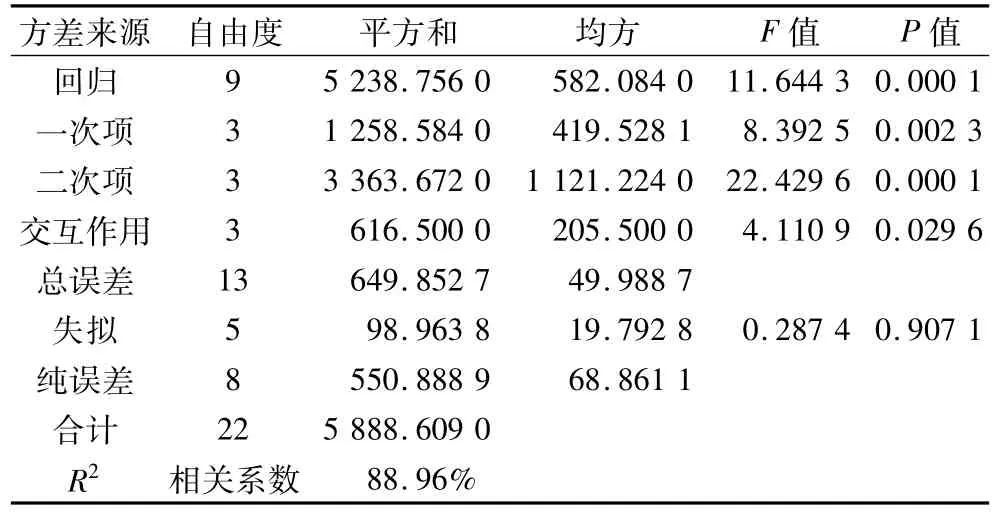
表3 二次回歸模型方差分析
從回歸系數的T檢驗結果(表4)可以看出,單因素中,加酶量(X1)對發泡力有顯著性影響(P<0.05);時間(X2)對發泡力影響極顯著(P <0.01);料液比(X3)在α=0.1水平上對發泡力影響顯著(P <0.1)。雙因子中,、X1X2對發泡力影響極顯著(P <0.01)。
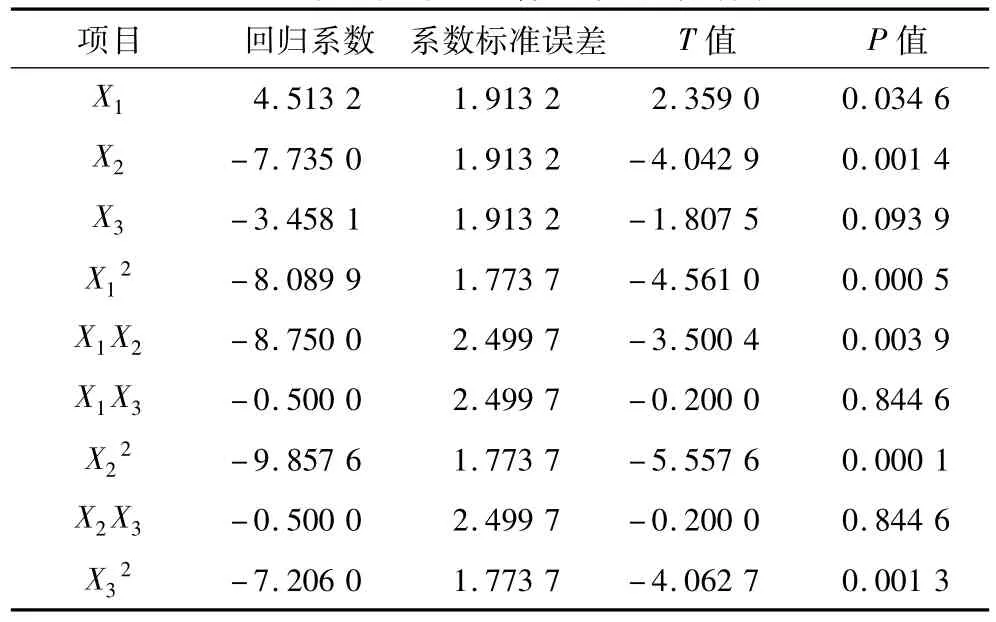
表4 二次正交中心組合設計回歸分析結果
2.2.2 顯著性交互作用對發泡力的影響
由表4分析中可知,交互作用中X1X2對發泡力影響極顯著,為了進一步考察X1X2之間的交互作用對發泡力的影響,作響應面圖及等高線圖如圖7。
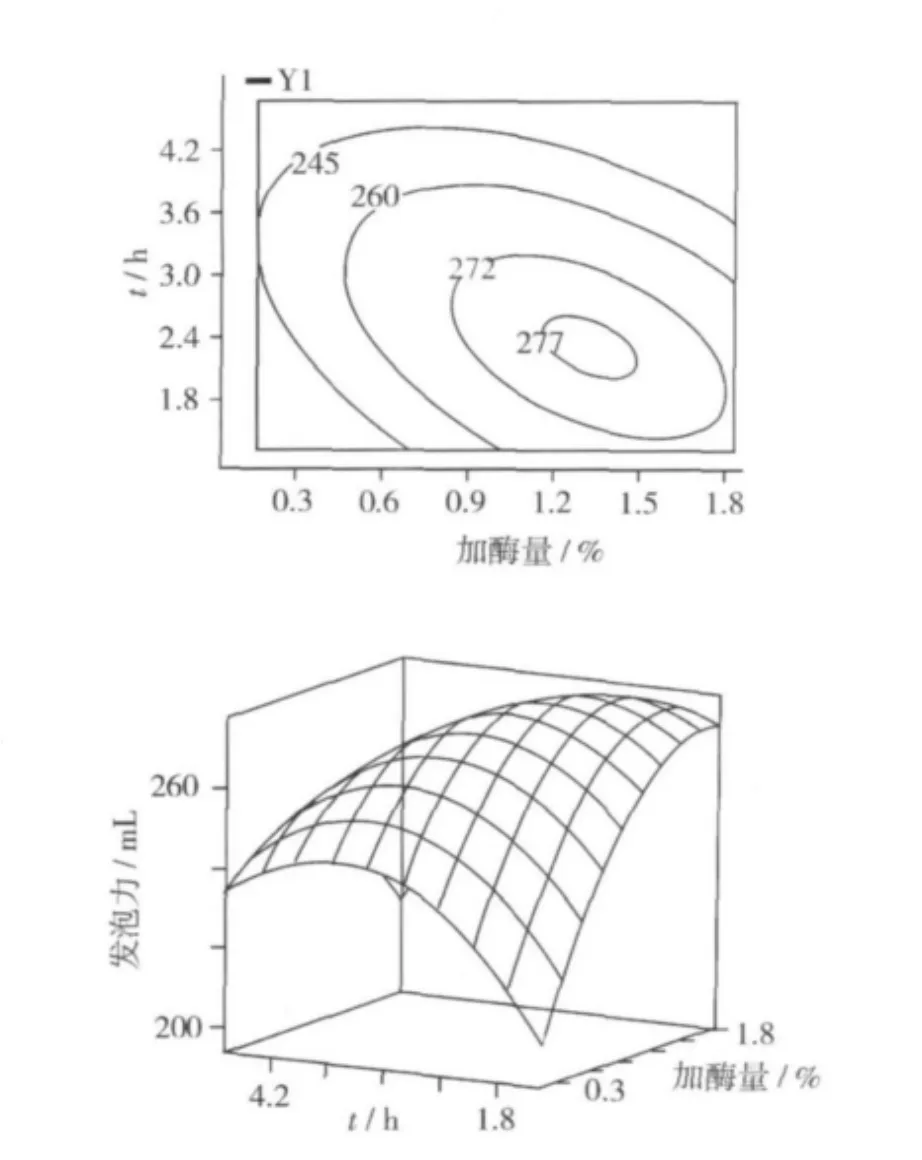
圖7 Y=f(X1,X2)的響應曲面圖及其等高線圖
由圖7,等高線呈橢圓形,說明加酶量與時間的交互作用對響應值發泡力的影響較大。
固定料液比為1∶10時加酶量與時間的響應曲面圖如圖7。由響應曲面可以看出,固定時間為某一值時,隨著加酶量的增加,發泡力先增加,后降低。固定加酶量為某一值時,隨著時間的增加,發泡力也是先增加后降低。當加酶量在1.16%~1.67%,時間在1.32~3 h時對提高發泡力最為有利。
2.2.3 最佳酶解條件的確定
用SAS軟件對試驗結果進行分析優化可得最佳酶解條件為加酶量1.33%,酶解時間2.16 h,料液比1∶10,預測最大發泡力為277 mL。按照SAS軟件分析所得的最佳條件,進行驗證,酶解液發泡力可達275 mL。
2.3 發泡粉蛋白的相對分子質量分布
蛋白質的發泡性與蛋白質分子表面的極性和蛋白質分子的大小密切相關。良好的蛋白質發泡性需要合適的分子大小[14],而通過控制酶解條件如加酶量或酶解時間就可能獲得相對分子質量分布不同的酶解物組分[15],因此可以將酶解物的相對分子質量控制在適宜發泡的范圍內。為了了解上述試驗中用中性蛋白酶制備的蛋白發泡粉的相對分子質量分布狀況,采用高效液相凝膠色譜法對其的相對分子質量分布狀況進行分析,分析色譜圖如圖8。

圖8 發泡粉蛋白的相對分子質量分布
由圖8可知,發泡粉蛋白的相對分子質量的峰集中出現在18~27 min,其中相對分子質量在189~500之間的占62.24%,相對分子質量在500~1 000之間的占26.33%,說明水解出來的主要是寡肽,總共占88.57%。寡肽具有良好的溶解性,而良好的溶解性是表現蛋白質功能性(發泡性)的基礎[16]。且本研究選擇中性蛋白酶酶解米渣,其僅水解羧基端是Tyr、Trp、Phe等芳香族疏水性氨基酸殘基的肽鍵,從而保證了水解蛋白的一定的疏水性。綜上,發泡粉在溶解性(親水性)和疏水性之間達到了一定的平衡,從而具有良好的發泡性。
2.4 發泡粉的微觀形態
通過電子掃描顯微鏡(SEM)觀察了發泡粉的微觀形態,并與原料米渣進行比較,如圖9。
由圖9可以看出,原料米渣蛋白質由于經過高溫變性,形成了高分子聚集體,形狀不規則,表面凹凸不平并堆積在一起,而經過酶解改性的發泡粉則呈大小不一的球狀結構。由此可知,原料米渣的塊狀結構難以與水分子充分接觸,溶解性差,而經過噴霧干燥工藝的發泡粉的球狀結構,使得水分子可以容易地進入其中,大大增加了水解蛋白的比表面積,溶解性也大大增加。同時酶解使蛋白質分子發生了結構重排,因此原來包埋于蛋白質分子內部的疏水性基團暴露到水相中[17]。所以,經過中性蛋白酶的酶解,米渣蛋白質由大分子變成了小分子,蛋白質結構也發生了變化,比表面積增加,溶解性增加,從而蛋白質的功能性(發泡性)與原料蛋白質有很大差別,發泡性也就得到了改善。

圖9 米渣和蛋白發泡粉掃描電鏡圖(×5 000)
2.5 發泡粉的主要質量指標
經1.2.1的工藝步驟制得的蛋白發泡粉的主要質量指標如表5。
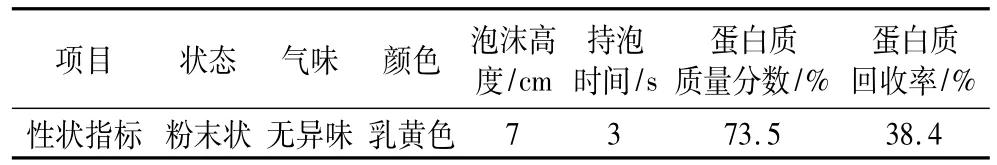
表5 發泡粉的主要質量指標
3 結論
3.1 在單因素試驗的基礎上,選定酶解pH 7.5,酶解溫度45℃,并選擇對發泡力影響較大的3個因素加酶量、酶解時間、料液比進行響應面試驗。以發泡力為指標,經SAS軟件分析得到中性蛋白酶酶解的最佳工藝條件為:加酶量1.33%,酶解時間2.16 h,料液比1∶10;理論預測最大發泡力為277 mL,經驗證,酶解液的發泡力為275 mL,驗證結果與預測結果差別不大,說明已建立的數學模型可用于發泡力的工藝條件優化。
3.2 通過高效液相凝膠色譜測定發泡粉蛋白的相
對分子質量分布狀況可知,發泡粉的相對分子質量在189~500之間的占62.24%,相對分子質量在500~1 000之間的占 26.33%,因此寡肽總共占88.57%,具有良好的溶解性;而中性蛋白酶酶解改性又保證了酶解物的一定的疏水性,所得發泡粉在溶解性和疏水性之間取得了一定的平衡,從而發泡性得到提高。
3.3 通過掃描電鏡圖可以看出經過中性蛋白酶的酶解,米渣蛋白的結構發生了變化,比表面積大大增加,溶解性增加,功能性也隨之改變,從而發泡性也就得到改善。
3.4 經脫糖,酶解,脫色,噴霧干燥工藝制備的大米蛋白發泡粉呈乳黃色,無異味,發泡性能良好(3%的發泡粉溶解攪打后可獲得泡沫高度為7 cm),蛋白質含量高。
[1]玄國東,何國慶,熊皓平,等.大米蛋白酶法改性及酶解物功能特性研究[J].中國糧油學報,2005,20(3):1-4
[2]王章存,劉衛東,姚惠源.熱變性大米蛋白的結構和性質研究Ⅰ米蛋白加熱前后的溶解特性和氨基酸變化[J].中國糧油學報,2007,22(2):5 -7,11
[3]董吉林,姚惠源.熱變性米蛋白的性質與結構研究Ⅱ米蛋白組分特征[J].中國糧油學報,2008,23(4):1 -4
[4]王章存,申瑞玲,姚惠源.大米蛋白研究進展[J].中國糧油學報,2004,19(2):11 -15
[5]呂映輝,潘海濤,張道雷,等.風味蛋白酶酶解制取大豆蛋白發泡粉的工藝研究[J].中國調味品,2009,34(9):96-97
[6]夏劍秋,王敏.大豆蛋白發泡粉的酶法提取工藝技術[J].中國油脂,2007,32(11):47 -48
[7]王章存,劉衛東,宋予軍.大豆蛋白酶法水解制取食用發泡劑的研究[J].鄭州輕工業學院學報:自然科學版,1994,9(4):1 -5
[8]阮暉,陳美齡,俞超,等.大米發泡蛋白酶法制備工藝[J].農業工程學報,2009,25(1):281 -284
[9]胡中澤.酶法水解制取大米蛋白發泡粉工藝參數的研究[J].糧食與飼料工業,2002,(9):45 -46
[10]王文高,陳正行,姚惠源.大米蛋白及其水解物功能性質與疏水性關系的研究[J].糧食與飼料工業,2002(7):49-50
[11]劉珊,劉曉艷.熱變性對蛋白質理化性質的影響[J].中國食品添加劑,2006(6):108-112
[12]高育哲.定位限制性酶解對大豆分離蛋白表面性質及結構特性的影響[D].哈爾濱:東北農業大學,2008
[13]Tang S,Hettiarachchy N S,Horax R,et al.Physicochemical properties and functionality of rice bran protein hydrolyzate prepared from heat stabilized defatted rice bran with the aid of enzymes[J].Journal of Food Science,2003,68(1):152 -157
[14]王章存,姚惠源.大米蛋白質的酶法水解及其性質研究[J].中國糧油學報,2003,18(5):5 -7,15
[15]王章存,劉衛東,鄭堅強,等.大米蛋白的酶水解機制研究Ⅰ——酶反應進程及酶在反應體系中的分配[J].中國糧油學報,2007,22(3):5 -8
[16]王章存,聶卉,康延玲.酶法提取大米蛋白研究進展[J].現代食品科技,2006,22(3):255 -258
[17]Popineau Y,Masson P,Thebaudin J Y.Enzymatic processing of wheat proteins[M].//Godon B.Bioconversion of Cereal Products.USA:VCH Publishers,1993:129 -131.
Research on RSM Optimization of Preparation of Rice Dregs Foaming Protein
Wu Yujing Du Xianfeng
(College of Tea and Food Science and Technology,Anhui Agricultural University,Hefei 230036)
The foam powder with high protein content is obtained from rice dregs after removal of sugar,enzymatic hydrolysis,decoloration and spray dying.It is milky and odorless.It also has excellent foaming properties.In the single factor test,enzyme dosage,enzymatic time,and the ratio of stuff to liquid have lager impact on foaming ability.Then the response surface methodology(RSM)is used to optimize the conditions of enzymatic hydrolysis of neutral protease.The mechanism of the increase of foaming ability is also explained by high performance liquid chromatography(HPLC)and scanning electron microscopy(SEM).The result shows that the optimum conditions are as follows:enzyme dosage/substrate(E∶S)is 1.33%;enzymatic time is 2.16 h;and the ratio of stuff to liquid is 1∶10.The highest foaming ability in theory is 277 mL and the actual value is 275 mL.
rice dregs,enzymolysis,neutral protease,foam powder
TS209
A
1003-0174(2012)09-0096-07
安徽省戰略性新興產業科技計劃(11010302147)
2011-12-20
吳雨靜,女,1986年出生,碩士,食品科學
杜先鋒,男,1964年出生,教授,博士生導師,食品生物技術及農副產品深加工技術

