赭曲霉毒素A直接競爭ELISA試劑盒的研制
李沐潔 奚 茜 張明洲, 陳宗倫 王唯芬
(浙江省生物計量與檢驗檢疫重點實驗室 中國計量學院生命科學學院1,杭州 310018)
(杭州迪恩科技有限公司2,杭州 310013)
赭曲霉毒素A直接競爭ELISA試劑盒的研制
李沐潔1奚 茜1張明洲1,2陳宗倫2王唯芬1
(浙江省生物計量與檢驗檢疫重點實驗室 中國計量學院生命科學學院1,杭州 310018)
(杭州迪恩科技有限公司2,杭州 310013)
在多克隆抗體的基礎上研制了赭曲霉毒素A(OTA)直接競爭酶聯免疫檢測(cd-ELISA)試劑盒。在0~10 ng/mL范圍內,該試劑盒50%抑制率(IC50)為1.09 ng/mL,檢測靈敏度(IC15)為0.08 ng/mL;與赭曲霉毒素B、C的交叉反應率分別為6.28%和0.16%,而與黃曲霉毒素B1等生物毒素未見有交叉反應;板內與板間平均變異系數分別為2.21%和2.79%;花生、玉米和玉米粉3種樣品中OTA的檢測低限分別為1.71,1.26和1.85 μg/kg,平均添加回收率在83.80%~91.40%;與 HPLC 檢測方法具有較高的相關性,相關系數(R2)分別為0.94、0.88和0.90;檢測時間只需20 min,可用于花生、玉米及玉米粉中OTA的批量快速篩查。
赭曲霉毒素A 多克隆抗體 直接競爭ELISA
赭曲霉毒素主要是由赭曲霉(Aspergillus ochraceus)及純綠青霉(Penicillium viridicatum)等有毒真菌在惡劣環境條件下產生的有毒次級代謝產物[1],屬烈性的肝臟和腎臟毒素。它包括7種化學結構相似的化合物,其中毒性最大、分布最廣、產毒量最高、對農作物污染最重、對人和動物影響最大的是赭曲霉毒素A(OTA)。OTA具有腎臟毒性、肝臟毒性、免疫毒性、以及致畸、致癌和致突變作用等多種毒性,對動物和人體健康有很大的潛在危害[2]。1993年,國際癌癥研究機構(The International Agency for Research on Cancer,LARC)將 OTA定為2B類致癌物(即可能引起人類癌癥的物質)[3]。因此世界各國均重視對赭曲霉毒素A的檢測和控制,歐盟于2006年12月19日制定歐盟委員會條例(EC)No1881/2006[4],規定谷物原料中 OTA 最大限量為 5 μg/kg,谷物加工制品和直接供人食用的谷物中最大限量為3 μg/kg,嬰幼兒食品及有特殊醫療目的嬰兒食品中不超過0.5 μg/kg;我國也規定供人食用谷類和豆類中 OTA 的最大限量為 5 μg/kg[5]。
目前OTA的檢測方法主要有薄層色譜法(TLC)[6-8]、高效液相色譜法(HPLC)[9-11]、液相色譜串聯質譜法[12-13]、酶聯免疫吸附法[14-16]等。但色譜分析需要昂貴的儀器、復雜的樣品預處理(凈化,濃縮或衍生)和大量的有機溶劑和其他化學品[17],不能滿足基層大規模篩查和現場抽檢的需要。酶聯免疫分析(ELISA)方法可以在較短時間內完成大量樣品的分析,操作簡便,成本比較低,適合作為大量陰性樣品的快速篩選[18]。本研究在制備OTA特異性多克隆抗體的基礎上,采用直接包被抗體的方法成功研制出OTA直接競爭酶聯免疫(cd-ELISA)檢測試劑盒,為谷物中OTA免疫快速篩檢方法的建立和擁有自主知識產權檢測試劑盒產品的開發奠定基礎。
1 材料和方法
1.1 主要試劑
赭曲霉毒素A、赭曲霉毒素B、赭曲霉毒素C、黃曲霉毒素B1、黃曲霉毒素M1、玉米赤霉烯酮、伏馬毒素B1、嘔吐毒素與T-2毒素:以色列Fermantek公司;人血清白蛋白(HSA)、辣根過氧化物酶(HRP)、3,3',5,5'- 四甲基聯苯胺(TMB)、弗氏完全與不完全佐劑、N-羥基琥珀酰胺(NHS)、N,N-二環己基碳二亞胺 (DCC)、N,N-二甲基甲酰胺(DMF)、N,N'-羰基二咪唑(CDI):美國Sigma公司;牛血清白蛋白(BSA):美國Amesco公司;辣根過氧化物酶標記羊抗兔IgG:美國Pierce公司;色譜純甲醇、乙腈:美國Tedia公司,其他試劑均為國產分析純。
磷酸鹽緩沖溶液(PBS):0.01 mol/L,pH 7.4;洗液(PBST):含 0.05%Tween-20的 PBS;包被液(CBS):0.1 mol/L pH 9.6的碳酸鹽緩沖液;封閉液:含5%OVA的PBST;終止液:2 mol/L硫酸。
1.2 主要儀器與耗材
UV-4802S紫外可見分光光度計:美國Unico公司;VE-180垂直電泳槽、EPS-300數顯穩壓穩流電泳儀:上海天能科技有限公司;Gel Doc XR凝膠成像系統:美國Bio-rad公司;Multiskan Ascent全自動酶聯免疫分析儀:美國Thermo公司;H P1100高效液相色譜儀(配熒光檢測器):美國Agilent公司;96孔酶標板:美國Corning-Costar公司。
1.3 OTA人工抗原的合成與鑒定
采用活潑酯法合成OTA人工抗原(圖1)。準確稱取 3.5 mg OTA、3.8 mg NHS 和13.6 mg DCC 溶于0.5 mL DMF中,室溫下避光攪拌反應18 h,吸取100 μL上述溶液,冰浴條件下逐滴加入1.75 mg BSA(溶于 0.75 mL 0.13 mol/L NaHCO3溶液)中,室溫下避光攪拌反應2 h。反應結束后,4℃下PBS透析3 d[19]。同法合成包被抗原OTA-HSA。人工抗原采用紫外光譜掃描、SDS-PAGE電泳與紅外掃描(波數400~4 000 cm-1)鑒定。
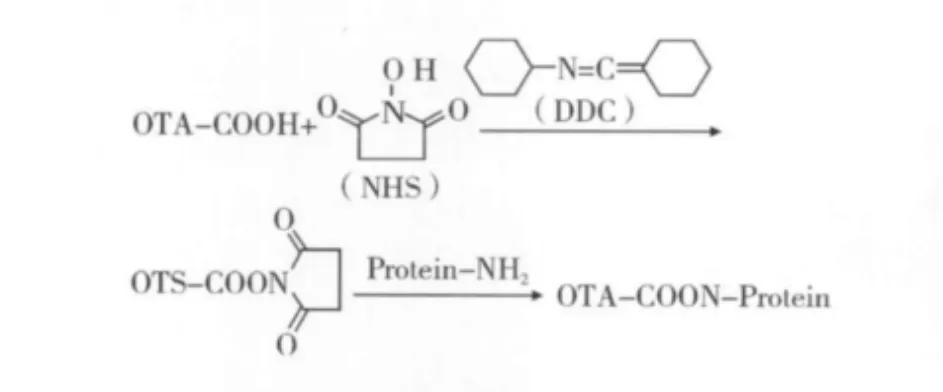
圖1 OTA人工抗原合成路線
1.4 OTA酶標抗原的制備
準確稱取2 mg OTA溶于100 μL丙酮,加入3 mg CDI,室溫避光攪拌反應20 min后逐滴加入4 mg HRP(溶于1.5 mL 0.05 mol/L 碳酸鹽緩沖液)中,室溫避光攪拌反應4 h。反應結束后,4℃下PBS透析3 d[20]。
1.5 多克隆抗體的制備及效價測定
將1 mg/mL OTA-BSA與等量佐劑乳化(第1次免疫用弗氏完全佐劑,以后加強免疫均用弗氏不完全佐劑),采用背腹部皮下多點注射方式免疫2.5~3 kg體重新西蘭大白兔,共免疫4次,首次免疫劑量為 0.5 mg/(mL·只),加強免疫為 0.25 mg/(mL·只)。第4次加強免疫后10 d心臟采血。血清經辛酸-硫酸銨分離純化后由SDS-PAGE電泳鑒定并采用間接ELISA測定抗體效價。
1.6 OTA直接競爭ELISA(cd-ELISA)的建立
1.6.1 抗體與酶標抗原最適工作濃度的確定
用CBS將抗體倍比稀釋(1∶500~1∶3 000)后包被 96 孔酶標板,100 μL/孔,37 ℃ 孵育 2 h,PBST洗滌3次;200 μL/孔封閉液,37 ℃封閉 2 h,PBST洗滌3次;加入PBS倍比稀釋的OTA酶標抗原(1∶100 ~1∶800),100 μL/孔,37 ℃ 孵 育 10 min,PBST 洗滌3 次;加入顯色劑,100 μL/孔,37 ℃ 孵育10 min;每孔加入100 μL終止液終止反應,酶標儀測定各孔的OD450nm值。選擇OD450nm值為1.0左右的組合[21]。
1.6.2 OTA與酶標抗原最佳反應模式的確定
在抗體與酶標抗原最適工作濃度下,加入PBS或PBS配制的10 ng/mL OTA與酶標抗原(A:50 μL PBS或 OTA+100 μL 酶標抗原;B:100 μL PBS 或OTA+100 μL 酶標抗原;C∶100 μL PBS 或 OTA+50 μL 酶標抗原;D∶50 μL PBS 或 OTA+50 μL 酶標抗原),按1.6.1測定各孔的OD450nm值并計算4種模式下方法對10 ng/mL OTA的抑制情況,選擇抑制效果好的反應模式。
1.6.3 OTA 直接競爭 ELISA(cd-ELISA)標準曲線的建立
在最佳工作濃度和反應模式下,PBS配制OTA系列標準工作溶液(10、5、2.5、1.0、0.5、0.25、0.1、0 ng/mL),采用cd-ELISA測定OD450nm值。以結合率(B/B0,B是不同質量濃度的 OTA標準品的OD450nm值,B0是 OTA標準品質量濃度為 0時的OD450nm值)為縱坐標,OTA不同質量濃度為橫坐標繪制OTA標準曲線,并分別計算50%(IC50)和15%(IC15)抑制濃度,以IC50衡量抗體對OTA的親合性,以IC15衡量OTA cd-ELISA法的檢測靈敏度。結合率與抑制率計算公式如下:

1.6.4 方法的特異性分析
在cd-ELISA最佳工作條件下,將赭曲霉毒素B、C及其他生物毒素(黃曲霉毒素B1、黃曲霉毒素M1、玉米赤霉烯酮、伏馬毒素B1、嘔吐毒素與T-2毒素)作為抑制劑,測定各抑制劑50%抑制濃度(IC50),以抗體對OTA的IC50與對各抑制劑的IC50之比的百分數為其交叉反應率(CR),通過交叉反應率高低衡量方法的特異性。交叉反應率(CR)按式(3)計算:
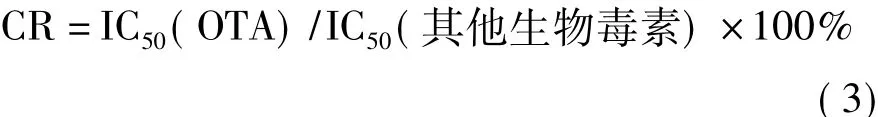
1.6.5 方法的準確性分析
通過在同一酶標板上做6組平行cd-ELISA標準曲線和分別在6個包被批次的酶標板上各做1組平行cd-ELISA標準曲線進行板內與板間變異系數分析,研究不同標準品濃度測定結果的準確性。
1.6.6 樣品添加回收試驗與最低檢出限分析
1.6.6.1 樣品前處理方法
精確稱取粉碎樣品2 g于50 mL可密封的離心管中,加入10 mL提取液(50%的甲醇水溶液),于振蕩器上振蕩提取5 min,用濾紙過濾,或者5 000 r/min離心5 min,取上清液備用。
1.6.6.2 樣品基質影響試驗
取花生、玉米和玉米粉陰性樣品,按1.6.6.1方法分別制備提取上清液,以PBS稀釋1、2.5和5倍不同處理;以PBS為對照,每處理用于配制系列標準品溶液,按1.6.3方法建立4條標準曲線,分析樣品基質對OTA cd-ELISA的影響。
1.6.6.3 檢測低限分析
隨機抽取陰性樣品,按1.6.6.1方法前處理并消除基質影響后以建立的OTA cd-ELISA分析,檢測低限(LOD)以陰性樣品的平均測定值(n=20)加上其3倍的標準差進行計算。
1.6.6.4 樣品加標回收率試驗
在花生、玉米和玉米粉陰性樣品中分別添加OTA標準品至5、10和25!g/kg,每濃度重復做3次,每個重復設2孔平行。樣品按1.6.6.1方法前處理并消除基質影響后,cd-ELISA測定OD450nm值,并根據標準曲線計算樣品添加回收率:

1.6.7 與HPLC比對試驗
1.6.7.1 色譜條件[22]
色譜柱:Hypersil C18(150 mm ×4.6 mm,3 μm);柱溫:室溫;流動相:乙腈/水/乙酸(99/99/2,體積比);流速:0.4 mL/min;進樣量:20 μL;激發波長:330 nm;發射波長:450 nm。
1.6.7.2 OTA 標準曲線制備
乙腈配制OTA系列標準工作溶液(100、40、20、10、1、0 ng/mL),采用上述色譜條件測定各濃度下的色譜峰面積,以濃度為橫坐標,峰面積為縱坐標繪制標準曲線。
1.6.7.3 樣品前處理[23]
取粉碎后的樣品5 g,加入25 mL甲醇,超聲提取20 min,過濾;取適量甲醇潤洗容器和濾紙,合并甲醇溶液;將甲醇提取液減壓蒸干,取5 mL流動相溶解,過0.22 μm濾膜后進樣分析。以保留時間定性,峰面積定量。
1.6.7.4 比對方法
在花生、玉米和玉米粉粉碎陰性樣品中分別添加 OTA 標準品至 5、10、25、50 μg/kg,分別用 HPLC與ELISA方法提取測定,每個樣品添加濃度重復6次,以HPLC測定值為橫坐標、ELISA測定值為縱坐標繪制散點圖進行回歸分析,以相關系數(R2)衡量2種方法的相符性。
2 結果與討論
2.1 OTA人工抗原鑒定
2.1.1 紫外掃描分析
將 OTA、BSA、HSA、OTA -BSA、OTA -HSA 溶液用PBS稀釋到合適濃度后進行紫外掃描。結果表明(圖2),載體蛋白BSA、HSA在280 nm有特征吸收,OTA在333 nm具有特征吸收峰,反應產物的圖譜與載體蛋白、OTA的圖譜都有所不同。同時,反應產物的最大吸收峰波長與載體蛋白、OTA的比較都有所移動,這說明反應產物是不同于載體蛋白和半抗原的物質,是載體蛋白和OTA的復合物。

圖2 OTA人工抗原的紫外掃描圖
2.1.2 SDS-PAGE 電泳分析
OTA人工抗原SDS-PAGE電泳結果如圖3所示,第3、5泳道分別明顯滯后于第2、4泳道,說明載體BSA或HSA經合成反應后連接上了一定數目的OTA,從而使得分子質量增大。
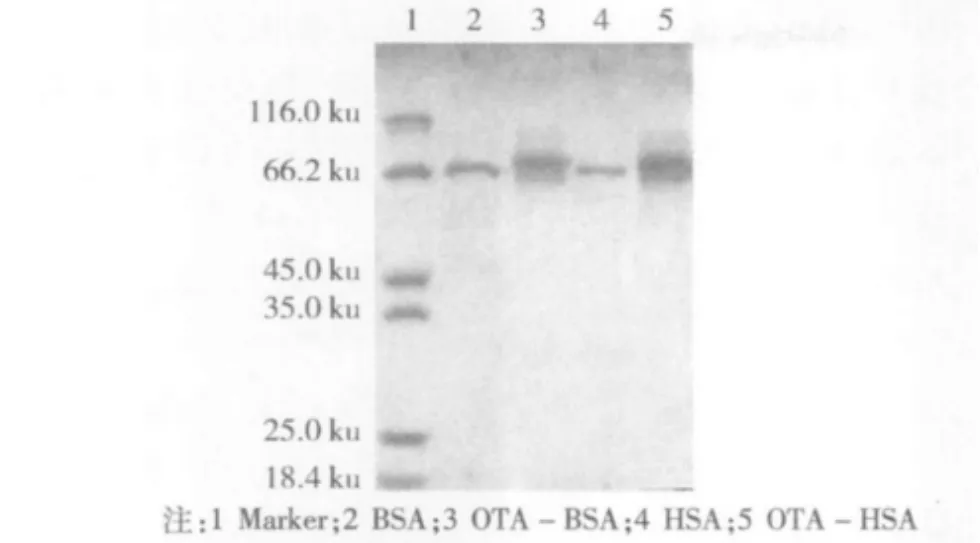
圖3 OTA人工抗原SDS-PAGE電泳圖
2.1.3 紅外掃描分析
將OTA、BSA和OTA-BSA凍干粉與適量KBr混勻研磨后壓片進行紅外掃描,從圖4可以看出,反應產物的圖譜與載體蛋白、半抗原的圖譜存在一定差異。與OTA相比,產物在羧基中氧氫鍵所在的3 000 cm-1處的吸收峰的峰型不明顯,而與BSA相比,產物在1 530 cm-1處伯氨基的吸收峰明顯降低,可以推測這是由于OTA的羧基與BSA的伯氨基發生脫水縮合反應形成肽鍵,導致羧基和伯氨基大量減少造成的,再結合紫外光譜圖和SDS-PAGE結果,證明OTA與BSA確已發生了偶聯反應。
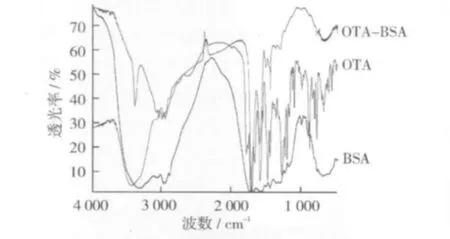
圖4 OTA人工免疫原的紅外掃描圖
2.2 血清純化結果
血清經純化由SDS-PAGE(圖5)鑒定可知,其在2、4泳道中僅呈現2條帶,分子質量大約在52 ku和26 ku左右,分別與抗體的重、輕鏈分子質量55 ku和26 ku大小一致,其他條帶均消失,說明血清純化達到較好的效果。
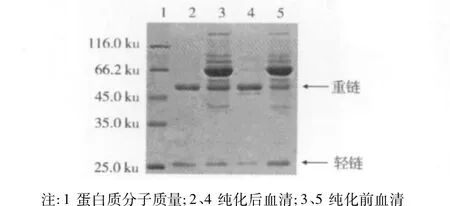
圖5 血清抗體SDS-PAGE電泳圖
2.3 抗體效價測定
用CBS將包被抗原OTA-HSA稀釋成2 μg/mL后包被96孔酶標板,采用間接ELISA測定純化抗體效價。OD450nm值為0.8~1.0左右時抗體的稀釋倍數即為其效價。從表1可看出OTA抗體的效價為1∶3 000。

表1 OTA抗體效價測定
2.4 OTA直接競爭ELISA(cd-ELISA)的建立
2.4.1 OTA抗體與酶標抗原最適工作濃度的確定
根據棋盤法結果(表2),選擇 OD450nm值為1.0左右的組合。考慮到陰性值越低對檢測影響越小,以及節約抗體、酶標抗原使用量的原則,最后確定包被抗體稀釋3 000倍,酶標抗原稀釋200倍時為最佳工作濃度。
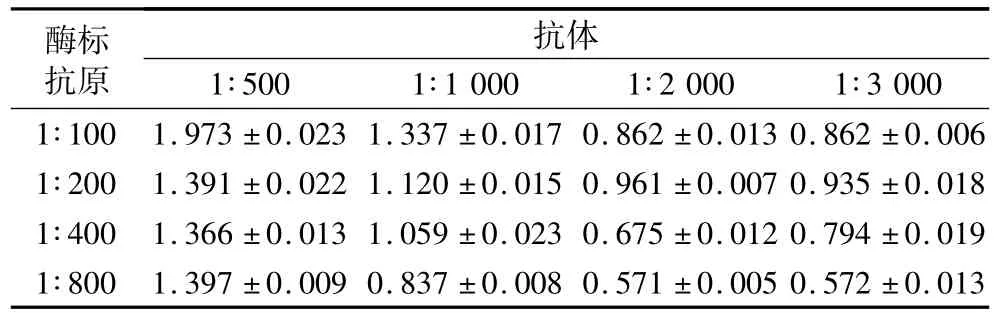
表2 OTA抗體和酶標抗原最佳工作濃度的確定
2.4.2 OTA與酶標抗原最佳反應模式的確定
結果如表3,考慮到抑制情況,最后確定OTA加樣量為100 μL,酶標抗原為50 μL為最佳反應模式。
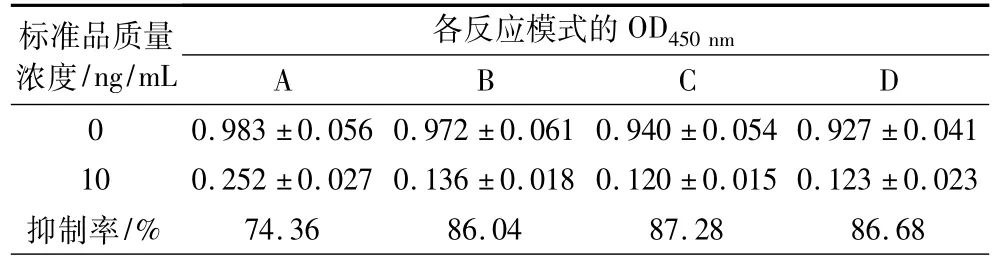
表3 反應模式的確定
2.4.3 OTA cd-ELISA 標準曲線的建立
用CBS將抗體稀釋3 000倍后包被96孔酶標板,100 μL/孔,37℃ 孵育 2 h,PBST 洗滌 3 次;200 μL/孔封閉液,37℃封閉2 h,PBST洗滌 3次;加入100 μL OTA 系列標準工作溶液(10、5、2.5、1.0、0.5、0.25、0.1、0 ng/mL)與 50 μL PBS 稀釋 200 倍的OTA酶標抗原,37℃孵育10 min,PBST洗滌 3次;加入顯色劑,100 μL/孔,37 ℃孵育10 min;每孔加入100 μL終止液終止反應,酶標儀測定各孔的OD450nm值。
以結合率為縱坐標、OTA濃度為橫坐標繪制的標準曲線如圖6所示。在0.1~10 ng/mL質量濃度范圍內結合率與濃度呈線性關系,線性回歸方程為y= -0.347 6x+0.878 3,R2=0.991 9,50%抑制率IC50=1.09 ng/mL,方法的檢測靈敏度 IC15=0.08 ng/mL。
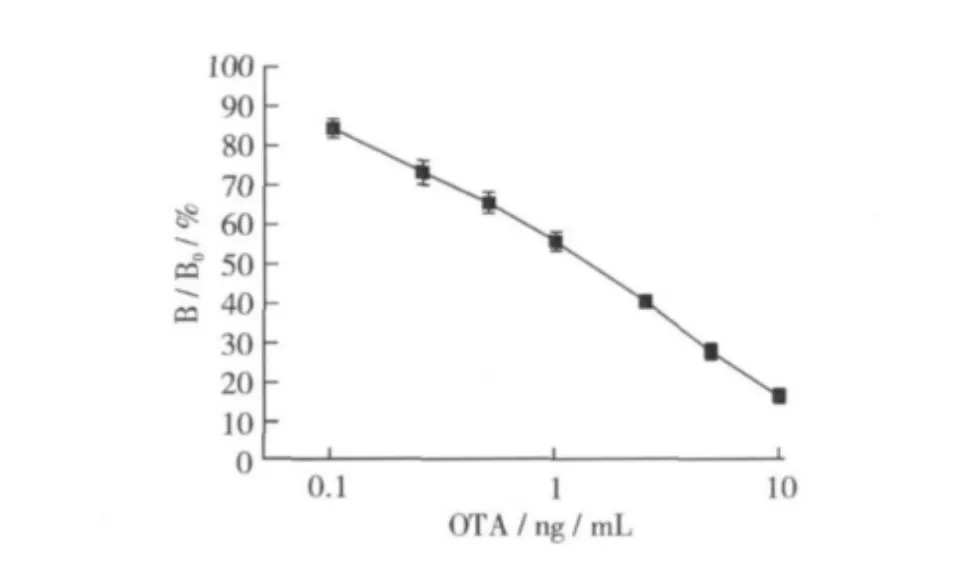
圖6 OTA標準曲線
2.4.4 方法的特異性分析
OTA抗體對其類似物赭曲霉毒素B、C的交叉反應率分別為6.28%和0.16%;而對黃曲霉毒素B1等生物毒素的交叉反應率均小于0.01%(表4)。說明以本研究獲得的OTA抗體建立的cd-ELISA檢測方法具有良好的特異性,其他生物毒素對OTA檢測的干擾較小。
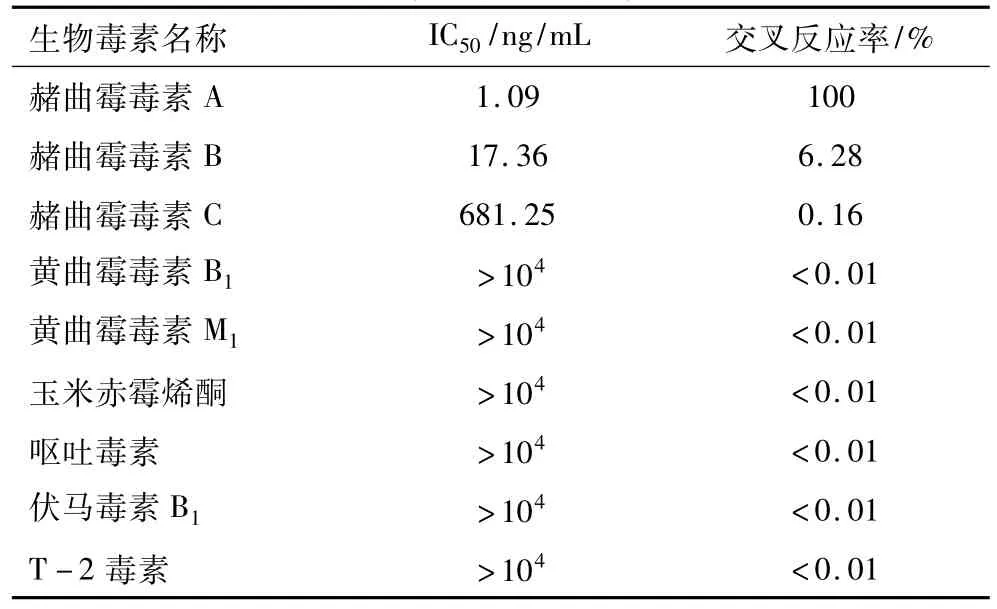
表4 交叉反應試驗結果
2.4.5 方法的準確性分析
結果表明(表 5),各濃度板內變異系數在0.73%~3.79%之間,平均變異系數為 2.21%,板間變異系數在1.67%~4.29%之間,平均變異系數為2.79%。說明該方法的準確性較高,可以滿足谷物中OTA含量分析的基本要求。
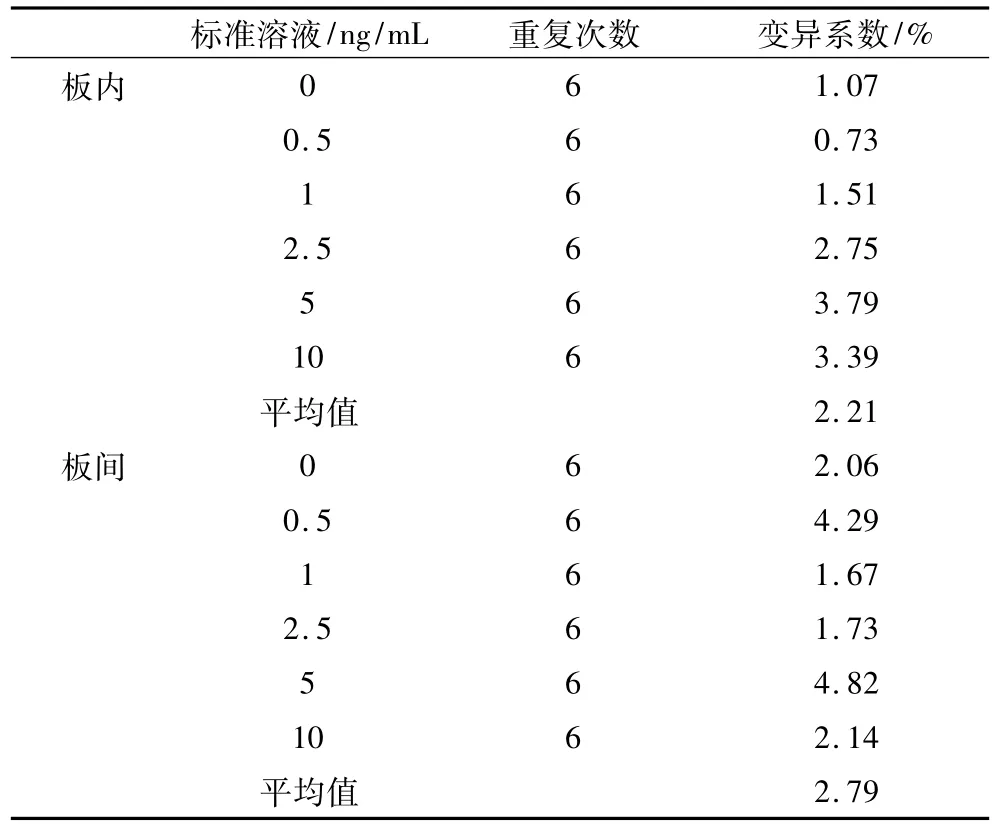
表5 板內與板間變異系數
2.4.6 樣品基質影響分析
與對照(樣品稀釋液)相比較,樣品基質被稀釋1倍和2.5倍時,樣品基質仍對標準曲線有一定影響;稀釋5倍時,0.1~10 ng/mL范圍內的標準曲線變化不大(圖7)。因此,花生、玉米和玉米粉3種樣品選擇5倍稀釋來消除基質影響。
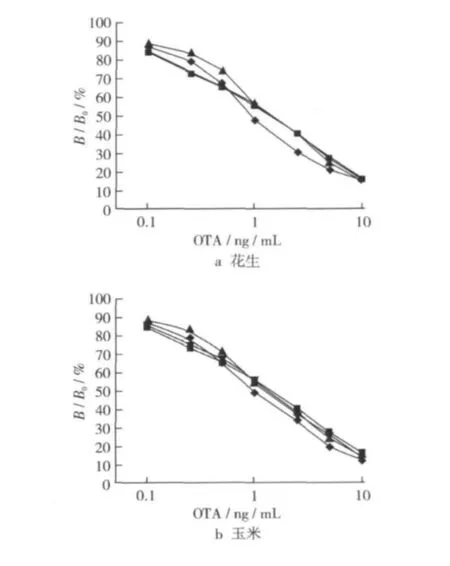
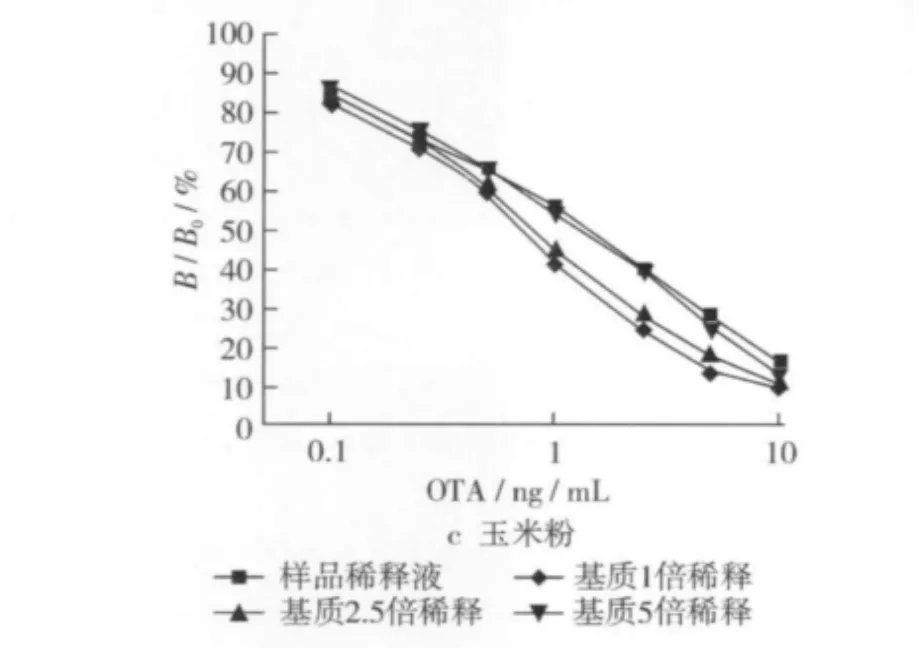
圖7 樣品基質對標準曲線的影響
2.4.7 方法的檢測低限分析
從表6可見,花生、玉米及玉米粉中OTA的檢測低限分別為1.71、1.26 和 1.85!g/kg。
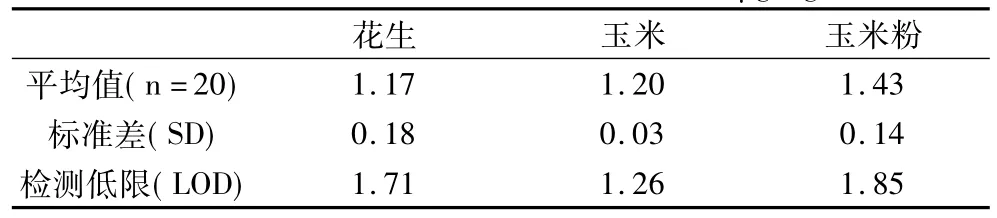
表6 花生、玉米與玉米粉的檢測低限/!g/kg
2.4.8 樣品加標回收率試驗
花生、玉米和玉米粉陰性樣品中,OTA在添加5~25!g/kg的平均回收率在83.80%~91.40%范圍內(表7),說明該方法的準確性較高。
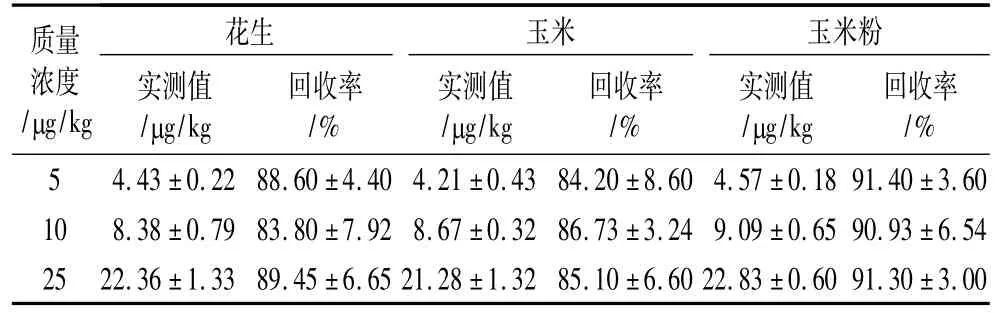
表7 樣品加標回收試驗結果(平均值)
2.5 HPLC 比對試驗
添加 5、10、25 和 50 μg/kg OTA 的花生、玉米和玉米粉樣品分別采用ELISA和HPLC方法進行檢測。

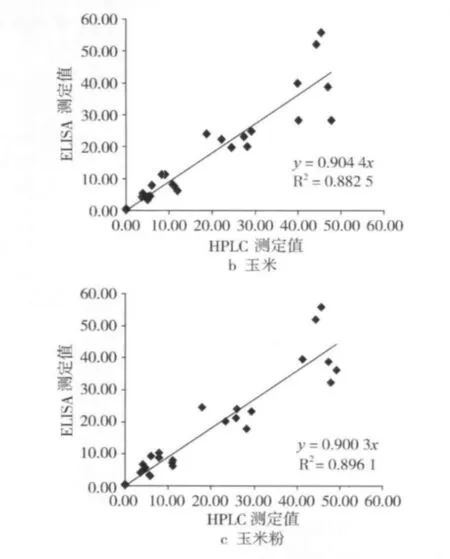
圖8 ELISA與HPLC方法檢測OTA含量的相關性
結果表明(圖8),花生、玉米和玉米粉樣品中2種檢測方法的相關系數(R2)分別為0.94、0.88與0.90,表明本研究建立的ELISA方法與HPLC方法具有較高的相符性,可用于谷物中OTA批量快速篩查。
3 結論
OTA屬于一種小分子半抗原,本身沒有免疫原性,必須與載體蛋白大分子連接才能產生完整的免疫應答。通過活潑酯法,利用OTA上的—COOH將之與載體蛋白BSA連接,后免疫兔子獲得了高效價和高特異性多克隆抗體,并在此基礎上研制了OTA cd-ELISA檢測試劑盒。該試劑盒IC50為1.09 ng/mL,IC15為0.08 ng/mL;與赭曲霉毒素B、C的交叉反應率分別為6.28%和0.16%,而與其他毒素未見有交叉反應;在花生、玉米及玉米粉中的檢出低限分別為1.71,1.26 和1.85 μg/kg,平均回收率在 83.80%~91.40%;與HPLC檢測方法具有較高的相符性;檢測時間短,只需20 min;顯示出較好的特異性、靈敏度、準確性、及簡便快速等優點,可滿足花生、玉米及玉米粉中OTA的免疫快速檢測。
[1]RatolaN,Martins L,Alves A.Ochratoxin A in wines- assessing global uncertainty associated with the results[J].Analytica Chimica Acta,2004,513(1):319 -324
[2]舒黛廉,王玨.乳及乳制品中抗生素殘留微生物檢測法研究進展及其控制措施[J].中國畜牧獸醫,2008,35(1):74-77
[3]高翔,李梅,張立實.赭曲霉毒素A的毒性研究進展[J].國外醫學:衛生學分冊,2005,32(1):51-55
[4]European Commission.(EC)No 1881/2006 setting maximum levels for certain contaminants in foodstuffs[s].Official Journal of the European Union,2006 -12 -20
[5]GB 2715—2005糧食衛生標準[S]
[6]Santos E A,Vargas E A.Immunoaffinity column clean - up and thin layer chromatography for determination of ochratoxin A in green coffee[J].Food Additives and Contaminants,2002,19(5):447 -458
[7]Pittet A,Royer D.Rapid,low cost thin -layer chromatographic screening method for the detection of ochratoxin A in green coffee at a control level of 10 μg/kg[J].Journal of Agricultural and Food Chmistry,2002,50(2):243 -247
[8]Meritxell V,Ivan A,Francesc B P,et al.Two - dimensional thin-layer chromatographic method for the analysis of ochratoxin A in green coffee[J].Journal of Food Protection.2005,68(9):1920-1922
[9]Tessini C,Mardones C,Baer V D,et al.Alternatives for sample pre-treatment and HPLC determination of ochratoxin A in red wine using fluorescence detection[J].Analytica Chimica Acta,2010,660(1 -2):119 -126
[10]褚慶華,郭德華,王敏,等.油料和食用油中真菌毒素快速測定方法的研究[J].中國糧油學報,2006,21(2):114 -120
[11]Vega M,Munoz K,Sepúlveda C,et al.Solid - phase extraction and HPLC determination of Ochratoxin A in cereals products on Chilean market[J].Food Control,2009,20(7):631-634
[12]Lattanzio V M T,Solfrizzo M,Powers S,et al.Simultaneous determination of aflatoxins,ochratoxin A and Fusarium toxins in maize by liquid chromatography/tandem mass spectrometry after multitoxin immunoaffinity cleanup[J].Rapid Communications in Mass Spectrometry,2007,21(20):3253 -3261
[13]Vatinno R,Vuckovic D,Zambonin C G,et al.Automated high-throughput method using solid-phase microextraction-liquid chromatography-tandem mass spectrometry for the determination of ochratoxin A in human urine[J].Journal of Chromatography A,2008,1201(2):215 -221
[14]Fujii S,Ribeiro R M R,dos Santos Scholz M B ,et al.Reliable indirect competitive ELISA used for a survey of ochratoxin A in green coffee from the North of Paraná State,Brazil[J].Food Additives and Contaminants,2006,23(9):902 -909
[15]Flajs D,Domijan A M,Ivic'B,et al.ELISA and HPLC analysis of ochratoxin A in red wines of Croatia[J].Food Control,2009,20(6):590 -592
[16]Klaric'M S,Cvetnic'Z,Pepeljnjak S,et al.Co - occurrence of aflatoxins,ochratoxin A,fumonisins,and zearalenone in cereals and feed,determined by competitive direct enzyme -linked immunosorbent assay and thin-layer chromatography[J].Archives of Industrial Hygiene and Toxicology,2009,60(4):427-434
[17]Chun H S,Choi E H,Chang H J,et al.A fluorescence polarization immunoassay for the detection of zearalenone in corn[J].Analytica Chimica Acta,2009,639(1 -2):83 -89
[18]王松雪,李愛科,謝剛,等.糧食飼料資源霉菌毒素檢測技術[J].中國糧油學報,2006,21(3):415-418
[19]M?rtlbauer E,Gareis M,Terplan G.Enzyme immunoassay for the macrocyclic trichothecene roridin A:production,properties,and use of rabbit antibodies[J].Applied and Environment Microbiology,1988,54(1):225 -230
[20]Xiao H,Clarke J R,Marquardt R R,et al.Improved methods for conjugating selected mycotoxins to carrier proteins and dextran for immunoassays[J].Journal of Agricultural and Food Chemistry,1995,43(8):2092 -2097
[21]王海艷,袁飛,吳亞君,等.食品中過敏原胡桃蛋白間接競爭ELISA檢測方法研究[J].中國食品學報,2010,10(5):217-222
[22]Aboul-Enein H Y,Kutluk ? B,Altiokka G,et al.A modified HPLC method for the determination of ochratoxin A by fluorescence detection[J].Biomedical Chromatography,2002,16(7):470 -474
[23]王向紅,劉濤,王忠斌,等.高效液相色譜法同時測定谷物中的赭曲霉毒素和玉米赤霉烯酮[J].中國食品學報,2008,8(5):148 -152.
Development of a Direct Competitive ELISA
Kit for Rapid Detection of Ochratoxin A
Li Mujie1Xi Xi1Zhang Mingzhou1,2Chen Zonglun2Wang Weifen1
(Zhejiang Provincial Key Laboratory of Bio - metrology,Inspection and Quarantine College of Life Science,China Jiliang University1,Hangzhou 310018)
(DNA Scitech Co.,Ltd.2,Hangzhou 310013)
A direct competitive enzyme-linked immunosorbent assay(cd-ELISA)kit based on ochratoxin A(OTA)polyclonal antibodies was developed.In the 0 ~10 ng/mL range,the OTA ELISA kit had a good sensitivity with an IC50of 1.09 ng/mL and IC15of 0.08 ng/mL,showed 6.28%,0.16%cross- reactivitives to ochratoxin B and C respectively,and scarcely showed cross- reactivity to others.The mean variation coefficient of intra - assay and inner-assay were 2.21%and 2.79%.The limit of detection in peanut,maize and maize flour samples were 1.71,1.26 and 1.85 μg/kg,respectively,and spiked recovery ranged from 83.80%to 91.40%.Compared with HPLC,the correlation coefficients(R2)were 0.94、0.88 and 0.90 for peanut,maize and maize flour,respectively.And the detection time of the kit is 20 minutes.It is indicated that the OTA ELISA kit in this paper was applicable to rapid preliminary screening of OTA.
ochratoxin A,polyclonal antibody,cd-ELISA
TS207.3
A
1003-0174(2012)09-0116-08
浙江省重大科技專項(2006C12102),杭州市重大科技創新專項(20083212A25),浙江省重點科技創新團隊(2010R50028),浙江省科技成果轉化項目(2011E 61018)
2011-12-20
李沐潔,女,1986年出生,碩士,生物化學與分子生物學
張明洲,男,1970年出生,教授,碩士生導師,食品質量與安全

