谷胱甘肽巰基轉移酶基因多態性在原發性肝細胞癌人群中的研究
唐耘天,李辛平,劉天奇,楊建榮,羅建強,梁中驍
(廣西壯族自治區人民醫院 肝膽外科,廣西 南寧530021)
原發性肝細胞癌(Hepatocellular carcinoma,HCC)是我國男性常見的惡性腫瘤,發病率呈逐年上升的趨勢[1]。流行病學研究表明:黃曲霉毒素B1(Aflatoxin B1,AFB1)暴露和乙型肝炎病毒(Hepatitis B virus,HBV)感染是肝癌發生的高危因素。隨著人類基因組計劃的進展,肝癌與基因多態性的研究日益受到重視。AFB1的主要代謝解毒酶-谷胱 甘 肽 巰 基 轉 移 酶 (Glutathione S-transferase,GSTs),其基因多態性與腫瘤的關系是目前研究的熱點。本研究選取GSTs家族中的GSTM1、GSTT1、GST01、GSTP1,采 用 Multiplex-PCR 和PCR-RFLP技術檢測肝癌患者和健康對照者的GSTM1、GSTT1缺失情況,及 GST01-Ala140Asp、GSTP1-Ile105Val位點的多態性,并加以比較研究,探尋GSTs基因多態性與肝癌發生發展的關系。
1 材料與方法
1.1 研究對象 肝癌組為本院2008年10月至2010年10月住院已經病理證實的男性原發性肝細胞癌患者150例,年齡23-62歲。對照組為男性體檢健康者150例年齡25-65歲。兩組年齡分布具有可比性(P>0.05)。
1.2 試劑和儀器 DNA抽提試劑盒(Qiagen公司)、PCR引物(上海捷瑞生物工程有限公司)、限制性內切酶(New England Biolabs公司)、聚合酶鏈式反應(PCR)儀(MJ Research公司)。
1.3 實驗方法 采EDTA抗凝靜脈血,離心分層獲取中間層多核細胞。GSTM1和GSTT1采用多重PCR(Multiplex-PCR)檢驗,以β-珠蛋白(β-globin,268bp)為參照基因;GST01-Ala140Asp、GSTP1-Ile105Val位點采用 PCR-RFLP技術。受檢各基因各位點檢測參考文獻方法[2-4]。PCR基本反應條件為95℃預變性2min、94℃變性15s、62℃退火30s、72℃延伸30s,共約35個循環,最后72℃延伸5min(各基因位點略有不同)。PCR反應體系容積為25μl:0.25μl Platinum Taq polymerase(1.25μ)、2.5μl 10×PCR buffer、0.8μl MgCl2(50mM)、0.5 μl deoxynucleotide triphosphate(dNTPs,10mM)、0.5μl引物(10pmol/μl)、1μl基因組DNA(50ng)、19.45μl去離子水。PCR產物及酶切產物行瓊脂糖凝膠電泳,根據不同條帶大小(bp)判定表型:GSTM1和 GSTT1(M1:215、268 bp;T1:268、480bp;M1T1:215、268、480bp;M1T1-null:268bp);GST01-Ala140Asp(Ala/Ala:127bp;Asp/Ala:68、59、127bp;Asp/Asp:68、59 bp);GSTP1-Ile105Val(Ile/Ile:176bp;Ile/Val:85、91、176bp;Val/Val:85、91bp)
1.3 統計學方法 采用SAS9.1統計軟件分析。各基因多態性在兩組間的差異采用χ2檢驗。P≤0.05為差異有統計學意義。
2 結果
2.1 GSTs基因多態性結果分析 以GSTs基因位點多態性型別進行兩組比較,顯示各基因位點多態性在病例和對照兩組間的差異無顯著性,P>0.05;將基因多態型別中的雜合子與突變型合并后與野生型比較,多態性的比例在病例和對照兩組間的差異也無顯著性,P>0.05;見表1。
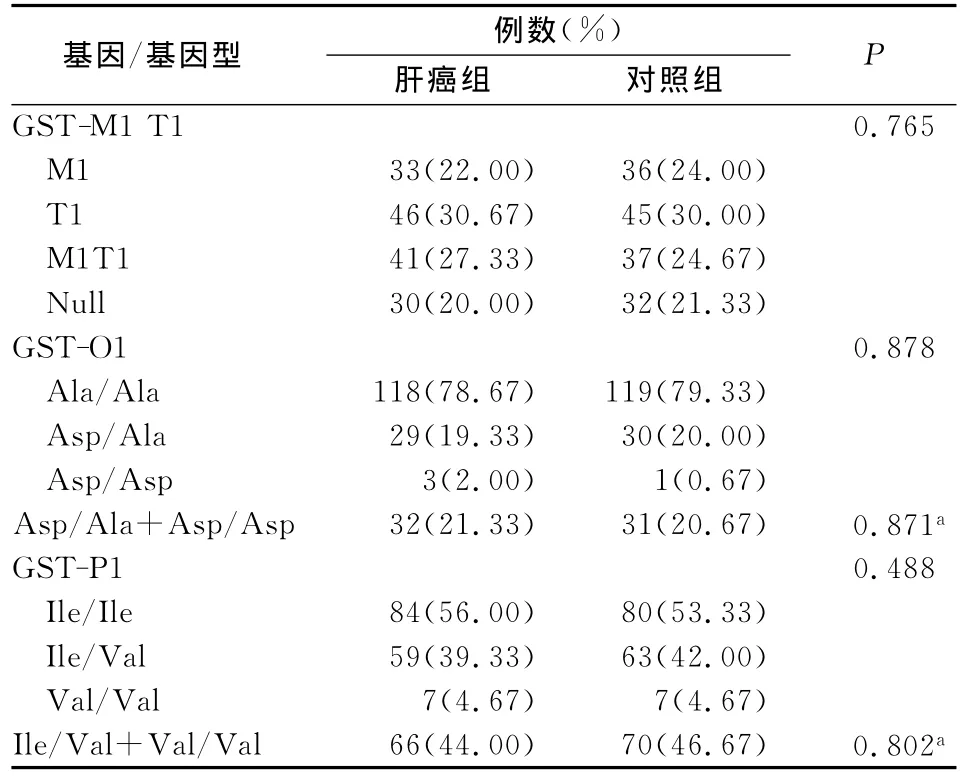
表1 GSTs基因多態性在兩組研究對象中的比較
3 討論
黃曲霉毒素是一種真菌代謝產物,已報道的有:B1、B2、G1、G2、M1、M2六型,以 AFB1毒性最強。由黃曲霉菌與寄生曲霉菌產生[5]。研究顯示,黃曲霉毒素在代謝之前是無致癌性,攝入體內后經第一階段代謝酶代謝后的產物可能是其致癌作用的關鍵[5],如:黃曲霉毒素 M1(AFM1)、黃曲霉毒素 Q1(AFQ1)、AFB1環氧化物(AFBO)等。這些親電子的代謝產物與細胞內大分子物質,如脫氧核糖核酸(DNA)、核糖核酸(RNA)、蛋白質結合并造成損害。同時,體內的第二階段代謝酶,特別是谷胱甘肽轉移酶(glutathione S-transferase,GST),可以解毒代謝第一階段的毒性代謝產物,最終形成不同的終末物質從尿液中排出。
GST基因家族已報道有7個亞族,其代謝解毒的主要機制為:將還原性谷胱甘肽(glutathione,GSH)與體內疏水性的毒性代謝產物結合,增加其親水性以利于機體的代謝排出。在AFB1的代謝產物中,GSTs主要針對的是具有氧化活性的AFBO,其與細胞內的大分子物質形成共價加合物,特別是作用于DNA后形成的8-羥基脫氧鳥苷(8-OHdG),被認為是AFB1誘導HCC發生的點突變起源[6]。GST基因家族存在多態性,可以影響GST酶的解毒代謝活性,從而導致不同個體間黃曲霉毒素代謝水平的差異,其中GSTM1和GSTT1可表現為特殊的缺失型或空白型(GSTM1-null、GSTT1-null),具有此類基因型的個體在組織中不能表達GSTM1和GSTT1酶,因此也決定不同個體之間毒性物質代謝水平的高低,最終導致不同個體在腫瘤發生上的差異性。但是,已發表的研究結果對GSTM1和GSTT1缺失型是否為肝癌的危險因素仍存在爭議[7]。不同種族和地區之間GSTM1和GSTTl基因缺失率波動范圍也較大,在亞洲人群中GSTM1和GSTT1的缺失比例范圍分別為17-75%和16-64%[7]。而本研究的實驗對象中GSTM1-null和GSTT1-null的比例分別為病例組42.00%和50.67%;對照組為45.33%和51.33%。在GST01-Ala140Asp和GSTP1-Ile105Val基因位點中,變異等位基因的出現的頻率分別為21.00%和45.33%。在肝癌病例和對照組間基因多態性類型出現頻率基本一致,無顯著性差別。這些結果與既往的廣西和國內人群的結果接近或一致[8-10],但是并沒有反映出GSTM1、GSTT1的缺失,及 GST01-Ala140Asp、GSTP1-Ile105Val位點的多態性在肝癌病例人群和健康人群間的差別。
我們認為這樣的結果與目前腫瘤發生研究的主流共識是相一致的,即腫瘤的發生是由遺傳基因和環境因素共同作用的結果。遺傳基因只是其中的一部分,決定了個體是否具有腫瘤易感基因。而另一方面,環境中的多種致癌因素,如化學物質、物理因素、病毒等等都可作用于個體,并與內部的諸多因素相互作用,最終導致腫瘤的發生發展。另一方面,廣西還是一個相對比較落后和蔽塞的農業地區,人口流動相對較少、外來人口比率偏低、具有比較穩定的人口組成,這也是造成該地區人權基因多態性結果較為穩定的主要原因。綜上,廣西地區肝癌的高發生率可能與該地區人群的遺傳基因關系并不密切,而是與該地區人群的黃曲霉毒素高暴露率有關[11]。
[1]McGlynn KA,London WT.The global epidemiology of hepatocellular carcinoma:present and future[J].Clin Liver Dis,2011,15(2):223.
[2]Wang LD,Zheng S,Liu B,et al.CYP1A1,GSTs and mEH polymorphisms and susceptibility to esophageal carcinoma:study of population from a high-incidence area in north China[J].World J Gastroenterol,2003,9(7):1394.
[3]Yu L,Kalla K,Guthrie E,et al.Genetic variation in genes associated with arsenic metabolism:glutathione S-transferase omega 1-1and purine nucleoside phosphorylase polymorphisms in European and indigenous Americans[J].Environ Health Perspect,2003,111(11):1421.
[4]Chan QK,Khoo US,Ngan HY,et al.Single nucleotide polymorphism of pi-class glutathione s-transferase and susceptibility to endometrial carcinoma[J].Clin Cancer Res,2005,11(8):2981.
[5]Wogan GN,Hecht SS,Felton JS,et al.Environmental and chemical carcinogenesis[J].Semin Cancer Biol,2004,14(6):473.
[6]Boysen G,Pachkowski BF,Nakamura J,et al.The formation and biological significance of N7-guanine adducts[J].Mutat Res,2009,678(2):76.
[7]Nie F,Chen Z,Cao C,et al.Absence of Association Between GSTM1and GSTT1Polymorphisms and Melanoma Susceptibility:A Meta-Analysis[J].DNA Cell Biol,2011,30(10):783.
[8]Long XD,Ma Y,Wei YP,et al.The polymorphisms of GSTM1,GSTT1,HYL1*2,and XRCC1,and aflatoxin B1-related hepatocellular carcinoma in Guangxi population,China[J].Hepatol Res,2006,36(1):48.
[9]Fu S,Wu J,Chen F,et al.Polymorphisms of Glutathione S-transferases Omega-1among ethnic populations in China[J].BMC Genet,2008,10(9):29.
[10]Zhong SL,Zhou SF,Chen X,et al.Relationship between genotype and enzyme activity of glutathione S-transferases M1and P1in Chinese[J].Eur J Pharm Sci,2006,28(1-2):77.
[11]唐耘天,黃天壬,王加生.黃曲霉毒素暴露和谷胱甘肽轉移酶基因多態性檢測在原發性肝癌高危人群中的研究[J].廣西醫科大學學報,2008,25(5):694.

