雷竹林存留有機覆蓋物高效降解菌株分離及產酶條件優化
可 曉,陳雙林,張小平,郭子武
(1.中國林業科學研究院 亞熱帶林業研究所,浙江 富陽,311400;2.四川農業大學 資源與環境學院,四川 雅安 625014)
雷竹Phyllostachys violascens林地有機材料(主要為礱糠、稻草、鋸木屑等)覆蓋竹筍早出技術的推廣應用始于20世紀90年代初,滿足了市場供應淡季對鮮筍的大量需求,顯著地提高了筍用竹林的經濟效益[1]。然而,長期連年覆蓋會導致雷竹林地土壤理化性質劣變,竹林地上和地下部分結構失衡[2-6],致使雷竹林大面積衰敗,如雷竹筍用竹主產區浙江省臨安市太湖源鎮超過1萬hm2雷竹林中重度、中度、輕度退化竹林所占比例分別達13.34%,26.66%和46.67%,未退化竹林僅占13.33%,重度退化竹林幾乎無經濟產出[7]。而存留于雷竹林土壤中短期內難以自然腐解且高碳氮比 (C/N),富含纖維素和木質素的有機覆蓋物,是導致林地土壤發生物理、化學和生物性劣變重要原因之一。因此,從維護林地覆蓋筍用竹林高效可持續經營目標出發,必須采取高效、無二次污染的林地存留有機覆蓋物促腐措施。目前,具有生物質材料降解活性的微生物已廣泛應用于高碳氮比材料的工業發酵(替代能源的生產)[8]、飼料生產[9]和秸稈還田土壤培肥[10]等方面,而對于筍用竹林存留有機覆蓋物降解微生物篩選、降解活性及產酶條件的相關研究尚未見有報道。本研究從長期堆放有機覆蓋物場所的不同腐解程度的稻草、礱糠及覆蓋雷竹林土壤中篩選培養具有高纖維素降解酶活性的微生物,并對其產酶條件進行優化,旨在為筍用竹林林地存留有機覆蓋物高效促腐制劑的研制提供前期理論基礎。
1 材料和方法
1.1 供試材料
供試材料采自浙江省臨安市太湖源鎮(30°24′N,119°32′E)雷竹林林地覆蓋的不同腐解程度的礱糠、稻草及覆蓋雷竹林土壤。礱糠、稻草采用多點取樣法,取混合樣品200.00 g,土壤采用五點取樣法,取0~10 cm土壤混合樣品500.00 g。樣品采集后放入無菌袋內,置于冰壺中帶回實驗室4℃保存。
對照菌株哈茨木霉(HC)Trichoderma harzianum,綠色木霉(LS)Trichoderma viride購自廣東省微生物研究所菌種保藏中心。
1.2 培養基
富集培養基(赫奇遜濾紙液體培養基):1 cm×6 cm新華定量濾紙、磷酸二氫鉀(KH2PO4)1.00 g,氯化鈉(NaCl) 0.10 g,硫酸錳(MgSO4°7H2O) 0.30 g,硝酸鈉(NaNO3) 2.50 g,氯化鐵(FeCl3) 0.01 g,氯化鈣(CaCl2) 0.10 g。水 1 000 mL,pH 7.2[11]。
初篩培養基(剛果紅羧甲基纖維素平板培養基):羧甲基纖維素鈉(CMC-Na)2.00 g,剛果紅0.40 g,硫酸銨[(NH4)2SO4]2.00 g,硫酸錳(MgSO4°7H2O) 0.50 g,磷酸二氫鉀(KH2PO4) 1.00 g,氯化鈉(NaCl)0.50 g,瓊脂20.00 g。水1 000 mL,自然pH值(不進行人為的調節)[12]。
復篩培養基(赫奇遜秸稈液體培養基):用稻草取代富集培養基中的濾紙。
1.3 菌株篩選
分別取腐爛的礱糠、稻草及雷竹林土壤樣品各10.00 g,加入裝有90.0 mL無菌水和玻璃珠的150.0 mL三角瓶中,180 r°min-1振蕩30 min使樣品充分分散,取懸濁液5.0 mL接種于45.0 mL富集培養基中,28℃下120 r°min-1振蕩培養2 d。再取培養液接種到新鮮無菌富集培養基中,反復培養3次。
取第3次富集培養液100 μL均勻涂布在剛果紅羧甲基纖維素平板培養基上,28℃下培養,挑取水解圈出現時間早,水解圈直徑與菌落直徑之比大的菌株進行純化并保存。將初篩獲得的菌株分別在馬鈴薯葡萄糖瓊脂(PDA)(真菌)、高氏一號(放線菌)培養基上活化,用直徑1 cm打孔器在菌落生長均勻處取菌塊接種于復篩培養基中,28℃下120 r°min-1振蕩培養5 d,測定發酵液中濾紙酶活力,篩選具有高纖維素酶活性的菌株。
1.4 濾紙酶(filter paper activity,FPA)活力測定
濾紙酶活力測定采用 3,5-二硝基水楊酸顯色法[13-16]。發酵液于 10 kg°min-1離心 10 min,取上清液即為粗酶液。將新華定量濾紙裁剪成1 cm×6 cm的小條,放入25.0 mL刻度試管中,加入1.0 mL檸檬酸-檸檬酸鈉緩沖液(pH 4.8)和稀釋酶液0.5 mL,50℃水浴中反應1 h,加入3.0 mL 3,5-二硝基水楊酸(DNS)試劑沸水浴5 min,定容到25.0 mL后測定540 nm波長吸光度,計算還原糖量,同時測定發酵液中的還原糖量,以酶解反應液中還原糖量與發酵液中還原糖量之差計算酶活力。實驗設3個重復。以1 h 1.0 mL原酶液催化底物(濾紙)轉化為1 μmol葡萄糖的酶量為1個酶活力單位(16.67 nkat)。
1.5 產酶條件優化
1.5.1 單因素實驗 采用赫奇遜液體培養基。選擇不同培養時間(1,2,3,4,5,6,7 d),pH(3.0,4.0,5.0,6.0,7.0,8.0,9.0,10.0),培養溫度(20,25,30,35,40℃),碳源[淀粉、 葡萄糖、 微晶纖維素粉、稻草秸稈粉、淀粉和微晶纖維素粉(m∶m=1∶1)和葡萄糖和微晶纖維素粉(m∶m=1∶1)],氮源(酵母膏、蛋白胨、牛肉膏、硫酸銨和尿素為氮源)及無機鹽(氯化鐵為0.01g°L-1,氯化鈣0.10 g°L-1,磷酸二氫鉀 1.00 g°L-1,硫酸錳 0.30 g°L-1和氯化鈉 0.10 g°L-1)進行單因素實驗,分別確定目標菌株的最佳產酶條件。
1.5.2 正交實驗 根據以上的各單因素實驗結果,對菌株產酶的最佳碳源、氮源及無機鹽進行正交實驗[L9(34)],確定目標菌株最佳培養條件。
2 結果與分析
2.1 有機覆蓋物高效降解菌株篩選
經過富集培養,從常年堆積的不同腐解程度的礱糠、稻草及覆蓋雷竹林土壤中初步篩選獲得38株在剛果紅羧甲基纖維素平板上能夠產生透明水解圈的菌株,再經反復篩選出透明水解圈出現時間早,水解圈直徑與菌落直徑比值(HC值)較大的菌株7株(表1),其中,真菌4株(分別編號為1.1,2.1,YQ1和YQ9),放線菌3株(分別編號為1.2,2.2和3.1)。

表1 菌株培養3 d透明水解圈與菌落直徑比值Table 1 HC values of 9 strains after 3 days cultivation
培養5 d后,從7個菌株濾紙酶活性分析表明:真菌1.1,2.1,YQ1酶活力極顯著地高于放線菌、真菌YQ9及對照菌株哈茨木霉(3.93×16.67 nkat)與綠色木霉(4.64×16.67 nkat),且以2.1菌株的濾紙酶活力最高,達10.80×16.67 nkat(圖1),確定菌株2.1為高效目標菌株。
2.2 菌株2.1生物學特性
從菌株2.1的菌落培養特征(表2)及顯微結構特征(圖2a)表明,菌株2.1分生孢子梗發生于基質,壁平滑,帚狀枝雙輪生,偶有3輪生或單輪生;梗基每輪2~3個,13.0~20.0 μm×3.2~3.7 μm,彼此通常較緊貼;瓶梗幼齡時呈現瓶狀至披針狀,充分成熟時近圓柱形,梗頸明顯,分生孢子橢圓形,4.5~5.5 μm×3.0~4.0 μm,壁平滑。依據2.1菌落形態(圖2b)及菌株顯微結構特征,查《中國真菌志》(青霉及其相關有性型屬)[17]、《真菌的形態和分類》[18]等相關資料可確定菌株2.1屬青霉屬Penicillium。
2.3 菌株2.1培養時間、起始酸堿度(pH值)和溫度條件優化
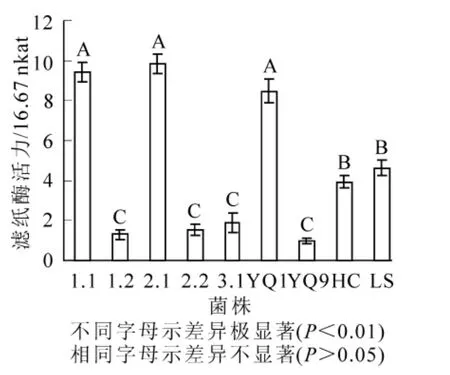
圖1 分離菌株的濾紙酶活力Figure 1 Filter paper activity of 9 strains
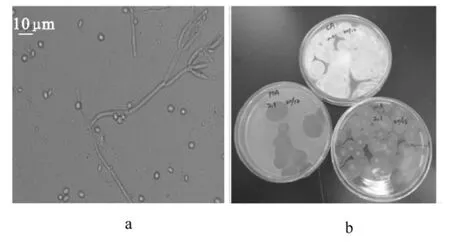
圖2 菌株2.1的菌落形態(a)及顯微結構(b)Figure 2 Colony morphology and microstructure of Strain 2.1

表2 菌株2.1菌落形態特征Table 2 The colony morphology of strain 2.1
2.3.1 培養時間 培養初期菌株2.1發酵液濾紙酶活力隨培養時間的延長緩慢升高,第1,2天發酵液濾紙酶活力分別為2.72×16.67 nkat,3.32×16.67 nkat,增幅僅為22.51%。第3天酶活力迅速提高,4.95×16.67 nkat,較第2天增加了49.01%。第3天以后,酶活力增加趨勢減緩,至第5天時發酵液酶活力達峰值(5.62×16.67 nkat),其后酶活力雖能維持在較高水平,但較第5天有所下降(圖3a)。說明菌株2.1產酶的最佳培養時間為5 d。
2.3.2 起始酸堿度(pH值) 菌株2.1發酵液濾紙酶活力隨起始酸堿度(pH值)的變化呈先升高后降低的趨勢(圖3b)。起始酸堿度為pH 3.0~5.0時,菌株酶活力緩慢上升,且較為平穩,當起始酸堿度為pH 5.0時,發酵液濾紙酶活力達到峰值(4.90×16.67 nkat),其后隨酸堿度(pH值)的升高酶活力緩慢降低,當起始酸堿度超過pH 8.0時,酶活力開始迅速下降,至起始酸堿度為pH 10.0時,發酵液濾紙酶活力僅為2.22×16.67 nkat,為峰值的45.31%。說明菌株2.1培養的最佳起始酸堿度為pH 5.0。
2.3.3 培養溫度 隨著培養溫度的升高,菌株2.1產酶能力呈先升高后降低的變化規律(圖3c)。在25~30℃區間內酶活力急劇升高,由2.36×16.67 nkat提高到3.67×16.67 nkat,增幅達55.51%,而后酶活力趨于平穩,當溫度35℃時,酶活力為3.83×16.67 nkat,其后酶活力略有降低,40℃時酶活力下降為3.68×16.67 nkat。雖然35和40℃時菌株2.1的酶活力均高于30℃的酶活力,但結合菌株培養及竹林生產實踐,確定30℃為菌株2.1的最佳培養溫度。

圖3 培養時間(a),起始pH值(b)和培養溫度(c)對菌株2.1濾紙酶活力的影響Figure 3 Effect of time,pH and temperature on FPA of Strain 2.1
2.4 培養基組合優化
2.4.1 碳源 菌株2.1在不同碳源的培養基中均能正常生長,但在不同碳源條件下酶活力存在較大差異(圖4a)。以葡萄糖、淀粉、纖維素為單一碳源時,發酵液濾紙酶活力分別為1.67×16.67 nkat,1.98×16.67 nkat和1.35×16.67 nkat。當用葡萄糖和纖維素(m∶m=1∶1)共同作為碳源時,發酵液濾紙酶活力達到3.08×16.67 nkat,分別比葡萄糖或纖維素作單一碳源時增加了84.43%和128.15%。淀粉與纖維素(m∶m=1∶1)共同作為碳源時,發酵液濾紙酶活力僅為0.56×16.67 nkat,遠低于任一單一碳源的處理。在供試碳源中,以稻草秸稈粉做碳源時發酵液中濾紙酶活力最高(5.03×16.67 nkat)。
2.4.2 氮源 菌株2.1在多種氮源條件下均能正常生長,在有機氮源條件下發酵液濾紙酶活力均遠高于無機氮源(圖4b)。其中,牛肉膏為氮源時菌株發酵液濾紙酶活力最高(5.95×16.67 nkat),其次是酵母粉(5.19×16.67 nkat),蛋白胨為氮源時發酵液酶活(4.59×16.67 nkat)略低于牛肉膏和酵母粉為氮源的處理。以硫酸銨和尿素為氮源時酶活力較低,分別為3.13×16.67 nkat和3.18×16.67 nkat,僅為牛肉膏為氮源時的52.60%和53.44%。
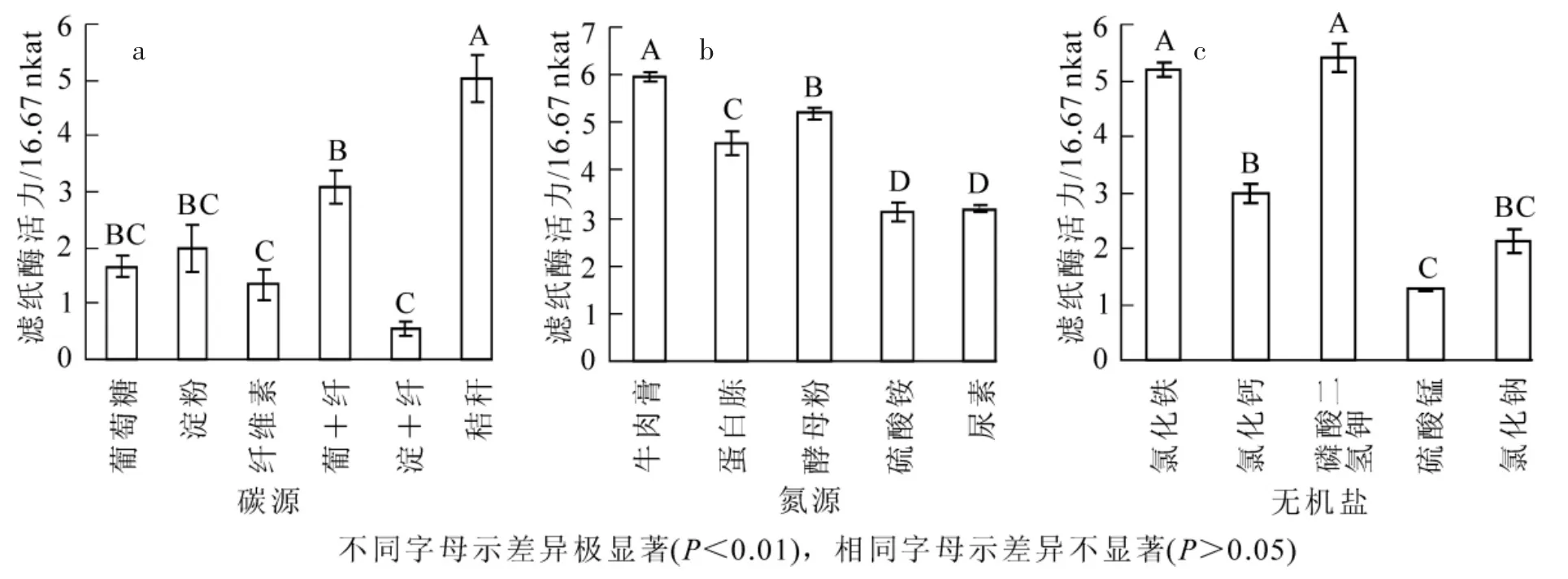
圖4 碳源(a),氮源(b)和無機鹽(c)對菌株2.1酶活力的影響Figure 4 Effect of C (a),N (b) source and inorganic salt(c) on FPA of Strain 2.1
2.4.3 無機鹽 菌株2.1發酵液濾紙酶活力以培養基中添加磷酸二氫鉀(KH2PO4)的最高(5.40×16.67 nkat),其次是添加氯化鐵(FeCl3)的處理(5.19×16.67 nkat)。這2種無機鹽處理均遠高于添加氯化鈣(CaCl2),氯化鈉(NaCl)和硫酸錳(MgSO4)的處理(分別為 2.98 × 16.67 nkat,2.13 × 16.67 nkat和 1.26×16.67 nkat,僅為最高酶活力的55.18%,39.44%和22.78%)(圖4c)。說明磷酸二氫鉀與氯化鐵對菌株2.1的酶活力影響較大。
2.4.4 培養基最佳組合 從表3的菌株2.1培養基碳源(稻草秸稈)、氮源(牛肉膏)及無機鹽(FeCl3),磷酸二氫鉀添加量正交實驗分析表明,9號培養基配方的菌株酶活力最高(11.19×16.67 nkat)。稻草秸稈和牛肉膏對菌株酶活力影響較大,極值分別為5.69和1.00,氯化鐵和磷酸二氫鉀對菌株酶活力影響較小,極值分別為0.41和0.27。稻草秸稈、牛肉膏、氯化鐵、磷酸二氫鉀均值最大水平分別為A3,B3,C1,D2。經方差分析,各因素對菌株2.1濾紙酶活力影響均達極顯著水平。表明菌株2.1產酶最適培養基組合為A3B3C1D2,即秸稈 25.00 g°L-1,牛肉膏 2.50 g°L-1,氯化鐵 0.01 g°L-1,磷酸二氫鉀 1.50 g°L-1。
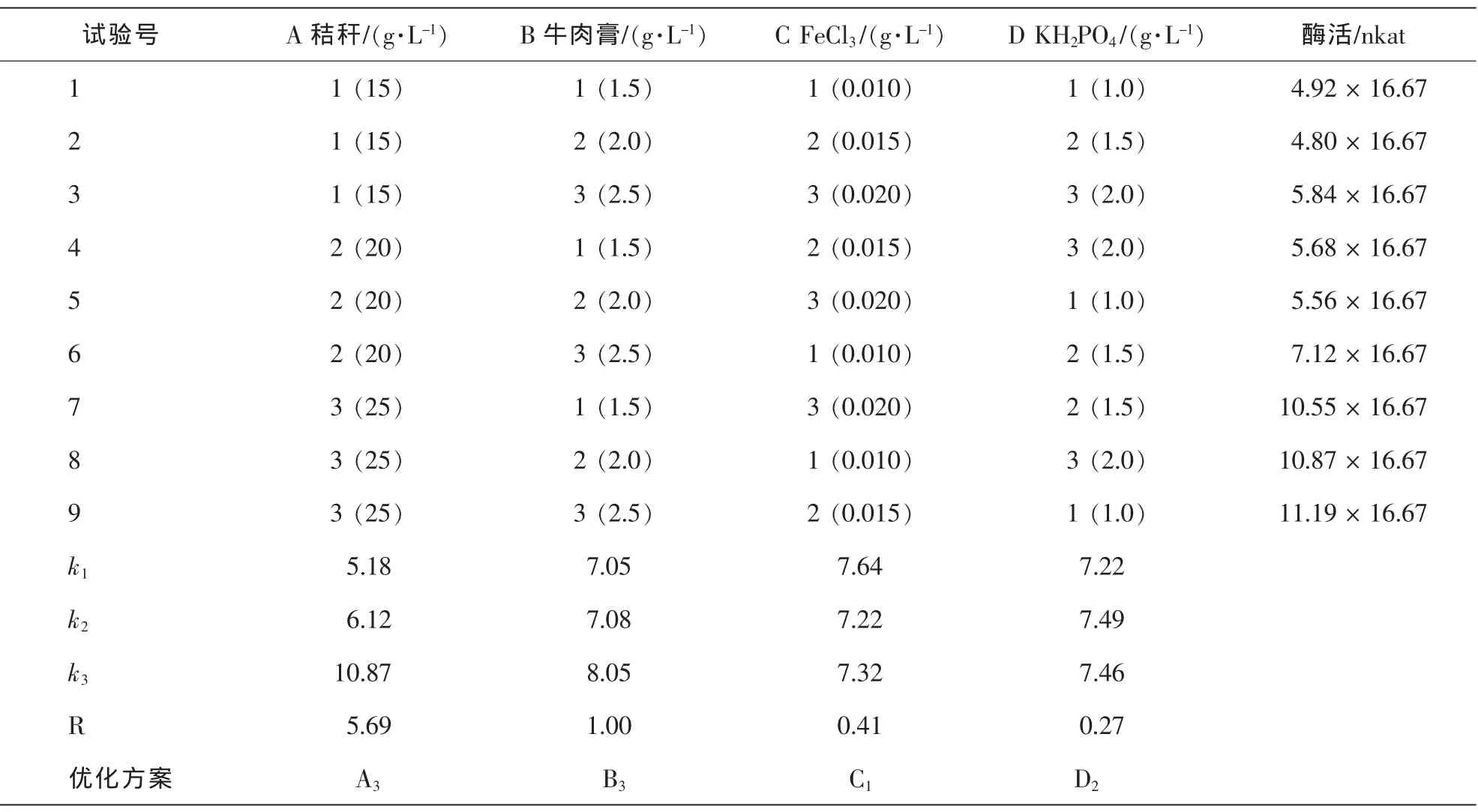
表3 L9(34)正交實驗設計及培養基組合菌株2.1酶活力Table 3 Design and results of L9(34) experiment and FPA of Strain 2.1
3 結論與討論
本研究通過稀釋涂平板法和富集培養法,從雷竹林地覆蓋材料礱糠、稻草及覆蓋雷竹林土壤中初步篩選得到了38個對林地有機覆蓋物具有分解活性的菌株,經反復篩選得7株在剛果紅羧甲基纖維素培養基上水解圈直徑較大,且出現時間早的菌株(真菌4株,放線菌3株),其中,菌株1.1,2.1,YQ1在僅有羧甲基纖維素為唯一碳源的剛果紅羧甲基纖維素平板上生長旺盛,濾紙酶活力較高,而且以菌株2.1酶活力最高,遠高于對照的綠色木霉和哈茨木霉。由于濾紙是聚合度和結晶度都居 “中等”的纖維性材料,濾紙酶活綜合反映了纖維素酶系統中3類酶的綜合效果[19]。因此,可以推斷菌株2.1可能具有較全面的酶系,將其定為目標菌株。經菌落培養特征和顯微結構特征觀察,菌株2.1屬青霉屬。
隨培養時間的延長,菌株2.1濾紙酶活呈先升高而后降低的趨勢,培養5 d后酶活力最高。菌株2.1在起始酸堿度為pH 3.0~5.0范圍內濾紙酶活較高,酸堿度超過pH 5.0后濾紙酶活力開始下降,這與普遍認為的酸性條件有利于真菌產纖維素酶的結論一致[16]。浙江省的筍用竹林土壤大多為紅壤或黃紅壤、黃壤,呈酸性[20],適宜菌株2.1的產酶潛力發揮。溫度對微生物生長發育有著重要影響,菌株2.1在30℃左右時產酶活力較高,而浙江省雷竹主栽區夏季最高氣溫40℃左右,菌株2.1適合浙江省雷竹林生境,能夠應用于竹林存留有機覆蓋物的生物降解。氮、碳及無機鹽均為降解菌株生長的必需養分因子,菌株2.1的最佳氮源為牛肉膏,添加量為2.50 g°L-1,最佳碳源為稻草秸稈,添加量為25.00 g°L-1,對菌株產酶活性有較大影響的無機鹽為氯化鐵和磷酸二氫鉀,添加量分別為0.01 g°L-1和1.50 g°L-1。
[1]方偉,何鈞潮,盧學可,等.雷竹早產高效栽培技術[J].浙江林學院學報,1994,11(2):121-128.FANG Wei,HE Junchao,LU Xueke,et al.Cultivation techniques of early shooting and high yielding for Lei bamboo sprout[J].J Zhejiang For Coll,1994,11 (2): 121-128.
[2]余樹全,姜春前,周國模,等.雷竹林生態系統健康的研究[J].北京林業大學學報,2003,25(5):15-19.YU Shuquan,JIANG Chunqian,ZHOU Guomo,et al.Study on Phyllostachys praecox forest ecosystem health [J].J Beijing For Univ,2003,25 (5): 15-19.
[3]胡超宗,金愛武,鄭建新.雷竹地下鞭的系統結構[J].浙江林學院學報,1994,11(3):264-268.HU Chaozong,JIN Aiwu,ZHENG Jianxin.Composition of Lei bamboo rhizomatic system [J].J Zhejiang For Coll,1994,11 (3): 264-268.
[4]何鈞潮,方偉,盧學可,等.雷竹雙季豐產高效筍用林的地下結構[J].浙江林學院學報,1995,12(3):247-252.HE Junchao,FANG Wei,LU Xueke,et al.Rhizome structure of Lei bamboo shoot-stand with high yield and good benefit[J].J Zhejiang For Coll,1995,12 (3): 247-252.
[5]金愛武,周國模,鄭炳松,等.覆蓋保護地栽培對雷竹地下鞭的影響[J].竹子研究匯刊,1998,17(4):36-39.JIN Aiwu,ZHOU Guomo,ZHENG Bingsong,et al.An effect of cultivation in mulched and protected Phyllostachys praecox plantations on its rhizome [J].J Bamboo Res,1998,17 (4): 36-39.
[6]張卓文,湯景明,熊艷平,等.雷竹引種后地下鞭生長規律研究[J].華中農業大學學報,2001,20(1):77-80.ZHANG Zhuowen,TANG Jingming,XIONG Yanping,et al.Studies on the bamboo rhizome growth after introduction of Phyllostachys praecox f.preveynalis [J].J Huazhong Agric Univ,2001,20 (1): 77-80.
[7]劉麗,陳雙林,李艷紅,等.基于林分結構和竹筍產量的有機材料覆蓋雷竹林退化程度評價[J].浙江林學院學報,2010,27 (1): 15-21.LIU Li,CHEN Shuanglin,LI Yanhong,et al.Stand structure and bamboo shoot number production based assessment of degradation degree of Phyllostachys praecox covered with organic materials [J].J Zhejiang For Coll,2010,27 (1):15-21.
[8]奚立民,曹樹,柯中爐.木質纖維素類生物質制備燃料乙醇的微生物研究進展[J].化工進展,2009,28(11):2003-2008.XI Limin,CAO Shu,KE Zhonglu.Research progress in microorganisms for the conversion of lignocellulosic biomass to fuel ethanol[J].Chem Ind Eng Prog,2009,28 (11): 2003-2008.
[9]刁治民,張雄偉,吳保鋒,等.微生物纖維素酶在飼料工業中的生產現狀及應用[J].青海草業,2006,15(3):15-20.DIAO Zhimin,ZHANG Xiongwei,WU Baofeng,et al.The research on the productive status and applied of microbial cellulose [J].Qinghai Pratac,2006,15 (3): 15-20.
[10]肖春玲,徐常新.微生物纖維素酶的應用研究[J].微生物學雜志,2002,22(2):33-35.XIAO Chunling,XU Changxin.Application study on microbial cellulose [J].J Microbiol,2002,22 (2): 33-35.
[11]湛方棟,何永美,陳建軍,等.3種培養基分離高溫纖維素分解菌及其酶活測定[J].安徽農業科學,2008,36(15):6171-6172,6232.ZHAN Fangdong,HE Yongmei,CHEN Jianjun,et al.Study on the isolation of thermophilic cellulolytic bacteria by using 3 kinds of medium and the determination of its enzyme activity [J].J Anhui Agric Sci,2008,36 (15):6171-6172,6232.
[12]張宇昊,王頡,張偉,等.一種改進的纖維素分解菌鑒別培養基[J].纖維素科學與技術,2004,12(1):33-36.ZHANG Yuhao,WANG Jie,ZHANG Wei,et al.An improved differential medium for cellulose decomposing microorganisms [J].J Cellul Sci Technol,2004,12 (1): 33-36.
[14]唐冰,夏秋瑜,李從發,等.NAG含量測定中常見的3種DNS試劑使用效果比較研究[J].熱帶農業科學,2006,26 (2): 33-35.TANG Bing,XIA Qiuyu,LI Congfa,et al.Comparison of three DNS reagents in determination of N-acetylglucosamine [J].Chin J Trop Agric,2006,26 (2): 33-35.
[15]SHARROCK K R.Cellulase assay methods: a review [J].Biochem Biophys Methods,1988,17 (2): 81-105.
[16]姜心,陳偉,周波,等.纖維素酶活測定影響因素的研究[J].食品工業科技,2010,31(5):65-68.JIANG Xin,CHEN Wei,ZHOU Bo,et al.Study on impact factors of determination of cellulase activity [J].Sci Technol Food Ind,2010,31 (5): 65-68.
[17]孔華忠.中國真菌志:青霉屬及其相關有性型屬[M].北京:科學出版社,2007.
[18]戴芳瀾.真菌的形態和分類[M].北京:科學出版社,1987.
[19]龐良偉.纖維素分解菌的混合培養及互生特性研究[D].成都:四川大學,2003.PANG Liangwei.The Study of Mixed Culture and the Mutualsitic Characteristics of Cellulolytic Strains [D].Chengdu:Sichuan University,2003.
[20]孫曉,莊舜堯,劉國群,等.集約經營下雷竹林土壤酸化的初步研究[J].土壤通報,2010,14(6):1339-1343.SUN Xiao,ZHUANG Shunyao,LIU Guoquan,et al.A preliminary study of soil acidification under Lei bamboo plantation with intensive management[J].Chin J Soil Sci,2010,14 (6): 1339-1343.

