體腔熱灌注化療治療惡性胸(腹)水的臨床觀察
李克愛 郝仲芳 劉金婷
惡性胸(腹)水是晚期惡性腫瘤常見的并發癥,嚴重地影響了患者的生活質量和生存期,如不及時采取相應的治療措施,病情將迅速惡化而導致死亡。因此,如何有效、迅速地控制胸(腹)水的生長成為臨床醫生關注的焦點。我院處于農村地區,多數惡性腫瘤患者發現時已處于晚期,且因經濟及體質狀況等多方面原因,患者及其家屬多不愿意接受經靜脈全身化療。我科對2010年2月—8月收治的惡性胸(腹)水患者58例(治療組)利用體腔熱灌注儀進行胸(腹)腔局部熱灌注化療取得了滿意的效果,其治療有效率較以往單純行體腔內局部灌注化療明顯提高,現報告如下。
1 資料與方法
1.1 一般資料 治療組58例,年齡38~79歲。對照組為我科自2009年6月—2010年2月收治的晚期惡性腫瘤合并惡性胸(腹)水患者58例,年齡29~78歲。所有患者治療前均經B超、CT證實有中等量以上的胸(腹)水,且經病理學及胸(腹)水生化證實為惡性胸(腹)水。治療前血常規及肝、腎功能檢查均正常,預計生存期在3個月以上,治療前近1個月未行靜脈化療及放射治療。2組一般資料比較見表1。
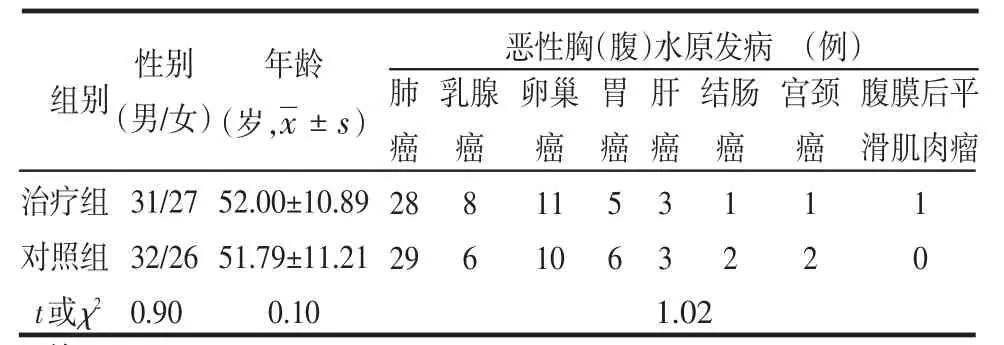
Table 1 Comparison of general situation between two groups表1 2組間一般情況比較
1.2 治療方法 根據患者的一般狀況、原發腫瘤對藥物的敏感性等選擇合適的化療藥物,通常為順鉑60~100 mg或羥基喜樹堿20~40 mg。以超聲定位點為穿刺點,在無菌技術下行中心靜脈導管(14號)體腔置管,依據患者胸(腹)水的量及耐受情況在灌注前適當引流胸(腹)水。治療組將化療藥物的2/3用量配制于2 000~3 000 mL的無菌生理鹽水中,并注入體腔熱灌注化療專用治療袋內,抽盡袋內空氣,同時注入鹽酸利多卡因0.1 g及地塞米松5 mg。然后將治療袋連接于體腔熱灌注治療儀(珠海和佳醫療設備公司生產的體腔熱灌注儀)內,開始對藥液進行加熱,設定藥液溫度上限為48℃,灌注溫度上限為45℃,灌注速度為150~300 mL/min,抽取速度為150~200 mL/min,治療時間設定為30~40 min。待藥液加熱至45℃~48℃后,經留置引流管進行循環灌注,通過治療設備的加溫及控溫系統保持灌注藥液的溫度恒定在43℃~45℃,每次灌注800~1 000 mL,灌注完畢,囑患者變換體位,以使藥液在胸(腹)腔內充分接觸,10~15 min后開始回抽,每次盡量將胸(腹)腔內液體抽盡。依據患者的耐受情況如此循環3~5次,總治療時間約為1 h。最后將剩余的1/3化療藥+生理鹽水100 mL注入胸(腹)腔內,以提高局部化療藥物濃度,使化療藥物與腫瘤細胞充分接觸,并口服抗生素3 d以預防感染。對照組將所選化療藥物配制于45℃的無菌生理鹽水(胸腔為50 mL,腹腔為1 000~2 000 mL)中,沿體腔留置引流管快速注入胸(腹)腔內,并囑患者每15 min變換體位1次,至少10次。治療結束后,2組均預防性應用止吐藥物,并適當予以補液、水化、利尿,每周監測血常規及肝腎功能,3周后重復治療,2周期后評定療效。
1.3 療效評定標準 參照Millar方案加以改進。完全緩解(CR):胸、腹水完全消失,持續1個月以上。部分緩解(PR):胸、腹水降低一個量級,如從大量減至中量或中量減至少量,持續1個月以上。好轉(MR):胸、腹水在同一個量級內減少,持續1個月以上。穩定(SD):胸、腹水在同一個量級內維持原水平,持續1個月以上。進展(PD):胸、腹水較原水平增加。CR+PR+MR為總有效率。不良反應按WHO抗癌藥物不良反應分度標準分為Ⅰ~Ⅳ度。
1.4 統計學方法 用SPSS 13.0軟件統計,計量資料以±s表示,行t檢驗,計數資料以例(%)表示,行χ2檢驗。以P<0.05為差異有統計學意義。
2 結果
2.1 治療效果 治療組有效率明顯高于對照組,差異有統計學意義(χ2=8.62,P<0.01),見表2。
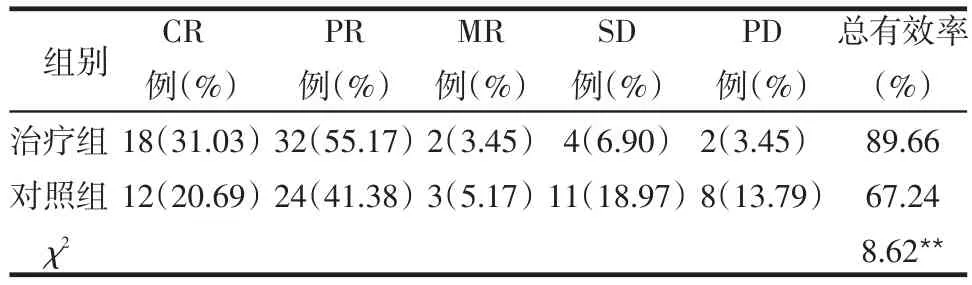
Table 2 Comparison of effectiveness between treatment group and control group表2 治療組與對照組療效比較 (n=58)
2.2 不良反應 2組均有輕度胃腸道反應發生,主要為惡心、呃逆、嘔吐和胃納下降及腹瀉、便秘等癥狀。其次為骨髓抑制。2組均無Ⅲ度以上胃腸道反應和骨髓抑制發生,亦無感染、腸粘連、腸梗阻、化學性腹膜炎等嚴重并發癥發生。2組間不良反應比較差異無統計學意義,見表3。
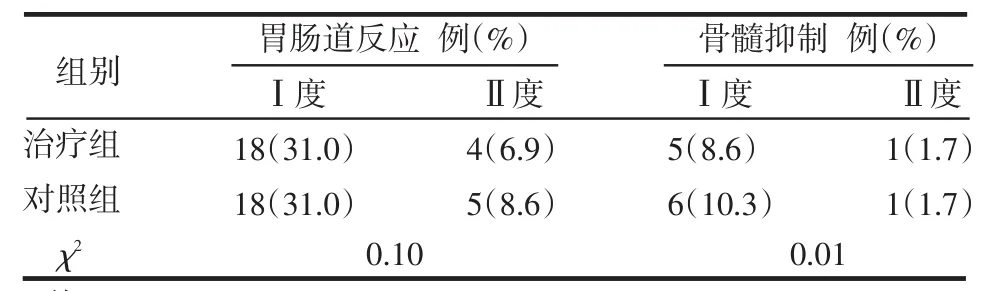
Table 3 Comparison of adverse reactions between two groups表3 2組不良反應比較 (n=58)
3 討論
惡性胸(腹)水的出現常常是病情進展或復發的結果,嚴重地影響了患者的生存質量和生存期,以往單純的穿刺排液或行閉式引流術可立即減輕壓迫癥狀,但反復大量排液使機體丟失大量蛋白質等營養物質,從而導致病情迅速惡化。有學者采用體腔內熱療或化療來治療惡性胸腹水,取得了一定的療效,但單純局部熱療或化療都有一定的局限性,在機體耐受的限度下,均難以徹底殺滅腫瘤細胞。體腔熱灌注化療是利用熱效應及區域性化療的協同增效作用,來發揮對腫瘤細胞的殺傷效應,其作用機制[1]如下:(1)通過熱直接殺滅癌細胞。(2)增強某些化療藥物的腫瘤滲透性和細胞毒性。(3)產生熱休克蛋白誘發機體的特異性免疫,活化自然殺傷細胞(NK),活化樹突狀細胞(DC),促進抗原呈遞抑制腫瘤轉移。(4)將滯留在體腔內的癌細胞沖出體外。
本組58例晚期惡性胸(腹)水患者經體腔內熱灌注化療,取得了令人滿意的療效,總有效率達89.66%,較以往單純行體腔內局部灌注化療提高22.42%。筆者認為成功的關鍵在于保持治療藥液相對恒定的溫度及有效的治療時間。研究表明,42℃~43℃的熱效應能使癌細胞染色體破壞,溶酶體釋放,直接破壞腫瘤細胞,同時增強細胞膜通透性,有利于化療藥物的吸收與滲透,并能增強化療藥物如鉑類、蒽環類的細胞毒化作用,對微小轉移灶則利用其腫瘤組織反射調節散熱能力差,使腫瘤血管痙攣,導致微循環不可逆損害[2-3]。另有試驗表明,腫瘤組織在43℃高溫持續1 h即出現不可逆損傷[4],而正常組織能長時間耐受42℃~43℃的高熱。實際操作中限定時間容易做到,而由于室溫、呼吸運動、心臟搏動和血液循環等散熱因素的影響,要把體腔內治療藥液溫度穩定在治療溫閾內是很困難的。筆者利用體腔熱灌注治療儀行體腔內熱灌注化療,是在計算機全程動態監測和反饋調節下進行的,有效地保持了治療藥液溫度恒定在43℃~45℃之間,同時循環灌注的方法有利于藥物均勻分布,以最大面積作用于體腔,發揮最廣泛的殺傷效應,治療后能有效殲滅體腔內游離的癌細胞和殘存的微小癌轉移病灶。另外,58例患者中僅有22例出現輕度化療相關性不良反應,主要表現為Ⅰ~Ⅱ度胃腸道反應及骨髓抑制。由于本研究在灌注的同時加用了利多卡因和地塞米松,有效地預防了化療相關性胸膜炎、腹膜炎、局部疼痛及腸粘連等并發癥的發生。
總之,體腔熱灌注化療能夠有效地控制惡性胸腹水的生長,且不良反應小,患者容易接受,不僅提高了患者的生存質量,而且為其進一步行全身化療、放療創造了條件,值得臨床推廣應用。
[1]王洪武,楊仁杰.腫瘤微創治療技術[M].北京:北京科學技術出版社,2007:344-352.
[2]張珊文,尚衛群,呂有勇.抑癌基因p53提高人胃癌細胞熱敏感性的作用[J].中華物理醫學和康復雜志,2000,22(2):94-96.
[3]Moriyama Gonda N,Igawa M,Shiina H,et al.Heat-induced membrane damage combined with adriamycin on prostate carcinoma PC-3 cells:correlation of cytotoxicity,permeability and P-glycoprotein or metallothionein expression[J].Br J Urol,1998,82(4):552-559.
[4]趙艷杰,王睿斌,喬士峰.持續熱灌注腹腔化療聯合靜脈化療治療進展期胃腸腫瘤的臨床研究[J].臨床醫學,2005,25(9):34-36.

