制備工藝對西番蓮種子膳食纖維理化性質影響的比較研究
陳良云,蔣琳蘭
(1.華南理工大學生物科學與工程學院,廣東廣州510640;2.廣州軍區廣州總醫院藥劑科,廣東廣州510010)
膳食纖維是一種不能被人體的消化酶消化、也不被小腸吸收的以多糖為主體的高分子物質的總稱,并被譽為21世紀食品工業中最受關注,具有特殊保健功能和食品改性作用的一種食品添加劑。隨著社會的發展和生活水平的提高,人們在膳食結構中對高熱量、高蛋白和高脂肪食品和精細食品攝入量大大增加,肥胖癥、高血壓、高血脂、脂肪肝、糖尿病等現代“富貴病”越來越普遍。膳食纖維能夠平衡人體營養,調節機體功能,被列為繼糖、蛋白質、脂肪、水、礦物質和維生素傳統的六大營養素之后的“第七大營養素”[1]。西番蓮(Passiflora edulis Sims)為西番蓮科西番蓮多年生藤本植物,別名百香果、雞蛋果,是著名的熱帶水果,有“果汁之王”的美譽。在我國臺灣、廣東、福建、海南、云南南部及四川攀西等地已有很長的種植歷史,并形成了一定的商業規模,被譽為第三代新興果樹[2]。西番蓮在我國主要應用于果汁加工工業,其種子往往作為廢棄物被加工廠丟棄,造成大量的資源浪費[3]。本實驗分別用酶法和化學法對西番蓮種子膳食纖維進行提取、改性,并對其性質進行分析比較,以期為西番蓮種子和相關膳食纖維食品的研究開發提供參考。
1 材料與方法
1.1 材料與儀器
紫果西番蓮種子 采自于廣東省五華縣,來源穩定;耐高溫α-淀粉酶、膽固醇 阿拉丁試劑公司;木瓜蛋白酶,800u/mg、淀粉葡萄糖苷酶 威佳科技,100u/mg,貨號:1098923;2-N-嗎啉代-乙烷磺酸(MES)(超純級)、三羥甲基氨基甲烷(Tris) 威佳科技;膽酸鈉 晶欣生物科技公司;檸檬酸 天津市福晨化學試劑廠;金福魚牌花生油 市售;豬油 自制;其他試劑均為市售分析純。
SX2箱式電爐 山海金滬電熱儀器聯營廠;KPQ-1200型超聲波清洗器 廣州市科普超聲電子技術有限公司;SHZ-DⅢ循環水式真空泵 鞏義市予華儀器有限責任公司;PHS-3D型pH計 上海精密科學儀器有限公司;KGN-102F自動定氮儀 上海纖檢儀器有限公司;YPJ-337型紫外可見分光光度計 北京萊伯泰科儀器有限公司;BP210S型分析天平 Sartorius公司;HH-2數顯恒溫水浴鍋 金壇市富華儀器有限公司。
1.2 實驗方法
1.2.1 西番蓮種子膳食纖維的提取
1.2.1.1 化學法制備西番蓮種子膳食纖維 50g種子洗凈,干燥,粉碎,石油醚脫脂3 次(1∶40,mg/mL),每次1h,回收石油醚,加入15倍體積的3%檸檬酸溶液,調節 pH3.0,超聲提取 50min(40℃,1200W),過濾,殘渣70℃堿溶1h,過濾合并2次濾液,濃縮后用4倍體積的95%乙醇室溫沉淀,干燥即得可溶性膳食纖維;濾渣用蒸餾水洗至中性,干燥即得不可溶性膳食纖維。
1.2.1.2 酶法制備西番蓮種子膳食纖維 按1.2.1.1進行脫脂,加檸檬酸溶液超聲提取30min(40℃,1200W),調節pH至中性,加入100μL耐高溫α-淀粉酶,于85℃水浴20min,冷卻至65℃,加入50mg/mL木瓜蛋白酶溶液1mL,65℃水浴30min,過濾,濾渣水洗至中性,干燥即得不可溶性膳食纖維;濾液濃縮后用4倍體積的95%乙醇沉淀,干燥后得可溶性膳食纖維。
1.2.2 膳食纖維的化學成分分析 灰分含量的測定:采用GB/T5009.4.2003灼燒稱量法;粗蛋白含量的測定:采用GB/T5009.5.2003凱氏定氮法;粗脂肪含量的測定:采用GB/T5009.6.2003索氏抽提法;膳食纖維含量的測定:采用AOAC991.43酶-重量法;水分含量的測定:采用GB 5009.3-2010直接干燥法。
1.2.3 膳食纖維物理性質測定 膨脹力的測定參考文獻[4];持水力的測定參考文獻[5];結合水力的測定參考文獻[6];脂肪結合能力的測定參考文獻[7]。
1.2.3.1 膽酸鹽體外吸附實驗[8]膽酸鈉標準曲線的繪制:精確稱取膽酸鈉0.1000g,用蒸餾水溶解并定容至50mL,得到濃度為2mg/mL的對照液。準確吸取0、1.0、2.0、4.0、6.0、8.0mL 對照液至 10mL 容量瓶中,加蒸餾水至刻度得到濃度分別為0、0.2、0.4、0.8、1.2、1.6mg/mL的稀釋液。分別吸取lmL不同濃度的膽酸鈉稀釋液于10mL比色管中,分別加入6mL 45%硫酸,混勻后加入lmL 0.3%糠醛溶液,混勻,置于65℃恒溫水浴中反應30min,冷卻至室溫,以0號管為參比,在620nm處測定吸光度,以膽酸鈉濃度為橫坐標,吸光值為縱坐標繪制標準曲線。
1.2.3.2 膳食纖維吸附膽酸鈉能力的測定 準確稱取1.00g樣品于250mL錐形瓶中,加入分別含0.05、0.10、0.15g膽酸鈉的 0.15mol/L NaCl溶液 100mL,用0.1mol/L HCl溶液調節pH7.0,37℃恒溫下電磁攪拌反應2h,4000r/min離心20min,后移取1mL樣液測定其中的膽酸鈉的含量,同時做空白實驗。根據反應前后溶液中膽酸鈉的含量差異計算出樣品對膽酸鈉的吸附量。
1.2.3.3 膽固醇體外吸附實驗[9]膽固醇標準曲線的繪制:分別精確吸取0.3mg/mL膽固醇標準溶液0.00、0.05、0.16、0.32、0.48、0.64mL 于比色管中,加入冰乙酸至0.80mL,然后依次加入1mg/mL鄰苯二甲醛0.4mL及混合酸(濃硫酸∶冰乙酸=1∶1)8.0mL,靜置15min,于550nm處測定各標準管的吸光值。以吸光值為縱坐標,膽固醇含量(μg)為橫坐標繪制標準曲線。
樣品對膽固醇吸附能力測定:取市售鮮雞蛋蛋黃,加入9倍量的蒸餾水充分攪打混勻成乳液。取1.00g樣品于250mL的錐形瓶中,加入50mL稀釋蛋黃液,攪拌均勻,分別調節體系pH至2.0和7.0,置搖床中,37℃水浴振蕩4h,4000r/min離心30min,吸取0.1mL上清液,采用鄰苯二甲醛法在550nm測定膽固醇含量。
1.2.4 實驗相關指標計算 根據式(1)~式(2)計算各膳食纖維得率及膳食纖維凈產率:

1.3 實驗數據處理
顯著性采用 SPSS 17.0 Independent-Samples T test進行。圖表中同一列(行)字母a、b不同表示有顯著性差異,取顯著性水平p<0.05,用“*”表示,取極顯著性水平p<0.01,用“**”表示。
2 結果與分析
2.1 膳食纖維得率和外觀形狀
由表1可知,制備工藝對膳食纖維的感官和得率影響較大:酶法制備的膳食纖維在粒徑分布和粗糙程度方面具有較大的優勢,它可以減小顆粒粒徑,使其顆粒分布均勻。其次,酶法制備的膳食纖維得率比化學法的高出10%,可溶性膳食纖維得率比后者高出53%,而可溶性膳食纖維含量是衡量膳食纖維品質的一個重要指標,這說明酶法制備的膳食纖維具有較優的品質。

表1 兩種方法制備的種子膳食纖維外觀形態和得率比較Table 1 The comparison between two kinds of dietary fibers on appearance and yield
2.2 膳食纖維的化學組成分析
由表2看出,西番蓮種子膳食纖維含量豐富,是一種潛在的膳食纖維資源。酶法制備的產品蛋白含量比化學法的高出22.8%,這一方面可能是因為酸堿對蛋白質的變性程度更劇烈且選擇性小,而木瓜蛋白酶具有一定的專一性,另一方面由于蛋白質網絡中包裹著淀粉顆粒,淀粉高溫糊化,同時蛋白質受熱后凝固,阻止蛋白酶與酶的反應,使得蛋白質去除不徹底[10]。而對于膳食纖維含量方面,酶法制備的樣品純度較高,其TDF含量為81.44%,而化學法的為74.71%。但結合得率因素來看,酶法所得的TDF和SDF的凈產率分別為60.31%、2.98%,而化學法的TDF和SDF的凈產率分別為50.21%、2.48%,由此可見酶法提取的膳食纖維凈產率明顯高于化學法的。這可能是因為樣品經過酸堿處理后,僅可保留20%的半纖維素,10%~40%的木質素,50%~90%的纖維素,損失了大部分的可溶性膳食纖維和部分的不可溶性膳食纖維[11]。

表2 兩種方法制備膳食纖維的化學成分比較(g/100g)Table 2 The comparison of chemical constituents of the two kinds of dietary fibers(g/100g)
2.3 膨脹力的測定
由圖1可知,西番蓮種子膳食纖維具有較低的膨脹力,且隨著時間的延長而增加,化學法制備的樣品的膨脹力明顯高于酶法的,且在4h時兩者的差異具有顯著性,這與之前的大多數報道不相一致。這可能是由于西番蓮種子脂肪含量過高,使更多的疏水性基團暴露,使干燥后相同目數的纖維顆粒溶于水后能充分伸展產生更大的容積,表現為膨脹力的增大減小,而酸堿處理可以使這些親水基團發生改變。

圖1 膨脹力的比較Fig.1 The comparison of swelling capacity
2.4 持水力測定
從圖2可以看出,酶法制備的膳食纖維比化學法的具有較好的持水力,可能一方面是因為它含有更高的可溶性膳食纖維含量,另一方面可能是因為酶解可以使膳食纖維結構變得疏松,粒徑減小而均勻,顆粒的比表面積、表面能和孔隙率均增大,更多的纖維素和半纖維素轉化為可溶性成分,因而親水基團暴露出來[12]。在24h時,酶法所得膳食纖維的持水力是2.87g/g,化學法制備的為2.06g/g,此時兩者具有顯著性差異,這說明提取工藝對膳食纖維的持水力影響較大。
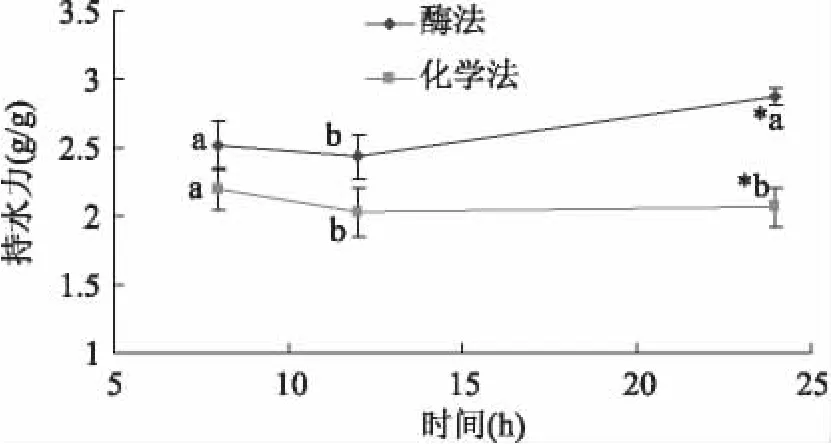
圖2 持水力的比較Fig.2 The comparison of water-holding capacity
2.5 結合水力的測定
相對于化學法,酶法制備的膳食纖維的結合水力對時間較為敏感,隨著時間的延長有很大的提高。這一方面可能是因為酶法制備的膳食纖維的顆粒粒徑較小,分子網格排列緊密,水分子不能迅速結合到親水基團,而化學法在一定程度上破壞了分子微觀結構,另一方面是因為酶法制備膳食纖維的可溶性膳食纖維和蛋白質含量較高,網狀結構中含有更多的半乳糖醛酸等親水性基團。由圖3所示,在4h時,化學法制備的膳食纖維結合水力為3.36g/g,酶法的是2.48g/g,隨著時間延長到6h時,后者略高于前者。

圖3 結合水力的比較Fig.3 The comparison of water-bonding capacity
2.6 脂肪結合能力的測定
由圖4可知,不同方法制備的膳食纖維對不同脂肪酸的吸附能力具有較大差異:從總體上看,西番蓮種子膳食纖維對飽和脂肪酸的吸附力高出對不飽和脂肪酸的吸附力高達22%;對于不飽和脂肪酸吸附力而言,化學法提取的膳食纖維比酶法制備的膳食纖維高出近11%;而在飽和脂肪酸的吸附能力方面,酶法制備的膳食纖維較化學法制備的膳食纖維吸附力強,且差異具有顯著性。
2.7 膽酸鈉體外吸附實驗

圖4 脂肪結合能力的比較Fig.4 The comparison of fat-bonding capacity
由圖5可知,膽酸鈉標準溶液在0~1.6mg/mL質量濃度范圍內與吸光度值線性關系良好。從圖6可以看出,西番蓮種子膳食纖維的膽酸鈉吸附能力高于已經報道的多數膳食纖維。當膽酸鈉濃度為0.05g/100mL時,酶法制備的膳食纖維的吸附量為17.52mg/g,化學法制備的膳食纖維吸附量為25.89mg/g,后者高出前者48%,且差異極具顯著性,這說明提取方法對膽酸鈉濃度為0.05g/100mL時的膳食纖維吸附力影響明顯。隨著膽酸鈉濃度的提高,膳食纖維的吸附力發生一定的變化,當膽酸鈉濃度為0.15g/100mL時,酶法制備的膳食纖維的吸附量為77.01mg/g,吸附力提高4倍多,化學法制備的膳食纖維吸附量為51.48mg/g,吸附力提高約2倍,前者高出50%,這說明體系中膽酸鈉濃度也是影響膳食纖維吸附能力的一個重要影響因素。

圖5 膽酸鈉紫外吸收標準曲線Fig.5 The standard curve of the adsorption of sodium cholate
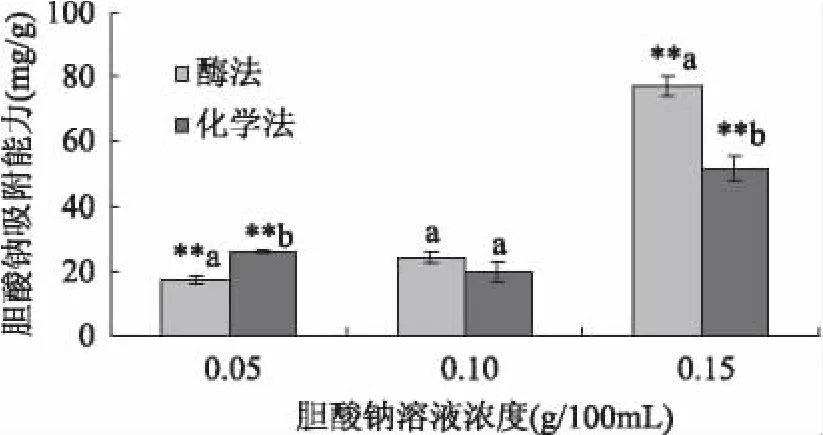
圖6 膽酸鈉吸附能力比較Fig.6 The comparison of sodium cholate adsorption
2.8 膽固醇體外吸附實驗
由圖7~圖8可知:在中性條件下(模擬小腸的pH環境),各膳食纖維對膽固醇的吸附力均高于酸性條件下(模擬胃的酸堿條件)的吸附能力,這與張寧等報道的大豆、小麥和水果膳食纖維相一致[13]。當pH2時,酶法制備的膳食纖維吸附力為4.69mg/g,高出化學法13%;當pH7時,化學法所得膳食纖維吸附力為7.47mg/g,略高于酶法的7.16mg/g,這說明制備工藝對西番蓮種子膳食纖維的膽固醇吸附能力影響不明顯。

圖7 膽固醇紫外吸收標準曲線Fig.7 The standard curve of the adsorption of cholesterol

圖8 膽固醇吸附能力比較Fig.8 The comparison of cholesterol adsorption
3 結論
化學法方法簡單,易操作,水解徹底;但非特異性,且需要高堿高酸的條件,對設備要求高;在去除雜質的同時也對膳食纖維造成破壞,而且會污染環境;而酶法處理反應條件溫和,專一性強,不會影響膳食纖維的產量和質量,但要求嚴格的工藝條件且生產成本較高。本實驗比較了兩種方法對制備西番蓮種子膳食纖維物化性質的影響:
3.1 酶法制備的膳食纖維粒徑均勻,質地細膩、柔軟,粗蛋白和脂肪含量較高;化學法制備出的樣品顆粒較大,較粗糙,灰分含量較高。
3.2 酶法提取膳食纖維的凈產率為60.31%,SDF凈產率為2.98%,化學法的分別為50.21%、2.48%,由此可見酶法制備的膳食纖維不僅產率較高,且SDF含量高。
3.3 兩種方法制備出的膳食纖維在物化性質方面各具優勢:酶法制備的膳食纖維的持水力、飽和脂肪結合能力、膽酸鈉吸附能力都高于化學法的,而化學法制備的樣品在膨脹力、結合水力、不飽和脂肪酸結合力方面較有優勢,在對膽固醇吸附能力上兩者差異不大。
[1]艾仄宜,張潔,楊曉萍.茶葉非水溶性膳食纖維的提取及其理化特性研究[J].食品科學,2010,31(8):121-124.
[2]Ingale A G,Hivrale A U.Pharmacological studies of Passiflora sp.and their bioactive compounds[J].African Journal of Plant Scienc,2010,4(1):417-426.
[3]鄭文武,鄭頌,劉華.我國西番蓮生產現狀及發展探討[J].中國熱帶農業,2008(6):8-9.
[4]FEMENIA A,LEFEBVR C,THEBAUDIN Y,et al.Physical andsensory properties of model foods supplemented with cauliflower fiber[J].Journal of Food Science,1997,62(4):635-639.
[5]ESPOSITO F,ARLOTTIB G,BONIFATI A M,et al.Antioxidant activity and dietary fibre in durum wheat bran by products[J].Food Research International,2005,38(10):1167-1173.
[6]鄭剛,何李,趙國華.高壓蒸煮對蘋果膳食纖維理化特性及發酵性能的影響[J].食品與發酵工業,2009,35(5):90-93.
[7]Sangnark A,Noomhorm A.Effect of particle sizes on function properties of dietary fibre prepared from sugarcane bagasse[J].Food Chemistry,2003,80:221.
[8]胡國華,黃紹華.米糠膳食纖維對膽酸鈉吸附作用的研究[J].中國食品添加劑,2001(2):10-12.
[9]陳亞飛,趙謀明.水溶性與水不溶性膳食纖維對油脂、膽固醇和膽酸鈉吸附作用研究[J].現代食品科技,2005(3):58-60.
[10]李鵬飛,陸紅佳,任志遠.不同方法提取麥麩膳食纖維的比較研究[J].現代農業科學,2009,16(6):7-9.
[11]吳生文,高紅娟,張水華.工業中藥渣的膳食纖維含量研究分析[J].現代食品科技,2008,24(9):940-942.
[12]何李,李燦明,李紹振.高制備工藝對果渣膳食纖維水合性質的影響[J].食品工業科技,2012,33(3):186-190.
[13]張寧,歐仕益,黃才歡.膳食纖維對有害元素吸附的研究[J].食品研究與開發,2006,27(8):163-166.

