針藥并用對大鼠急性痛風性關節炎滑膜IL-1b、IL-8的影響
金澤,張振營,姜珊珊,趙洪斌,陳靜,王玉琳
(1.黑龍江中醫藥大學附屬第二醫院,哈爾濱 150001;2.黑龍江中醫藥大學,哈爾濱 150040)
痛風是由于長期嘌呤代謝紊亂及尿酸排泄減少所引起的一組疾病,其主要病理改變是尿酸鈉晶體在關節周圍組織沉積而引起的急性炎癥反應。中醫針灸治療痛風因其療效顯著[1],不良反應少而得到廣泛的關注。在取得較好臨床效果的前提下,我們以自擬痛風方配合針刺治療急性痛風。本實驗通過觀察針藥并用治療對大鼠急性痛風性關節炎滑膜組織IL-1b、IL-8含量的影響,進一步研究其對急性痛風的抗炎機理。
1 材料與方法
1.1 實驗材料
1.1.1 實驗動物
3月齡健康雄性 wistar大鼠 96只,體重(250±20)g,清潔級,由黑龍江中醫藥大學動物實驗中心提供,合格證號為2008004。
1.1.2 藥品與試劑
自擬痛風方(為中藥配方顆粒,由土茯苓、生大黃、威靈仙、秦艽、薏苡仁、忍冬藤、防己、豬苓、蒼術、茯苓、黃柏等組成)由江陰天江藥業有限公司提供,用100℃熱水沖開。根據實驗大鼠藥用劑量公式[2]計算出中藥制成濃度為0.2 g/mL的溶液,秋水仙堿制成濃度為0.1 mg/mL,兩者封瓶后置于冰箱中保存備用。大鼠IL-1b、IL-8試劑盒由北京邦定生物制劑公司提供,秋水仙堿由西雙版納有限公司生產(批號 110217),尿酸鈉晶體購于北京化學試劑公司,SIGMA CHEMICAL CO.(5gu- 2875 LotBCBF1330V)。
1.2 實驗方法
1.2.1 造模
痛風動物模型制作方法按國外Coderre等[3-4]經典方法略作改進,將大鼠膝關節周圍脫毛,消毒皮膚,輕彎曲膝關節,于關節正中垂直進針,至針尖有落空感,用6號注射器將0.2 mL(濃度2.5 g/100 mL)尿酸鈉溶液,通過髕上韌帶注入到關節腔內形成痛風模型。
1.2.2 尿酸鈉結晶及尿酸鈉溶液的制備
取 1250 mg尿酸鈉結晶加 45 mL生理鹽水,再加5 mL吐溫80,加熱攪拌,配成50 mL尿酸鈉溶液。
1.2.3 分組及處理
將96只大鼠按照上述造模方法造模,并隨機分成空白組、模型組、治療組、對照組,每組24只,各組根據取材時間1 d、3 d、5 d隨機分成3組,并分別給予以下相應處理。空白組不造模,不用藥,不施針,其余方法相同。模型組于造模后3 h予2 mL生理鹽水灌胃,不施針,余相同。對照組于造模后3 h予秋水仙堿懸浮液(0.2 g/mL)2 mL灌胃,每日1次,連續5 d,余相同。治療組于造模后 3 h予自擬痛風方中藥懸浮液(0.2 g/mL)2 mL灌胃,每日1次,連續5 d;應用從陽引陰針法選取足三里、陰陵泉進行針刺,取穴參照《實驗動物針灸穴位圖譜》,用0.25 mm×25 mm毫針進行針刺,針刺后接華佗牌 SDZ-Ⅱ電針儀,采用疏密波,每日1次,每次20 min,連續治療5 d,余相同。
1.3 觀察指標
分別于造模后1、3、5 d后處死,檢測關節滑膜組織 IL-1b、IL-8含量變化。取滑膜組織,稱取 20 mg加組織提取液(試劑盒提供),電動勻漿,3000 rpm,15 min,按酶聯免疫法測定。
1.4 統計學方法
所有數據均采用SPSS13.0統計軟件進行分析。采用單因索方差分析,組間比較選用LSD-t檢驗。
2 結果
表1 各組治療前后關節滑膜組織IL-1b、IL-8含量比較(±s,ng/mL)
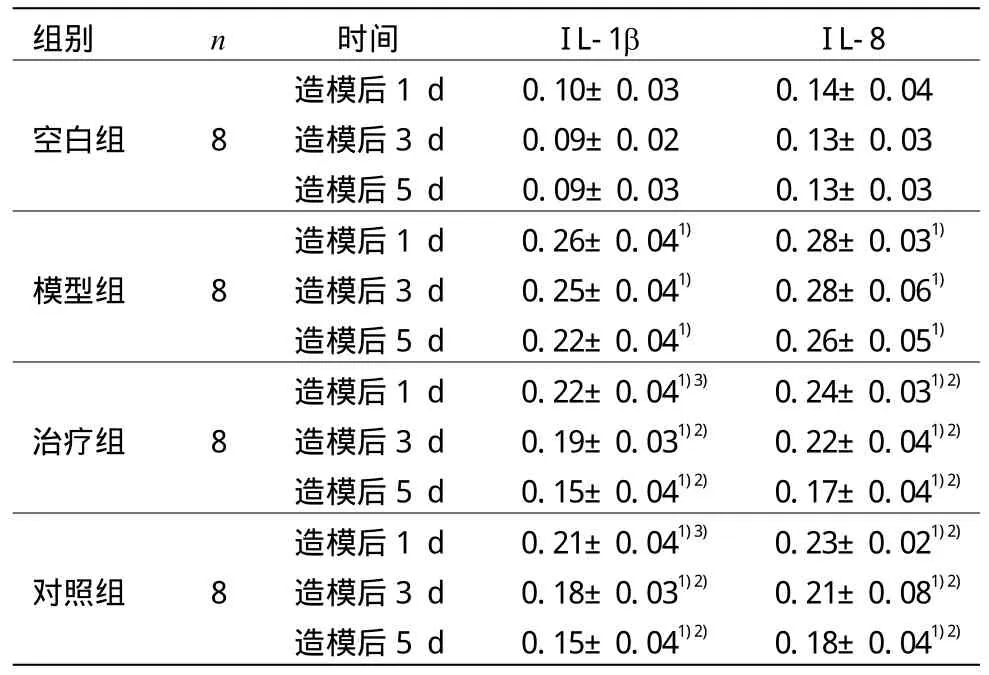
表1 各組治療前后關節滑膜組織IL-1b、IL-8含量比較(±s,ng/mL)
注:與空白組比較1)P<0.05;與模型組比較2)P<0.01,3)P<0.05
組別 n 時間 IL-1b IL-8空白組 8造模后1 d 0.10±0.03 0.14±0.04造模后3 d 0.09±0.02 0.13±0.03造模后5 d 0.09±0.03 0.13±0.03模型組 8造模后1 d 0.26±0.041) 0.28±0.031)造模后3 d 0.25±0.041) 0.28±0.061)造模后5 d 0.22±0.041) 0.26±0.051)治療組 8造模后1 d 0.22±0.041)3) 0.24±0.031)2)造模后3 d 0.19±0.031)2) 0.22±0.041)2)造模后5 d 0.15±0.041)2) 0.17±0.041)2)對照組 8造模后1 d 0.21±0.041)3) 0.23±0.021)2)造模后3 d 0.18±0.031)2) 0.21±0.081)2)造模后5 d 0.15±0.041)2) 0.18±0.041)2)
模型組、治療組和對照組造模后關節滑膜組織IL-1b、IL-8含量與空白組比較,差異均具有統計學意義(P<0.05)。治療組和對照組治療后關節滑膜組織IL-1b、IL-8含量與模型組比較,差異均具有統計學意義(P<0.01,P<0.05)。詳見表1。
3 討論
痛風是由于長期嘌呤代謝紊亂及尿酸排泄減少所引起的一組疾病。臨床和實驗均證實,尿酸鈉結晶在滑膜組織沉積并脫落是引起急性痛風性關節炎的病理基礎,IL-1b、IL-8、TNF-a等參與炎癥過程。IL-1b、IL-8、TNF-a作為炎癥趨化因子和激活因子在痛風性關節炎的發生、發展過程中起重要作用。有文獻認為IL-1b、TNF-a是前炎癥網鏈中的一級細胞因子,而 IL-8是由IL-1b、TNF-a誘導的二級炎癥細胞因子[5]。IL-1b作為炎癥趨化因子和激活因子在痛風性關節炎的發生、發展過程中發揮關鍵作用[6]。IL-8的主要生物學活性是吸引和激活中性粒細胞,中性粒細胞與IL-8接觸后發生形態變化,定向游走到反應部位并釋放一系列活性產物;這些作用可導致機體局部的炎癥反應,達到殺菌和修復細胞損傷的作用。所以本實驗我們選取IL-1b、IL-8觀測針藥結合干預治療的抗炎療效。
中醫學認為痛風屬“痹證”范疇,病機是嗜食厚味,以致濕熱內蘊,又兼外感風寒,侵襲經絡,以致氣血津液運行受阻,遂使煎熬成痰,痰凝絡道,致關節紅腫灼痛,故得此病。自擬痛風方中用威靈仙、秦艽、防己祛風除濕、通絡止痛,蒼術、黃柏取二妙散清熱燥濕之意,豬苓、茯苓、薏苡仁以健脾利濕去濁,輔以土茯苓、忍冬藤以解毒除濕,并用生大黃瀉熱逐瘀,以上述諸藥共奏清熱、祛風、除濕、消腫之功效。并配合透刺針法中“從陽引陰”針法以活血、通絡、止痛。本實驗證實,運用針藥并用治療可以明顯降低 IL-1b、IL-8含量,與對照組相比無明顯差異,說明本治療方法具有顯著抗炎效果。
[1] Zhang QC, Huang QL. Clinical observation on treatment of acute gouty arthritis with acupuncture: a report of 60 cases[J]. J Acupunct Tuina Sci, 2004,2(3):32-33.
[2] 陳洪巖,夏長友.簡明實驗動物學[M].哈爾濱:哈爾濱出版社,2002:216.
[3] Coderre TJ, Wall PD. Ankle joint urate arthritis in rat: an alternative animal model of arthritis to that produced by freund’s adjuvant[J].Pain, 1987,28(3):379-393.
[4] Coderre TJ, Wall PD. Ankle joint arthritis in ratsprovide a useful tool for the evaluation of analgesis and anti-arthritis agents[J]. Pham Biochern Behav, 1988,29(3):461-466.
[5] Shrestha M, Chiu MJ, Martin RI,et a1. Treatment of acute gouty arthritis with intramuscular ketoralac tromethamine[J]. Am J Emerg Med, 1994,12(4):454-455.
[6] 王秋琴.痛風證治探討[J].中國中醫骨傷科雜志,1999,7(4):52.

