丹參酮ⅡA對正常和氧化損傷內皮細胞的保護作用研究
羅 婷,鐘先鋒,李 靜,劉小如,鄧澤元
南昌大學食品科學與技術國家重點實驗室,南昌330047
動脈粥樣硬化(atherosclerosis,AS)是心腦血管疾病的前期階段,血管內膜附有一層內皮細胞,是非常光滑的,動脈粥樣硬化發生常伴有內皮細胞損傷或脫落[1],血管內皮細胞的功能障礙是AS發生的始動因素[2]。故進行早期預防內皮細胞功能障礙對AS的發病具有積極的作用[3]。
丹參酮ⅡA(Tanshinone IIA,TIIA)具有明顯的抗氧化應激作用[4],氧化應激通過產生氧自由基介導血管內皮細胞的損傷,與血管內皮功能障礙有著密切的關系。已有實驗證實丹參酮ⅡA具有抗氧化的作用,并且能夠抑制羥自由基引起的脂質過氧化[5]。本研究以培養的人臍靜脈內皮細胞為材料,觀察丹參酮ⅡA對內皮細胞增殖的影響,探討丹參酮ⅡA保護損傷后的血管內皮細胞和抗動脈粥樣硬化的作用。
1 材料與方法
1.1 材料與試劑
人臍靜脈內皮細胞株(Human vascular endothelial cells,HUVECs)由南昌大學醫學院提供;DMEM (Invitrogen corporation);胰蛋白酶(Sigma公司); MTT(Sigma公司);胎牛血清(Gibco公司);丹參酮ⅡA(中國生物制品檢定所;批號:110766-200518;純度:98%以上);DMSO(天津大茂公司);乳酸脫氫酶(lactate dehydrogenase,LDH)、超氧化物歧化酶(superoxide dismutase,SOD)、一氧化氮合酶(nitrogen oxide synthase,NOS)、谷胱甘肽過氧化物酶(glutathione peroxidase,GSH-Px),丙二醛(malondialdehyd,MDA)、一氧化氮(nitric oxide,NO)試劑盒(南京建成生物工程研究所)。
1.2 儀器與設備
CO2恒溫恒濕培養箱(SanYo);生物安全柜(蘇凈集團安泰公司);倒置顯微鏡(上海光學儀器進出口有限公司);MK3型酶標儀(賽默飛世爾上海儀器有限公司);臺式冷凍高速離心機(Heal Force)等。
1.3 方法
1.3.1 內皮細胞培養
人臍靜脈內皮細胞的培養:取人臍靜脈血管內皮細胞接種于50 mL培養瓶內,待細胞鋪滿80%~90%的瓶底表面積后,用0.25%的胰蛋白酶消化1 min,離心,分裝于新的培養瓶中,置37℃、5%的CO2培養箱內培養。第二天換培養液,培養至第3天進行傳代。如上述方法正常培養3代以上后,將內皮細胞分組進行實驗。
1.3.2 MTT法測定丹參酮ⅡA對人臍靜脈內皮細胞增殖的影響
離心收集對數期細胞,以2×104~5×104個/ mL的密度接種于96孔板中,5%CO2,37℃培養箱中培養24 h后,棄去培養液,用PBS洗去未貼壁細胞。換用無血清的培養基繼續培養8 h,使細胞同步化。然后換用含5%胎牛血清和不同濃度丹參酮ⅡA的DMEM培養液培養,其中丹參酮ⅡA分6個濃度,分別是400、200、100、40、20、10 μmol/L,每組設6個復孔,同時設置調零孔和對照孔。24 h后終止培養,每孔加入MTT(5 mg/mL)20 μL,在37℃體積分數5%CO2孵育4 h。棄去上清液,每孔加入150 μL二甲基亞砜(DMSO),置搖床上低速振蕩10 min,使結晶物充分溶解,并用酶標儀OD490nm處測定各孔的吸光值。
1.3.3 MTT法測定丹參酮ⅡA對人臍靜脈內皮細胞損傷的保護作用
將細胞分為對照組(在細胞培養體系中不施加任何干預因素)、H2O2組(在細胞培養體系中加入100 μmol/L的 H2O2)和藥物干預組(10~100 μmol/L丹參酮ⅡA+100 μmol/L H2O2)[7]。前期實驗操作同1.3.2,加入丹參酮ⅡA后,培養24 h,加入100 μmol/L H2O2作用內皮細胞6 h,換入無血清DMEM培養液100 μL/孔,并于每孔加入MTT(5 mg/mL)10 μL。繼續培養4 h后,加入DMSO使結晶物溶解,并用酶標儀OD490nm處測定各孔的吸光值。
1.3.4 測定丹參酮ⅡA對內皮細胞LDH、SOD、MDA、NOS、NO和GSH的影響
使用試劑盒,按照試劑盒說明書測定每組內皮細胞中LDH釋放率,MDA、NOS、NO、SOD和GSHPx的變化。
1.3.5 流式細胞術檢測內皮細胞凋亡
實驗分組同1.3.2,內皮細胞用胰酶消化后,PBS洗滌2遍,離心(1000 rpm,5 min)獲取細胞,加入100 μL的Binding Buffer懸浮細胞,使用5 μL FITC和5 μL PI在室溫避光反應10~15 min,離心加入500 μL的Binding Buffer懸浮細胞,在1 h內進行流式細胞儀的檢測。
1.3.6 統計學處理
采用SPSS 17.0統計軟件處理實驗數據,單因素方差分析進行顯著性檢驗,并用LSD-t進行了組間差異性比較;所得數據用±s表示,P<0.05表示差異顯著,具有統計學意義。
2 結果
2.1 丹參酮ⅡA對正常內皮細胞生長的影響
如圖1所示,低劑量添加丹參酮ⅡA對正常內皮細胞的生長沒有影響,但在濃度達到200 μmol/L時,對內皮細胞生長產生抑制作用,可能過量的丹參酮ⅡA會對內皮產生細胞毒性。圖1顯示,丹參酮ⅡA添加濃度于10~100 μmol/L之間時,內皮細胞的存活率沒有明顯影響,但當上升到400 μmol/L,內皮細胞的存活率也于100%下降到57.4%,隨著丹參酮ⅡA添加濃度的升高,丹參酮ⅡA對血管內皮細胞生長抑制作用越來越明顯,呈現濃度依賴關系。
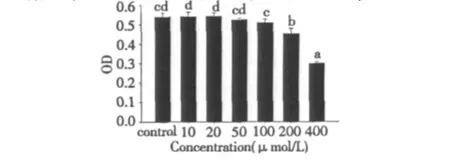
圖1 丹參酮ⅡA對內皮細胞增殖的影響Fig.1 The effect of Tanshinone IIA on the proliferation of HUVECs
2.2 丹參酮ⅡA對內皮細胞損傷的保護作用
根據2.1的實驗結果,本實驗選擇了較低濃度(5~100 μmol/L)的丹參酮ⅡA來保護內皮細胞,以排除細胞毒性的影響。從圖2可以看到,丹參酮ⅡA對內皮細胞的保護作用顯濃度依賴關系。比較藥物添加各組和H2O2組,添加5、10 μmol/L的丹參酮ⅡA對內皮細胞的保護作用不明顯(P<0.05),而添加量上升到20 μmol/L,則有顯著的保護作用。
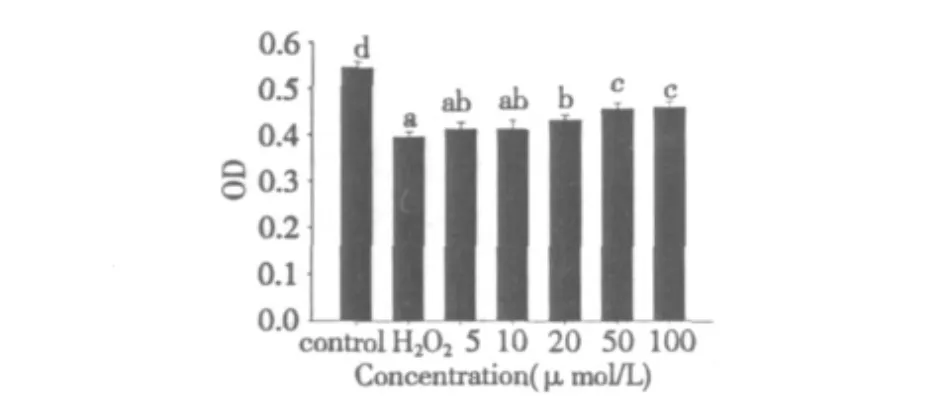
圖2 丹參酮ⅡA對內皮細胞損傷的保護作用Fig.2 Protective effects of Tanshinone IIA on HUVECs from oxidative injury
2.3 丹參酮ⅡA對內皮細胞 LDH、SOD、MDA、NOS、NO和GSH的影響
從表1可以看到,H2O2組的LDH釋放率和MDA與對照組相比顯著上升,LDH釋放率從36.28%上升到54.89%,MDA從23.78 nmol/mg prot上升到45.70 nmol/mg prot。加入丹參酮ⅡA處理后,LDH釋放率和MDA有不同程度下降,如100 μmol/L丹參酮ⅡA預處理組與H2O2組比較,LDH釋放率下降為44.75%,MDA下降為33.57 nmol/mg prot,說明內皮細胞經丹參酮ⅡA預處理,可以抵御氧自由基損傷,降低細胞脂質過氧化物,維護生物膜的完整性。
NOS是維持內皮細胞生理功能的重要活性物質,能清除體內自由基。NO可促進血管舒張,并抑制增生作用[6]。H2O2組與對照組相比,內皮細胞NOS表達減少,其產物NO水平也隨之降低,隨著丹參酮ⅡA加入,NO水平回升。
細胞內同時存在清除過量氧自由基的系統,如SOD和GSH-Px,這些抗氧化酶可以保護內皮細胞,維持細胞膜結構和正常生理功能的作用。本研究表明:與對照組相比,H2O2組SOD和GSH-Px活性顯著降低。與H2O2組相比,50和100μmol/L丹參酮ⅡA均可增強內皮細胞的SOD、GSH-Px活性,SOD活力分別為112.51 U/mgprot和131.37 U/mgprot (P<0.05);GSH-Px活力分別為176.52 U/mgprot和212.96 U/mgprot(P<0.05)。且隨濃度的增加,細胞的SOD和GSH-Px活性也逐漸提高,表明丹參酮ⅡA可增強內皮細胞的抗氧自由作用,具一定的量效關系。
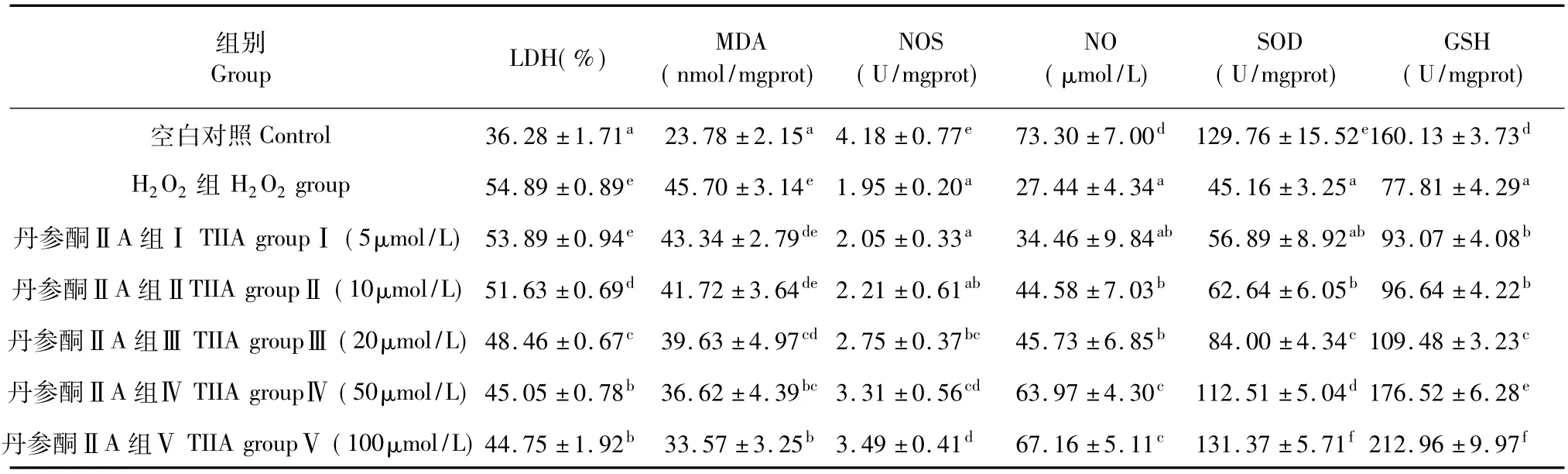
表1 丹參酮ⅡA對人臍靜脈內皮細胞LDH、MDA、NOS、NO、SOD和GSH-PX的影響Table 1 Effects of Tanshinone IIA on LDH,MDA,NOS,NO,SOD,GSH-PX in HUVECs
2.4 丹參酮ⅡA對內皮細胞凋亡的影響
從圖3可以看到,人臍靜脈內皮細胞經H2O2氧化損傷后,41.7%的細胞進入早期凋亡,2.1%的細胞進入晚期凋亡或者壞死,而丹參酮ⅡA預處理組(50 μmol/L),有23.2%的細胞進入早期凋亡,0.6%的細胞進入晚期凋亡或者壞死,提示丹參酮ⅡA可以保護內皮細胞免受氧化損傷,降低細胞凋亡率,維持正常生理功能防止AS的形成。
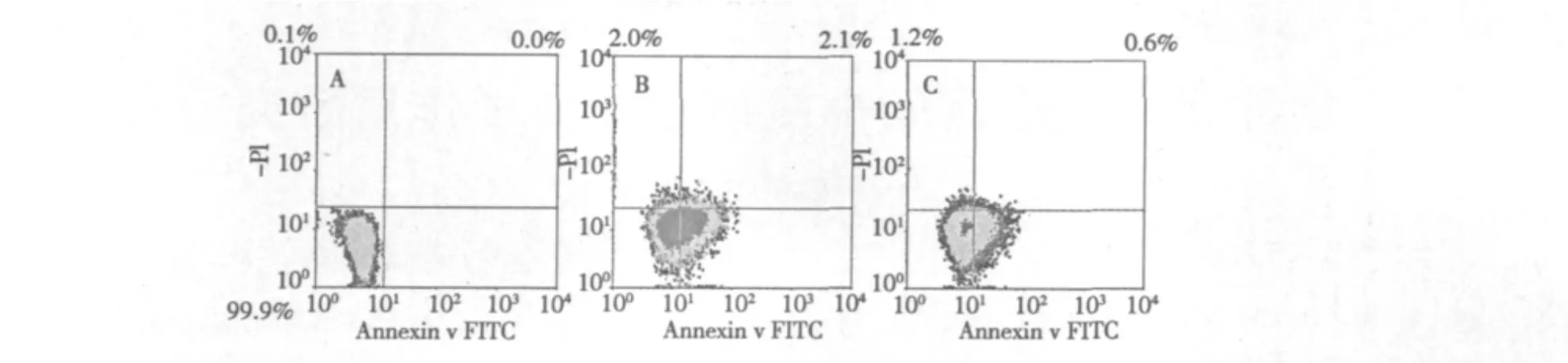
圖3 FITC-PI通道的二維散點圖Fig.3 Bivariate graphs illustrate the FITC-PI fluorescent resolution of HUVECs
3 討論
人體內多種因素導致血管內皮細胞損傷,如炎癥因子、失去平衡的調節因子、活性氧、脂肪氧化酶等,其中活性氧產生的氧化損傷是其中重要的因素之一[7]。人體正常生理活動過程伴有氧化性物質參與,主要為氧自由基。氧自由基可以參與人體的物質代謝和信號傳導,對細胞發揮正常生理功能起著重要作用。但是人體產生過量氧自由基或者清除能力下降時,則對人體內各種細胞產生不可逆的氧化損傷。
實驗室為了建立氧化損傷模型,多采用H2O2、乙醇和ox-LDL等試劑,本研究利用H2O2產生O來建立HUVECs損傷模型,因為該系統經濟科學,方便易行,適于快速誘導損傷建立模型,進而大量篩選藥物。綜合文獻和預實驗數據分析,本文采用200 μmol/L的H2O2誘導內皮細胞損傷。
從自然界中提取的部分植物化合物對細胞有細胞毒性,在研究各種化合物對細胞的保護作用時,實驗設計的藥物濃度應在不產生細胞毒性的范圍內。在本研究中,當丹參酮ⅡA添加濃度上升到200μmol/L,對HUVECs的增殖產生抑制作用,有顯著性差異(圖1)。所以本研究的實驗方案設計的藥物濃度為5~100 μmol/L。
氧自由基損傷細胞膜上的脂質,使其過氧化分解生成脂質過氧化物,如MDA。MDA能與蛋白質、氨基酸及其它細胞成分作用,最終使磷脂結構發生變化,生物膜受到嚴重的損害,致使細胞活力下降,同時細胞內的LDH外漏[8]。丹參酮ⅡA也促進了NOS和NO的生成量(表1),為了應對氧化應激,恢復平衡狀態,相對正常分泌水平過量產生的NOS和NO能清除體內自由基,維持血管正常生理功能。隨著丹參酮ⅡA加入,NO水平回升。丹參酮ⅡA也促進了SOD和GSH-PX的分泌,SOD和GSH-PX是體內清除過量氧自由基的系統,能消除人體在吸收代謝過程中生成的有毒有害物質,如超氧陰離子自由基,體內依靠SOD和GSH-PX系統可以維持細胞內的氧化還原狀態的平衡。
研究證實在動脈粥樣硬化的斑塊中存在著血管內皮細胞的凋亡現象。而且血管內皮細胞位于血管最內層,直接與循環血液接觸,因此較易受到血液中活性物質及血液剪切力的影響,在心腦血管疾病的發生過程中處于關鍵環節[9]。細胞凋亡導致細胞核內的DNA因漏出而減少,加入丹參酮ⅡA預處理后,大大減少了凋亡率,保持了內皮細胞的正常活力和生理功能。
綜合上述,丹參酮ⅡA在10~100 μmol/L濃度下,無細胞毒性;加入丹參酮ⅡA預處理后,減弱了因H2O2引起的細胞的過度脂質過氧化,維持細胞膜結構,減少了LDH釋放率和MDA生成量,增加了NOS、NO、SOD和GSH等抗氧化物質的分泌量,阻礙了細胞凋亡和在血管表皮上形成動脈粥樣硬化斑塊,阻止AS的發生和發展。
1 Avriam M.Modified forms of low density lipoprotein and atherosclerosis.Atherosclerosis,1993;98:1-9.
2 Fu H,Li J,Li QX,et al.Protective effect of ligustrazine on accelerated anti-glomerular basement membrane antibody nephritis in rats is based on its antioxidant properties.Eur J Pharmacol,2007:197-202.
3 Ross R.The pathogenesis of atherosclerosis:a perspective for the1990s.Nature,1993,362:801-809.
4 Tang F,Wu X,Wang T,et al.Tanshinone II A attenuates atherosclerotic calcification in rat model by inhibition of oxidative stress.Vasc Pharmacol,2007,46:427.
5 Wang L(王蘭),Li XR(李新榮),Deng XL(鄧湘蕾),et al.The effect of Tanshinone IIA on oxygen free radicals in type diabetes.J Clin Exp Med(臨床和實驗醫學雜志),2007,6(7):8-11.
6 Song LW(宋良文),Wang DW(王德文),Wang TL(王泰齡),et al.Expression and antagonist role of endothelin and nitric oxide synthase in atherosclerotic plaque.Chin J Pathol (中華病理學雜志),1997,26:12-15.
7 Csiszar A,Smith KE,Koller A,et al.Regulation of bone morphogenetic protein-2 expression in endothelial cells:role of nuclear factor-kappaB activation by tumor necrosis factor-alpha,H2O2,and high intravascular pressure.Circulation,2005,111:2364-2372.
8 Peng L(彭亮),Li ZM(李知敏).The protective effect of Spirodela polyrrhiza(L).Schleid extract on ECV-304 injury induced by hydrogen peroxide.Lishizhen Med Mater Med Res (時珍國醫國藥),2009,20:996-998.
9 Mei JJ(梅家俊),Cai DY(蔡大勇),Zhao TX(趙婷秀),et al.Study of the effective mechanism which Chinese herb Ligusticum chuanxiong Hort prevents and cures the pathological changes of rabbit atherosclerosis.J Hubei Coll Tradit Chin Med(湖北中醫學院學報),2004,6:5-7.

