高效液相色譜法同時測定植煙土壤和水中3種除草劑殘留量
丁春霞,龔道新,肖 浩,任穎俊,楊麗華
(1.湖南農業大學理學院,長沙 410128;2.湖南農業大學資源環境學院,長沙 410128;3.湖南農業大學煙草研究院,長沙 410128)
農田雜草對農產品的產量和質量會產生嚴重的影響,隨著除草劑品種的日益增多,新的除草劑不斷用于農業生產,因此環境樣品中常常含有多種除草劑的殘留組分,除草劑殘留分析方法也逐漸由單一種類除草劑的檢測向多種除草劑多殘留分析發展[1]。高效氟吡甲禾靈、精吡氟禾草靈及精喹禾靈是一類芳氧苯氧丙酸酯類除草劑[2],屬于內吸傳導型莖葉處理除草劑,被廣泛用于煙草、油菜、花生、馬鈴薯、大豆、番茄等多種闊葉作物地中,防除馬唐、狗尾草、稗草、牛筋等多種一年生和多年生禾本科雜草,除草活性高[3]。但隨著此類除草劑的廣泛使用,它對生態環境產生的不利影響也日趨增多[4-9]。因此,建立一套能同時檢測該類除草劑在環境中殘留量的分析與檢測方法就顯得十分必要。目前,對于這類除草劑的單劑在環境及作物中的殘留檢測方法已有一些報道,主要的分析檢測方法有氣相色譜法[10]、氣相色譜-質譜法[11]、高效液相色譜法[12-14]、高效液相色譜-質譜法[15]、酶聯免疫法[16-17]等。但尚未見有這3種除草劑在環境樣品中同時分析與檢測的報道。筆者通過對樣品前處理條件及其分析檢測條件的摸索,建立了一種能同時測定植煙土壤及其周邊水樣中精喹禾靈、高效氟吡甲禾靈和精吡氟禾草靈殘留量的分析方法。
1 材料與方法
1.1 儀器和試劑
Agilent 1260型高效液相色譜儀帶紫外檢測器(美國安捷倫科技有限公司),SHZ-D型循環水真空泵(鞏義市予華有限責任公司),RE-2000A型旋轉蒸發器(上海亞帶生化儀器廠),2HWY-2102型雙層大容量全溫度恒溫培養振蕩器(上海智城分析儀器制造有限公司)。
甲醇為色譜純,二氯甲烷、丙酮、乙腈、氯化鈉均為分析純。
高效氟吡甲禾靈標準品(純度為95.3%)、精吡氟禾草靈標準品(純度為94.8%)均由山東綠霸化工股份有限公司提供;精喹禾靈標準品(純度為96.7%)由湖南化工研究院提供。土壤樣品采自湖南農業大學煙草基地,樣品經風干后磨碎過 20目篩;水樣采自湖南農業大學煙草基地附近的池塘和水渠。
1.2 混合標準溶液的配制
分別準確稱取高效氟吡甲禾靈、精吡氟禾草靈及精喹禾靈的標準品,用甲醇配制成一定濃度的儲備液,準確吸取一定量各種農藥的儲備液,用甲醇梯度稀釋法配制質量濃度分別為0.0050、0.05、0.10、0.50、1.00、5.00 mg/L的混合標準溶液。
1.3 樣品的提取與凈化
1.3.1 植煙土壤 準確稱取植煙土壤樣品20.0 g,置于250 mL具塞三角瓶中,加入60 mL丙酮,在恒溫振蕩器中震蕩提取 30 min,減壓抽濾,再用60 mL丙酮分2次洗滌殘渣和抽濾瓶,合并濾液,無損轉入250 mL具塞三角瓶中,在旋轉蒸發儀上濃縮至近干后,用5 mL二氯甲烷-丙酮(3:1,v:v)混合液溶解,然后將其無損轉移入經10 mL二氯甲烷-丙酮(3:1,v:v)混合液預淋洗過的弗羅里硅土凈化柱中,用60 mL二氯甲烷-丙酮(3:1,v:v)混合液洗脫,收集全部洗脫液,置于旋轉蒸發儀上濃縮近干,用色譜甲醇溶解并定容至5.0 mL,過0.45 μm濾膜,待HPLC檢測。
1.3.2 水 準確量取100.0 mL已制備好的水樣置于500 mL分液漏斗中,向其中加入20 mL10%的氯化鈉水溶液,再加入5 mL丙酮,搖勻,分別用40、40、20 mL二氯甲烷液萃取3次,合并二氯甲烷萃取相,在旋轉蒸發儀上濃縮至近干;用甲醇溶解并定容至5.0 mL,過0.45 μm濾膜,待HPLC檢測。
1.4 HPLC條件
色譜柱:Hypersid-C18不銹鋼柱(250 mm×4.6 mm,5.0 μm);流動相為甲醇-水(85:15,v:v);流速0.6 mL/min;檢測波長223 nm;柱溫35 ℃;進樣量 20 μL。
1.5 添加回收率實驗
植煙土壤添加回收率:準確稱取空白植煙土壤20.0 g,用3種混合標準溶液分別添加至0.050、0.50、1.0 mg/kg三個水平,每個水平重復5次,按照1.3.1前處理方法處理,按照1.4的色譜操作條件進行測定;水的添加回收率:取空白水100 mL過濾,用3種混合標準溶液分別添加至0.0050、0.10、1.0 mg/L三個水平,每個水平重復5次。按照1.3.2前處理方法處理,按照1.4的色譜操作條件進行測定。
2 結 果
2.1 提取溶劑的選擇
分別比較了甲醇、乙腈、丙酮以及二氯甲烷作為提取溶劑對植煙土壤中的精喹禾靈、高效氟吡甲禾靈及精吡氟禾草靈的提取效果。結果表明,用甲醇和二氯甲烷提取時,有雜質峰干擾測定,而且精吡氟禾草靈的回收率低于50%;乙腈提取時,雖然雜質較少,但提取率低;而采用丙酮作為提取劑時,3種除草劑的提取率均有較大的提高,但有雜峰干擾,需進一步凈化。因此,對植煙土壤中3種除草劑的提取選丙酮作為提取溶劑。
在對水樣進行前處理時,選用二氯甲烷在對水中目標物進行提取時發現,只有精喹禾靈的回收率較高(80%~101%),而另外兩種目標物的回收率均低于70%,后通過往萃取體系中加入5%的丙酮后,3種目標物的回收率均有較大的提高,回收率均為88.9%~101.2%。這可能是因為丙酮的加入可以使二氯甲烷在水相中分散成細小的液滴,增大其與待萃取物的接觸面積,從而提高萃取效率。因此,水樣用二氯甲烷萃取時需加入5%的丙酮作為分散劑。
2.2 柱凈化條件的選擇
分別以二氯甲烷-甲醇(3:1,v:v)、二氯甲烷-甲醇(5:1,v:v)、二氯甲烷-丙酮(3:1,v:v)以及二氯甲烷-丙酮(5:1,v:v)作為柱淋洗液,考察其對3種除草劑與雜質分離效果的影響。結果表明,用二氯甲烷-甲醇作為洗脫液時,有一雜質峰干擾對精吡氟禾草靈的測定,且高效氟吡甲禾靈的峰形不好,拖尾嚴重。謝勇波等[13]對煙葉的高效氟吡甲禾靈殘留進行分析,用二氯甲烷-甲醇(5:1,v:v)作為洗脫液,可將高效氟吡甲禾靈與煙葉中雜質有效分離,而我們用其作為洗脫液不能將土壤中的雜質與3種目標化合物有效分開,這可能是由于土壤與煙葉中存在的雜質極性不同造成的。當把洗脫液中的甲醇換成極性比它弱的丙酮時,目標物與雜質分離較好,在用二氯甲烷-丙酮(3:1,v:v)洗脫時,3種目標化合物的回收率為 77.5%~110.3%,無雜質干擾測定,峰形良好。因此,選用二氯甲烷-丙酮(3:1,v:v)作為洗脫液。
2.3 HPLC條件的選擇與優化
2.3.1 檢測波長的選擇 高效氟吡甲禾靈、精吡氟禾草靈和精喹禾靈甲醇溶液的紫外光譜表明,其最大吸收波長分別為223、220、235 nm。當檢測波長為220 nm時,高效氟吡甲禾靈和精吡氟禾草靈的靈敏度較高,精喹禾靈有雜質峰干擾其測定;當檢測波長235 nm時,精喹禾靈的響應值大,靈敏度高,但是高效氟吡甲禾靈和精吡氟禾草靈的靈敏度低,不能滿足檢測要求;當檢測波長為223 nm時,盡管精喹禾靈的靈敏度度相對于在235 nm條件下稍有降低,但其峰形良好,高效氟吡甲禾靈和精吡氟禾草靈的靈敏度相對于在235 nm條件下均有大幅度提高,而且在此條件下雜質干擾也較少。因此,選擇223 nm作為檢測波長。
2.3.2 分離條件的優化 在流速為 0.6 mL/min不變的條件下,分別考察了不同體積比(70:30、75:25、80:20、85:15)的甲醇和水作為流動相時的分離效果。當柱溫為25 ℃,甲醇-水體積比為70:30時,在25 min內未見3種供試農藥出峰;當甲醇-水體積比為85:15時,3種供試農藥的保留時間變短,最遲出峰的農藥精喹禾靈的保留時間為14.27 min,但是精吡氟禾草靈和精喹禾靈不能完全分開,但當柱溫升高至35 ℃時,不僅3個目標化合物的響應值均增大,而且精吡氟禾草靈和精喹禾靈也能完全分開。故選擇在柱溫為 35 ℃,流動相為甲醇-水(85:15,v:v),流速為0.6 mL/min的條件下進行測定。其典型色譜圖見圖1。
2.4 線性關系
準確配制系列濃度為0.0050、0.05、0.10、0.50、1.00、5.00 mg/L的標準溶液,按所優選的條件進行測定,以峰面積y與相應的質量濃度x(mg/L)作標準曲線,得到相應的線性回歸方程:高效氟吡甲禾靈為y=71.949x+ 4.8899(R2=0.9996),精吡氟禾草靈為y=59.757x+ 4.0504(R2=0.9979),精喹禾靈為y=111.08x+ 6.8451(R2=0.9974),表明3種目標化合物在質量濃度為0.005~5.00 mg/L范圍內線性關系良好。
2.5 方法的回收率、精密度
在植煙土壤和水中,分別添加了高效氟吡甲禾靈、精吡氟禾草靈及精喹禾靈的混合標準溶液,設3個不同濃度水平,每個濃度水平樣品重復5次,按照前面優選的方法處理及測定,實驗結果見表1。結果表明,3種供試除草劑在土壤中的添加回收率為77.5%~110.3%,相對標準偏差為1.6%~10.2%,在水中的添加回收率為 88.9%~101.2%,相對標準偏差為0.9%~8.2%。此方法精密度和準確度均符合農藥殘留量分析與檢測技術的要求。
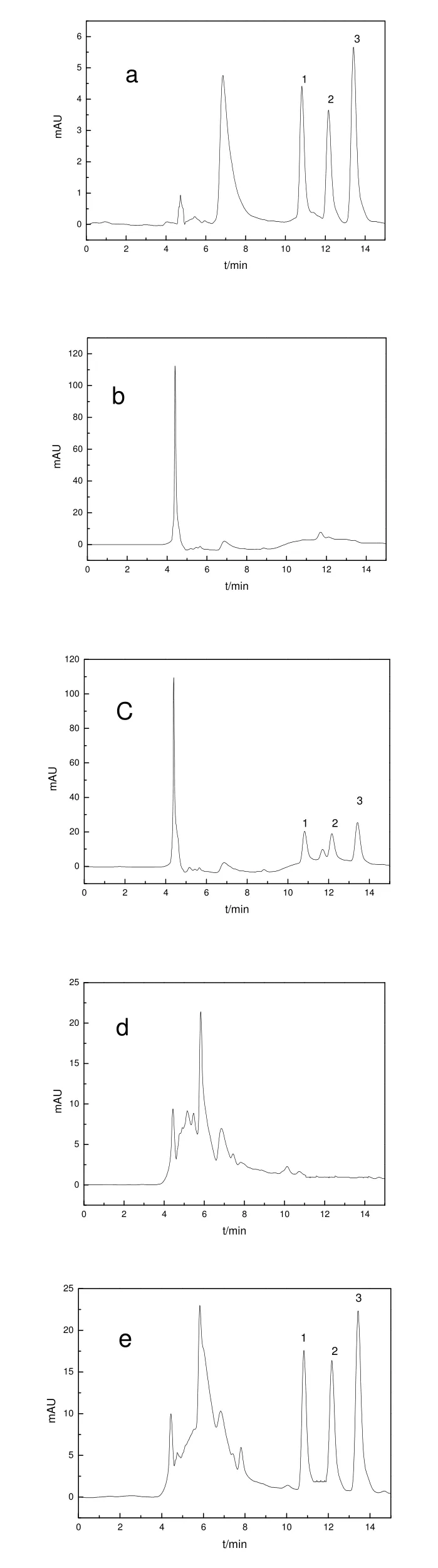
圖1 農藥標準溶液、空白樣品及其加標樣品的色譜圖Fig.1 Chromatograms of pesticide standard solution, blank and spiked samples
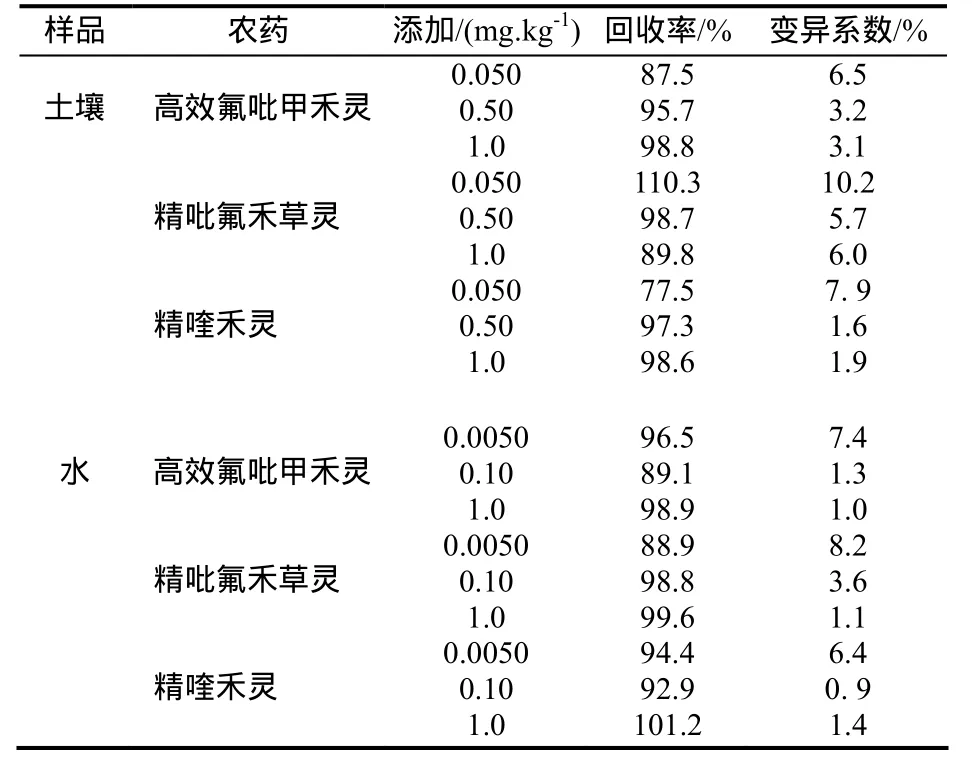
表1 高效氟吡甲禾靈、精吡氟禾草靈和精喹禾靈在土壤和水中的添加回收試驗Table 1 The spiked recoveries and relative standard deviations(RSD) of haloxyfop-p-methyl, fluazifop-p-butyl and quizafop-p-ethyl in soil and water
2.6 植煙環境中除草劑殘留分析
用所建立的方法可以對常用該類除草劑的土壤及周邊水體進行分析檢測,以便得知這幾種除草劑在環境中的殘留情況。本實驗對常用該類除草劑的湖南農業大學煙草基地的植煙土壤及周邊的河水、池塘水及水渠進行分析檢測,結果發現,一植煙土壤附近的水渠中存在精喹禾靈 0.016 mg/L殘留,其余植煙土壤和周邊水樣中均未檢測到。
3 結 論
建立了高效液相色譜法同時測定植煙土壤及水樣中3種常見的芳氧苯氧基丙酸酯類除草劑的分析方法。水樣使用二氯甲烷-丙酮(20:1,v:v)混合液提取,土壤樣品用丙酮提取,以弗羅里硅土凈化,二氯甲烷-丙酮(3:1,v:v)洗脫。該方法具有操作簡單、分離效果好、回收率高、精密度高等特點,符合農藥殘留分析要求,可用于植煙環境中土壤及水樣中3種常用芳氧苯氧基丙酸酯類除草劑殘留量的同時測定。
[1]Sakamoto M, Tsutsumi T.Applicability of head space solid-phase micro-extraction to the determination of multi-class pesticides in waters[J].Journal of Chromatography A, 2004, 1028(1): 63-67.
[2]韓熹萊.中國農業百科全書(農藥卷)[M].北京:農業出版社,1993:164-165.
[3]孫亞林,朱文達,陳文,等.精喹禾靈對夏大豆田間的控草效果和光照及養分的影響[J].華中農業大學學報,2009,28(2):161-163.
[4]Mustfa Y, Arikan E S.Genotoxicity testing of quizalofop-p-ethyl herbicide using the Allium cepa anaphase-telophase chromosome aberration assay[J].Caryologia, 2008, 61: 45-52.
[5]Elefsiniotis I S, Liatsos G D, Stamelakis D, et al.Case report: mixed cholestatic/hepatocellular liver injury induced by the herbicide quizalofop-p-ethyl[J].Environ.Health Perspect, 2007, 115: 1479-1481.
[6]Borjan M.Evidence on developmental and reproductive toxicity of quizalofop-ethyl[R].California: California Environmental Protection Agency (CEPA), 1999.
[7]Doganlar Z B.Quizalofop-p-ethyl-induced phytotoxicity and genotoxicity in Lemna minor and Lemna gibba[J].Journal of Environmental Science and Health, 2012,47(11): 1631-1643.
[8]Zhang X, Wang S, Wang Y, et al.Differential enantioselectivity of quizalofop-ethyl and its acidic metabolite:Direct enantiomeric separation and assessment of multiple toxicological endpoints[J].Journal of Hazardous Materials, 2011, 186: 876-882.
[9]俞少勇,陳日萍,陳彤,等.高效氟吡甲禾靈對大鼠睪丸生精細胞的損傷作用[J].毒理學雜質,2006,20(6):390-392.
[10]曾得意,施海燕,李波,等.氣相色譜法(NPD)測定水和土壤中精喹禾靈的殘留量[J].貴州大學學報:自然科學版,2006,23(2):184-187.
[11]蘇建峰,鐘茂生,張光軍,等.固相萃取-氣相色譜-質譜聯用測定蔥屬蔬菜中二甲嘧菌胺和吡氟禾草靈殘留量[J].應用化學,2010,27(5):590-593.
[12]田華,王延華.10.8%精喹禾靈水乳劑的高效液相色譜分析[J].應用化工,2011,40(7):1291-1289.
[13]謝勇波,周清明,龔道新,等.高效液相色譜法測定土壤、煙草和油菜中高效氟吡甲禾靈殘留[J].農藥,2011,50(3):209-212.
[14]李桂紅,張東飛,趙瑞,等.超高效液相色譜串聯質譜測定大豆和土壤中精喹禾靈的殘留分析方法[J].農藥科學與管理,2011,32(8):37-40.
[15]劉慧,曹趙云,張利強,等.分散固相萃取-液相色譜-串聯質譜法測定農產品中吡氟甲禾靈[J].分析實驗室,2011,30(3):83-86.
[16]Zeng D Y, Shi H Y, Li B, et al.Development of an enzyme-linked immunosorbent assay for quantitative determination of quizalofop-p-ethyl[J].Agricultural and Food Chemistry,2006, 54: 8682-8687.
[17]Bao H, Fang S, Liu Z, et al. Development of an enzyme-linked immunosorbent assay for the rapid detection of haloxyfop-p-methyl[J]. Journal of Agricultural and Food Chemistry, 2010, 58(14):8167-8170.

