黑加侖花色苷抗禽白血病A亞群病毒作用
雷用東, 王 丹, 童軍茂, 張 莉, 馬 越, 張 超, 趙曉燕*
(1.北京市農林科學院 蔬菜研究中心,北京 100097;2.石河子大學 食品學院,新疆 石河子 832003)
黑加侖(Blackcurrant),拉丁名 Ribes nigrum L.,學名黑穗醋栗,在我國東部地區廣泛種植[1]。研究發現,黑加侖花色苷提取物 (Anthocyanins from Blackcurrant,ACB)具有抑制肝細胞癌[2],清除自由基和抑制胃癌細胞增殖[3],減少動脈粥樣硬化血栓的形成,抗炎癥[4]和抗疲勞作用[5]等功能。禽白血病是由禽白血病病毒(Avian leukosis virus,ALV)引起的以造血細胞惡性增生為主的一類傳染病。目前ALV 分為A~J 10個亞群,A、B、C、D為外源性病毒,E為內源性病毒[6]。近年來,在我國不同規模的養雞場中,由雞群中經典外源性ALV-A感染而引起的惡性腫瘤的病例顯著上升,已給養殖業造成了很大經濟損失[7]。因此,作者在結合國內外對ACB的抗癌功能研究的基礎上,采用細胞模型,通過ACB對ALV-A誘導的DF1細胞形態學變化及細胞存活情況的影響,在體外開展其抗病毒活性的研究。本研究結果為ACB預防ALV-A病毒藥物的開發提供理論依據,并為人類預防白血病病毒提供新思路。
1 材料與方法
1.1 材料、試劑與儀器
黑加侖花色苷粉:購自北京綠色金可生物技術股份有限公司;DF1細胞、ALV-A病毒:由北京市農林科學院畜牧所提供;高糖DMEM培養基:購自Hyclone公司;胎牛血清(FBS):購自澳大利亞Gibco公司;胰蛋白酶:購自美國 BD 公司;3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴鹽 (MTT)、二甲基亞砜(DMSO):購自 Sigma 公司;鹽酸阿霉素(DOX):上海生工;其余試劑均為國產分析純。
液質聯用儀(HPLC 1200系列,MS 6310系列):Agilent公司;超凈工作臺YT-CJ-2NB:北京亞泰克隆實驗科技開發中心;倒置生物顯微鏡BDS200:OPTEC奧特光學;CO2水套式培養箱:Thermo公司;細胞自動計數分析儀CYT-100:CYTORECON公司;酶標儀550:Bio Rad公司。
1.2 實驗方法
1.2.1 黑加侖花色苷的主要成分分析
1)樣品制備:ACB粉首先用0.01 mol/L磷酸鹽緩沖液稀釋成質量濃度為1 mg/mL母液,0.22 μm針式過濾器過濾,-20℃保存備用。
2)HPLC分析條件:紫外檢測器,波長:520 nm;流動相:A 5%甲酸水溶液,B 100%乙腈;分離柱:C18(4.6 mm ×150 mm,5 μm)。進樣量 5 μL,流速 1 mL/min,柱溫25℃,梯度洗脫程序為:0~8 min,13%~22%B;8 ~15 min,22% ~23%B;15 ~20 min,23% ~100%B;20~25 min,100%B;25~26 min,100%~13%B;26~33 min,13%B。
3)MS分析條件:采用正離子模式,掃描范圍為100~1 500(m/z);N2流速為 12 L/min;噴霧器壓力為310 kPa;干燥氣溫度為350℃。
1.2.2 細胞培養 參照文獻[8]所描述的細胞培養方法,按體積比10∶1的胎牛血清與高糖DMEM培養基混合,在37℃、體積分數為5%的CO2培養箱中對DF1細胞常規培養,隔天傳代,調整細胞生長狀態,一般以傳代數為3~6生長良好的細胞,進行實驗。
1.2.3 黑加侖花色苷對DF1的毒性試驗 為了解ACB對DF1的細胞毒性,采用常規MTT實驗方法[9],取生長良好的DF1細胞(細胞懸浮濃度為2~3×105 cells/mL),每孔 200 μL,接種于 96 孔細胞培養板內,置于5%CO237℃培養24 h后,對照組不加ACB,樣品組每孔內分別加入ACB使其終質量濃度分別為 2、4、6、8、10、12、14 μg/mL,每個濃度設 6 個平行孔,然后置于培養箱內,分別在 24、48、72、96 h后,棄除培養液,每孔內分別入MTT溶液10 μL,37℃繼續孵育4 h后,終止培養,棄除上清液后,每孔加入170 μL二甲基亞砜,微量振蕩10 min,使MTT還原產物完全溶解,用酶標儀在490 nm處測定對照組和樣品組各孔吸光度(OD)值,通過OD值的大小間接反應ACB的細胞毒性。
1.2.4 黑加侖花色苷體外抗ALV-A活性試驗
1)黑加侖花色苷體外的預防病毒試驗:按照1.2.3 ACB對DF1的毒性試驗方法,取生長良好的200 μL細胞懸液,置于96孔細胞培養板內,約80%形成單層細胞,棄生長液,向孔中加入樣品稀釋后的樣品母液,使其終質量濃度為 2、4、6、8、10 μg/mL,37℃孵育1 h后,加入20 μL ALV-A病毒液再孵育1 h,2%FBS的細胞維持液每孔補至200 μL。分別在24、48、72、96 h后, 采用 MTT法在 490 nm 測定OD值。試驗設細胞對照、病毒對照和阿霉素對照,6個平行孔,3次重復實驗。
2)黑加侖花色苷體外的治療病毒試驗:同1.2.3方法,準備4個DF1長成約80%單層細胞的96孔板,棄生長液,每孔加20 μL ALV-A病毒液,37℃孵育1 h后,向孔中加入樣品母液,使其終質量濃度分別為 2、4、6、8、10 μg/mL, 細胞維持液補液體至200 μL。 分別培養至 24、48、72、96 h 后,采用 MTT法在490 nm測定OD值。
1.2.5 黑加侖花色苷與ALV-A對DF1細胞形態學試驗 按照1.2.4實驗方法,取生長良好的DF1細胞(細胞懸浮濃度為 5~7×105cells/mL),接種于 25 cm2細胞培養瓶中,置于5%CO2、37℃培養箱培養成單層,棄生長液,加入500 μL ALV-A病毒液,37℃孵育1 h后,向孔中加入ACB母液,使其終質量濃度分別為2 μg/mL和8 μg/mL,細胞維持液補液體至5 mL。試驗設細胞對照、病毒對照和治療對照。
1.2.6 數據統計分析 本實驗結果數據采用Origin8軟件作圖、Agilent ChemDF1ation Rev.A.09.01 software和DPS統計軟件分析,數據均以平均數和標準偏差(±SD)表示,采用 Duncan 新復極差多重比較。
2 結果與分析
2.1 黑加侖花色苷的HPLC-MS成分分析
黑加侖花色苷的HPLC色譜圖見圖1。
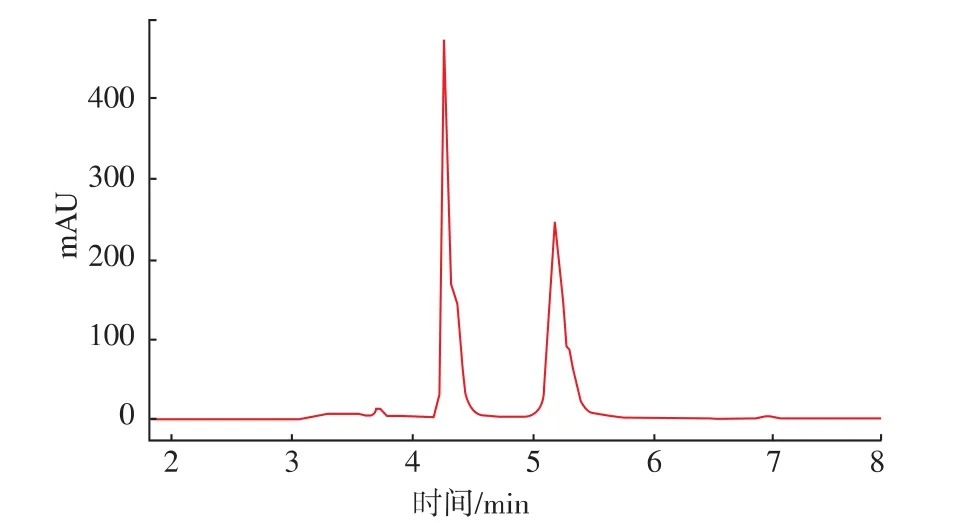
圖1 黑加侖主要花色苷的HPLC色譜圖(520 nm)Fig.1 HPLC profiles(520 nm) of the major anthocyanins from Blackcurrant
由圖1可知,黑加侖主要含兩種成分。作者鑒定出兩種花色苷,見表1,與文獻[10]鑒定花色苷組分相似,飛燕草及矢車菊素類花色苷為其主要成分。然而與前人研究結果不同的是,作者未檢測出天竺葵色素類花色苷,可能是黑加侖的品種、采收時間及其種植地域等因素導致。
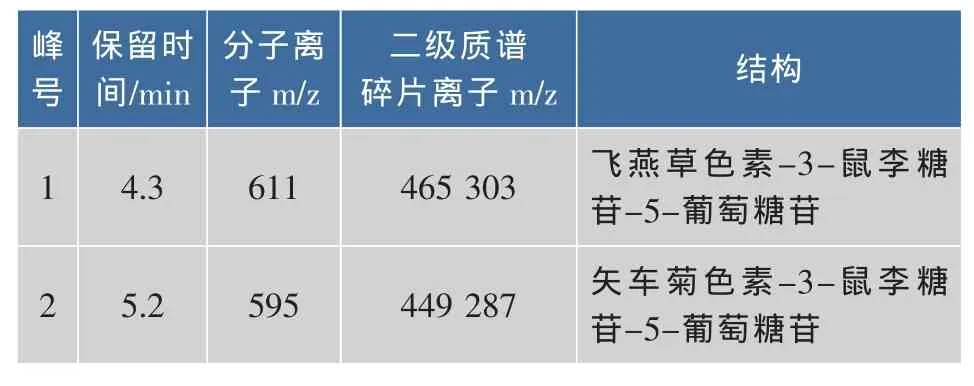
表1 黑加侖中主要的花色苷成分Table 1 Major anthocyanin components of Blackcurrant
2.2 黑加侖花色苷對DF1細胞毒性的研究
研究不同質量濃度的ACB對DF1單層細胞的毒性作用。從表2可以看出:細胞對照組在72 h與96 h的OD值大小一致,無顯著水平差異,說明96 h時為細胞生長達到最大程度的時間值。同一時間段下,當在質量濃度小于10 μg/mL各處理組,隨著ACB質量濃度的增加,OD值均比對照組高或者無水平差異,具有量效依賴性,說明ACB對 DF1細胞的生長有促進作用或者無毒性作用;當ACB質量濃度高于10 μg/mL,各處理組OD值與細胞對照相比,OD值呈下降趨勢,DF1生長受到不同程度抑制,有顯著性差異,差異具有統計學意義。在24、48、72、96 h四個時間段中,質量濃度小于10 μg/mL各處理組均顯著高于對照組,但是在時間上的水平差異并不顯著。本研究體外試驗時加入ACB,對正常DF1細胞的有無細胞毒性作用,當ACB質量濃度大于10 μg/mL時,各細胞組存活情況顯著下降,說明10 μg/mL是ACB對DF1細胞無細胞毒性的最大安全質量濃度。賈娜等[11]研究證實黑加侖花色苷具有清除自由基能力,推測ACB能清除細胞產生有害物質,因此一定質量濃度范圍內ACB可能提高了DF1細胞機能,從而促進其生長。
2.3 黑加侖花色苷體外抑制ALV-A活性的研究
阿霉素(DOX)為常見的抗腫瘤藥細胞毒類藥物,對白血病有明顯的治療效果[12]。本試驗前期已探討出DOX質量濃度為200 ng/mL對禽白血病A亞群有良好的治療效果,為本研究作為很好的藥物對照樣品。本實驗在ACB對DF1生長影響的最大質量濃度在10 μg/mL范圍內,展開對ACB抗ALV-A活性的研究。
表 2 ACB 對 DF1 細胞毒性(±s,n=6)Table 2 Cytotoxicity of ACB on DF1 cell(±s,n=6)
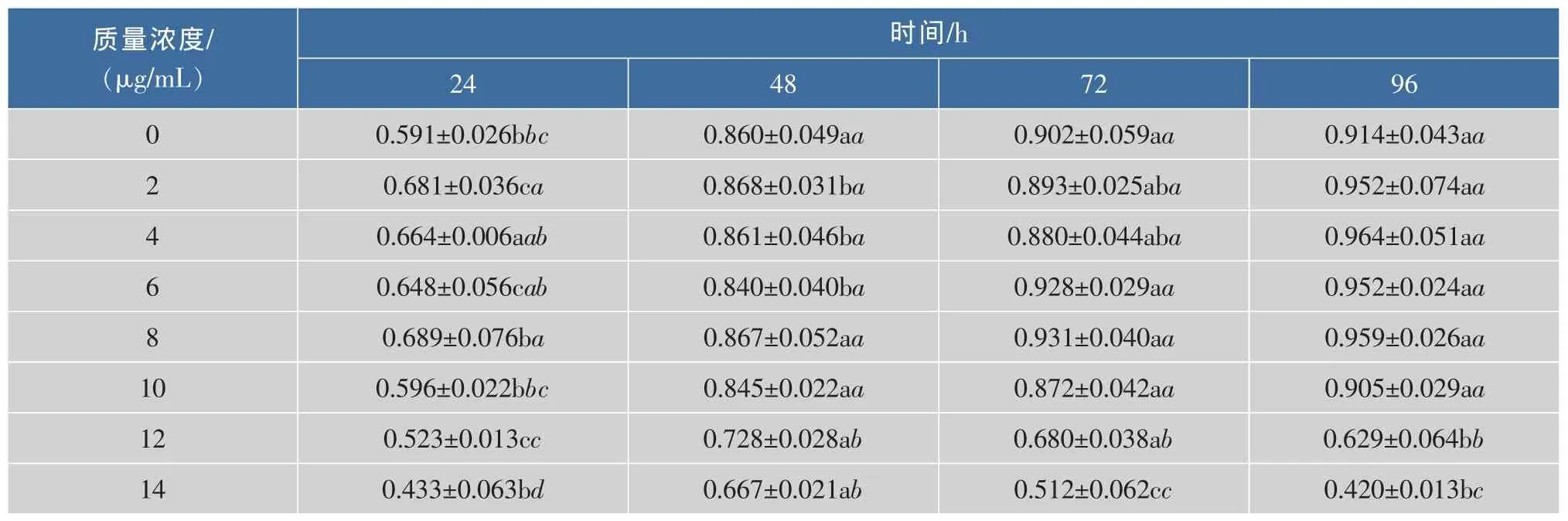
表 2 ACB 對 DF1 細胞毒性(±s,n=6)Table 2 Cytotoxicity of ACB on DF1 cell(±s,n=6)
注:采用Duncan新復極差多重比較法分析,不同字母表示每行時間之間的5%顯著水平差異,斜體字母表示每列質量濃度之間的5%顯著水平差異。
質量濃度/(μg/mL)2448時間/h 7296 0 2 4 6 8 1 0 12 14 0.591±0.026bbc 0.681±0.036ca 0.664±0.006aab 0.648±0.056cab 0.689±0.076ba 0.596±0.022bbc 0.523±0.013cc 0.433±0.063bd 0.860±0.049aa 0.868±0.031ba 0.861±0.046ba 0.840±0.040ba 0.867±0.052aa 0.845±0.022aa 0.728±0.028ab 0.667±0.021ab 0.902±0.059aa 0.893±0.025aba 0.880±0.044aba 0.928±0.029aa 0.931±0.040aa 0.872±0.042aa 0.680±0.038ab 0.512±0.062cc 0.914±0.043aa 0.952±0.074aa 0.964±0.051aa 0.952±0.024aa 0.959±0.026aa 0.905±0.029aa 0.629±0.064bb 0.420±0.013bc
2.3.1 黑加侖花色苷對ALV-A的預防試驗結果研究ACB對ALV-A的預防作用,即向DF1單層細胞預先加入ACB,再加入ALV-A感染細胞,起到預先防治作用。從表3可以看出,在各時間段下,藥物阿霉素對照的OD值均高于病毒組,有顯著性差異,說明阿霉素對ALV-A起到了治療作用。同一時間下,ACB各質量濃度處理組的DF1細胞OD值均顯著高于病毒對照組,具有量效依賴關系。其中72 h時,添加ACB質量濃度8 μg/mL的OD值為0.874,明顯高于病毒對照OD值0.789,有顯著性差異,說明在體外ACB質量濃度8 μg/mL對ALV-A病毒有一定的預防作用。在作用時間效應上,ACB對ALV-A抑制作用也比較明顯,但是在同質量濃度間差異性比較小。本實驗結果表明:ACB各質量濃度處理對ALV-A的具有預防作用,可明顯抑制ALVA在DF1細胞上的增殖。陶欣藝等[13]研究表明,花色苷能抑制氧化應激誘導的神經細胞凋亡,ACB可能通過提高細胞機體內的抗氧化酶類活性,減少由有害因素引起自由基的增加,從而減慢ALV-A在宿主細胞上的增殖。
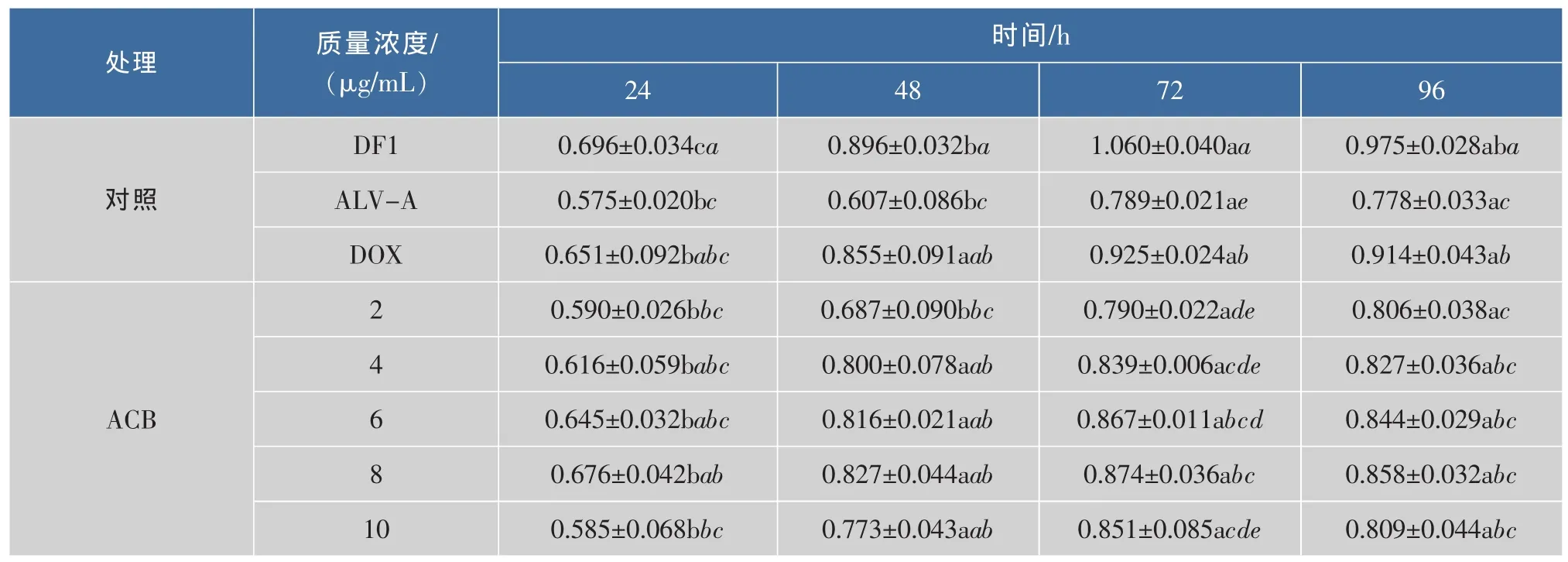
表3 不同質量濃度ACB體外對ALV-A的預防效果Table 3 Influence of prevention on ALV-A under different concentration of ACB in vitro
2.3.2 黑加侖花色苷對ALV-A的治療試驗結果研究ACB對ALV-A的治療作用,即加入ALV-A預先感染DF1單層細胞后,再用ACB處理,起到治療作用。從表4可以看出,阿霉素藥物治療對照組的各OD值均高于病毒組,治療效果明顯;同一時間下,ACB各質量濃度處理組的OD值均顯著高于ALV-A病毒對照組,隨著ACB質量濃度增加,其OD值逐漸上升,差異顯著,呈量效依賴關系。其中在72 h時,ACB質量濃度8 μg/mL時的OD值為0.843,與ALV-A病毒對照的OD值為0.753,呈顯著性差異。因此,在體外ACB對ALV-A病毒具有一定的治療作用。
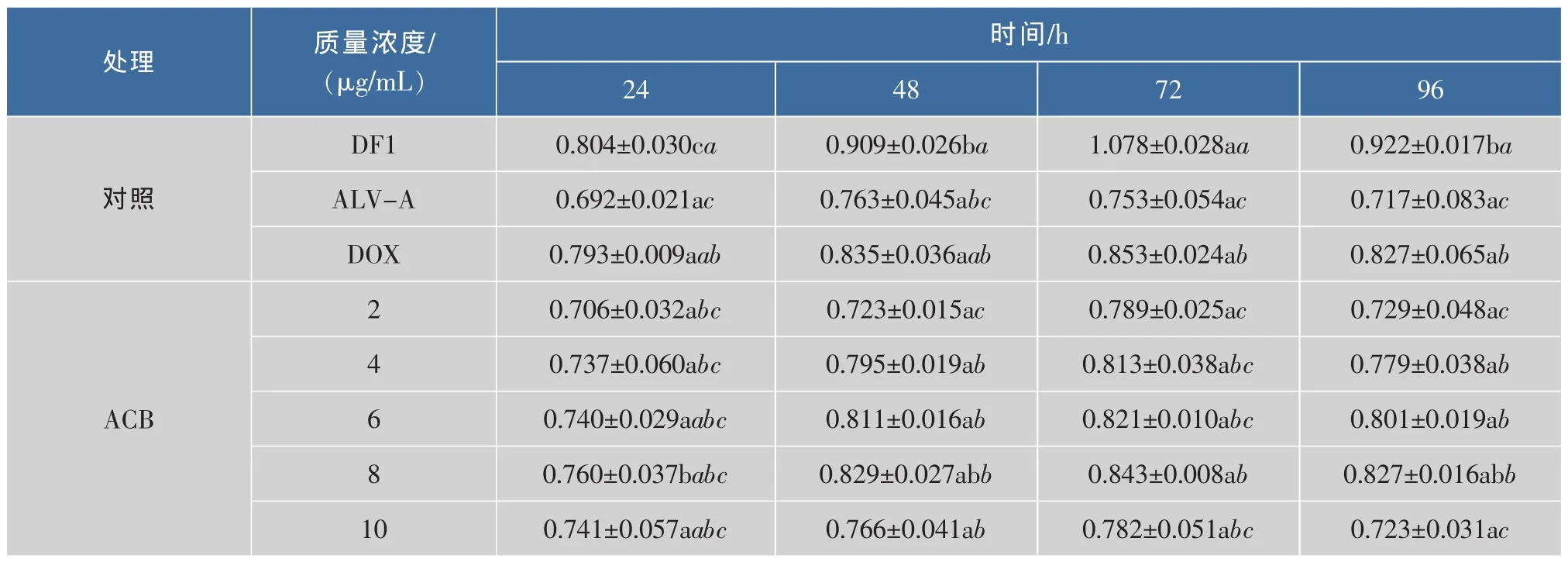
表4 不同質量濃度ACB體外對ALV-A的治療效果Table 4 Influence of treatment on ALV-A under different concentration of ACB in vitro
作者研究發現,ACB對ALV-A的預防作用比治療作用明顯。在相同質量濃度下,預防試驗的OD值比治療試驗的高,結果見表3,4。提示ACB對ALV-A的預防作用比治療作用顯著,推測這可能與細胞性繼發作用有關[14]。運用ACB進行干擾溶酶體膜通透性,減緩細胞自溶速度,從而保護正常細胞。因此,給家禽添加適量ACB的飼養,能增強機體的抗病毒能力,對ALV-A起到早期預防作用。
2.4 黑加侖花色苷與ALV-A對DF1細胞形態學的影響
觀察發現,DF1單層細胞感染ALV-A病毒后,一般在5 d左右出現比較明顯的病變,表現為細胞脫落、形態改變,或形成病斑。正常DF1形成單層細胞后,細胞呈長梭形或扁平星形,大小均勻[15]。生長至5 d,采用倒置顯微鏡圖顯示:圖2a為正常DF1細胞對照,細胞形態較為完整,有部分細胞脫離單層,是由于培養5 d后其營養物質的消耗和有害代謝產物積累而導致;圖2b顯示ACB質量濃度為8 μg/mL處理正常細胞,單層細胞表面完整,折光性好,無空隙,很少破碎死亡,細胞生長狀態良好;圖2C為DF1細胞受ALV-A病毒感染,出現明顯細胞形態完全改變,空泡化,大部分細胞已經脫離單層,發生嚴重的病變;圖2d為阿霉素藥物對照,只有少量細胞脫離單層,細胞形態較為完整;圖2e為ACB質量濃度2 μg/mL作用于ALV-A誘導的DF1形態,結果顯示有細胞脫離單層,細胞間隙增加,占70%的細胞保持單層狀態;圖2f顯示ACB質量濃度8 μg/mL作用于ALV-A誘導的DF1形態,細胞有部分脫落,約80%的細胞保持單層狀態,與圖2E比較,其細胞形態較好。因此,ACB能保護DF1的細胞形態,對ALV-A病毒繁殖有一定的抑制作用。
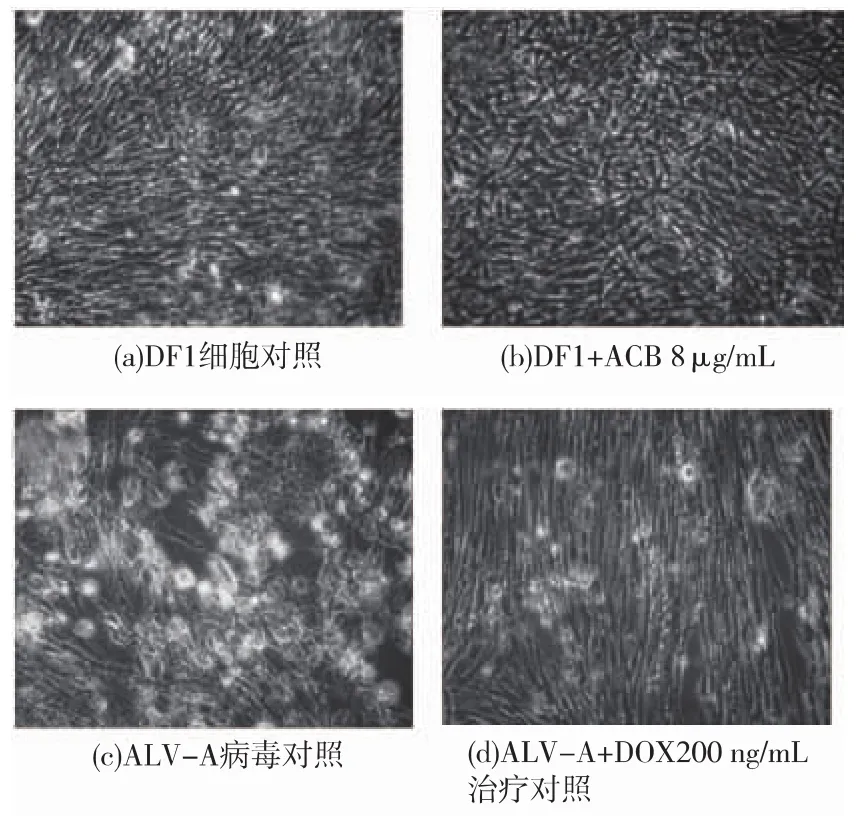
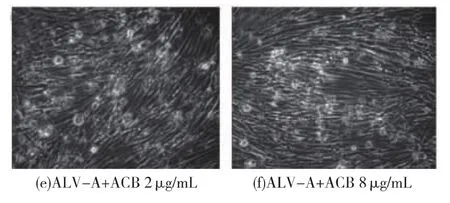
圖2 ACB對DF1細胞形態的影響(×250)Fig.2 Effect of ACB on DF1 cell morphology under microscope (× 250)
3 結語
目前我國對花色苷類作為抗病毒藥物的研究相對比較薄弱,主要集中在花色苷抗腫瘤的研究上,對禽白血病病毒的系統研究還不夠深入,對花色苷抗病毒的藥理作用研究才處于起步階段。作者通過研究表明,黑加侖含有飛燕草色素-3-鼠李糖苷-5-葡萄糖苷和矢車菊色素-3-鼠李糖苷-5-葡萄糖苷兩種主要花色苷成分;黑加侖花色苷在體外具有一定的抑制禽白血病A亞群病毒增殖作用,并隨劑量的增大呈量效依賴關系,同時對DF1細胞抵抗力有明顯的增強作用。作者用黑加侖花色苷混合物進行抗病毒研究,其抗病毒效果其含有的花色苷種類有關,具體哪種花色苷單體或者花色苷復合物起作用更佳,其確切機制還有待于深入研究。
[1]袁旭,張平,朱桂華.黑加侖色素穩定性研究[J].黑龍江八一農墾大學學報,2002,14(3):68-71.YUAN Xu,ZHANG Ping,ZHU Gui-hua.A study on the physicochemical properties of black current pigment[J].Journal of Heilongjiang August First Land Reclamation University,2002,14(3):68-71.( in Chinese)
[2]Bishayee A,Mbimba T,Thoppil J R,et al.Anthocyanin-rich black currant (Ribes nigrum L.) extract affords chemoprevention against diethylnitrosamine-induced hepatocellular carcinogenesis in rats[J].Journal of Nutritional Biochemistry,2011,22:1035-1046.
[3]Jia N,Xiong Y L,Kong B H,et al.Radical scavenging activity of black currant(Ribes nigrum L.) extract and its inhibitory effect on gastric cancer cell proliferation via induction of apoptosis[J].Journal off Functional Foods,2012,4:382-390.
[4]Kivimaki A S,Ehlers P I,Siltari A,et al.Lingonberry,cranberry and blackcurrant juices affect mRNA expressions of inflammatory and atherothrombotic markers of SHR in a long-term treatment[J].Journal off Functional Foods,2012,4:496-503.
[5]顧亞靜.黑加侖提取物抗疲勞作用及其機制的初步研究[D].烏魯木齊:新疆醫科大學,2008.
[6]Zavala G,Cheng S.Detection and characterization of avian leukosis virus in Marek's disease vaccines[J].Avian Diseases,2006,50:209-215.
[7]Zhang Q C,Zhao D M,Guo H J,et al.Isolation and identification of a subgroup a avian leukosis vrius from imported meat-type grandparent chickens[J].Virologica Sinica,2010,25(2):130-136.
[8]陳義勇,顧小紅,湯堅.樺褐孔菌多糖的抗腫瘤活性研究[J].食品與生物技術學報,2011,30(1):65-69.CHEN Yi-yong,GU Xiao-hong,TANG Jian.Study on anti-tumor activities of polysaccharides from Inonotus obliquus[J].Journal of Food Science and Biotechnology,2011,30(1):65-69.(in Chinese)
[9]李雁群,張蓮芬,張志斌,等.苦參靈芝發酵液在2.2.15細胞中抗HBV作用[J].無錫輕工大學學報,2004,23(2):98-10.LI Yan-qun,ZHANG Lian-fen,ZHANG Zhi-bin,et al.The lnhibitory effects of fermentation broth of Ganoderma lucidum in the 2.2.15 cell with addition of radix sophorae flavescentison HBV[J].Journal of Wuxi University of Light Industry,2004,23(2):98-10.(in Chinese)
[10]Bordonaba J G,Crespo P,Terry L A.A new acetonitrile-free mobile phase for HPLC-DAD determination of individual anthocyanins in blackcurrant and strawberry fruits:A comparison and validation study[J].Food Chemistry,2011,129:1265-1273.
[11]賈娜,孔保華,張洪濤.黑加侖花色苷的提取及抗氧化活性研究[J].食品科學,2011,32(16):162-166.JIA Na,KONG Bao-hua,ZHANG Hong-tao.Extraction and antioxidant activity of anthocyanins from blackcurrants[J].Food Science,2011,32(16):162-166.(in Chinese)
[12]李戈,季麗娟,黃建鳴.槲皮素誘導和增加HL-60白血病細胞對阿霉素的反應性 [J].中國小兒血液與腫瘤雜志,2009,14(1):12-15.LI Ge,JI Li-juan,HUANG Jian-ming.Impact of Quercetin on adriamycin sensitivity and responsiveness in acute myeloid leukemic HL-60 cells[J].Journal China Pediatr Blood Cancer,2009,14(1):12-15.(in Chinese)
[13]陶欣藝,盧艷花,周文瑜,等.歐洲越桔和篤斯越桔對神經細胞氧化損傷的保護作用[J].中國臨床康復,2005,33(9):50-53.TAO Xin-yi,LU Yan-hua,ZHOU Wen-yu,et al.Protective effects of Vaccinium myrtillus L.and Vaccinium uliginosum L.on oxidative damage in neural cells[J].Chinese Journal Clinical Rehabilitation,2005,33(9):50-53.(in Chinese)
[14]沈斌,杭春華.炎性細胞因子在腦外傷繼發性腦損害中的作用及研究進展[J].醫學綜述,2011,17(11):1621-1624.SHEN Bin,HANG Chun-hua.Effects and research advancement of inflammatory cytokines in brain damage after traumatic brain injury[J].Medical Recapitulate,2011,17(11):1621-1624.(in Chinese)
[15]張青禪.A亞群禽白血病病毒不同分離株的基因組和生物學特性比較究[D].泰安:山東農業大學,2010.

