外源NO對Pb脅迫下亞麻幼苗的保護效應
李宇潔,安 梅
(蘭州職業(yè)技術(shù)學院,甘肅 蘭州 730070)
植物生長過程中,常常會遭受到重金屬離子如鉛、汞、鎘、砷、鋅等的污染[1~3]。鉛是一種具有對植物強毒性的重金屬,鉛土壤污染是當今世界面臨的主要環(huán)境問題之一[4],土壤中的鉛被植物吸收后,可導致植物中毒,特別是導致植物根部、植株等形態(tài)生理變化[5]。亞麻(Linseed)在逆境脅迫下的生理生化指標變化已有大量報道,如水、鹽、干旱、鎘等協(xié)迫[6~9],但關(guān)于Pb污染方面的研究未發(fā)現(xiàn)報道。一氧化氮(NO)在植物光態(tài)建成、生長發(fā)育、衰老等過程和對非生物脅迫的響應中有重要作用[10]。有研究表明,NO可以緩解非生物脅迫下植物氧化損傷,其效應與NO處理濃度有關(guān)[11~12],低濃度的NO能夠緩解鹽脅迫對燕麥和番茄葉片的氧化性損傷,能夠有效提高鎘離子脅迫下亞麻幼苗葉片自我保護效應[6,13~14]。我們研究Pb脅迫與不同濃度SNP(NO供體)處理下亞麻的生理生化指標變化,旨在探討Pb脅迫下亞麻防御機理以及NO在植物逆境中的作用。
1 材料與方法
1.1 供試材料
指示亞麻品種為隴亞10號。
1.2 試驗方法
試驗共5個處理,處理A,對照(CK);處理B,0.2mmol/LPb(Ac)2;處理C,0.1mmol/LSNP+0.2 mmol/L Pb(Ac)2;處理D,0.5 mmol/L SNP+0.2 mmol/L Pb(Ac)2;處理E,1.0 mmol/L SNP+0.2 mmol/LPb(Ac)2。3次重復。
挑選飽滿的亞麻種子,用蒸餾水沖洗浸泡12 h,再用0.1%升汞溶液消毒30 s,然后播種育苗。幼苗長至4片葉后移栽到裝有已滅菌蛭石的花盆,每盆30株。每隔2 d澆1/8濃度的Hogland營養(yǎng)液100 mL,保持濕度在60%~70%。生長35 d后,選取生長整齊一致、健康的亞麻植株按試驗設(shè)計進行SNP預處理,即分別量取50mL不同濃度SNP溶液噴施于葉面,每隔24 h處理1次,連續(xù)處理3次。第3次處理后24 h,在蛭石中施加有0.2m mol/LPb(Ac)2的Hogland營養(yǎng)液100mL,每隔24 h處理1次,連續(xù)處理4次。施Pb(Ac)2前及處理后24、48、72、96 h采集生長狀況一致的幼苗葉片,取0.5 g幼苗葉片,用茚三酮顯色法測定游離脯氨酸(Pro)含量[15],用硫代巴比妥酸法測丙二醛(MDA)含量[16]。再取各處理幼苗葉片0.5 g,加入pH 7.8的0.05mol/L磷酸緩沖液(含1%PVP)研磨成勻漿,定容至10mL,在4℃、10 000 rpm下離心20min,取清液備用[17]。分別用NBT顯色法測定過氧化氫酶(CAT)活性[18]、用愈創(chuàng)木酚氧化法測定過氧化物酶(POD)活性[19]、紫外吸收法測定超氧化物歧化酶(SOD)的活性[20]。
數(shù)據(jù)采用Excel 2003整理,使用SPSS 18.0分析。
2 結(jié)果與分析
2.1 Pb脅迫下SNP處理對亞麻幼苗中脯氨酸(Pro)含量的影響
逆境條件能夠誘發(fā)植物脯氨酸含量積累。脅迫開始時各處理亞麻幼苗葉片內(nèi)Pro含量無顯著差異(P>0.05)。隨著脅迫時間的延長,處理B、D、E逐漸升高(圖1),均在96 h后Pro含量達到最大值;而處理C卻隨著脅迫時間的延長呈先升后降再升高的趨勢,在96 h時達到最大值。在脅迫的各個時間段,SNP處理的Pro含量均低于處理B,說明SNP處理可以緩解Pb脅迫下植物氧化損傷,其中處理C效果最明顯,Pro含量較B處理在48、72與96 h時分別降低了44.42%、30.12%、29.86%(P<0.01)。可知,SNP處理可以顯著緩解葉片氧化損傷,降低Pro的積累速度。
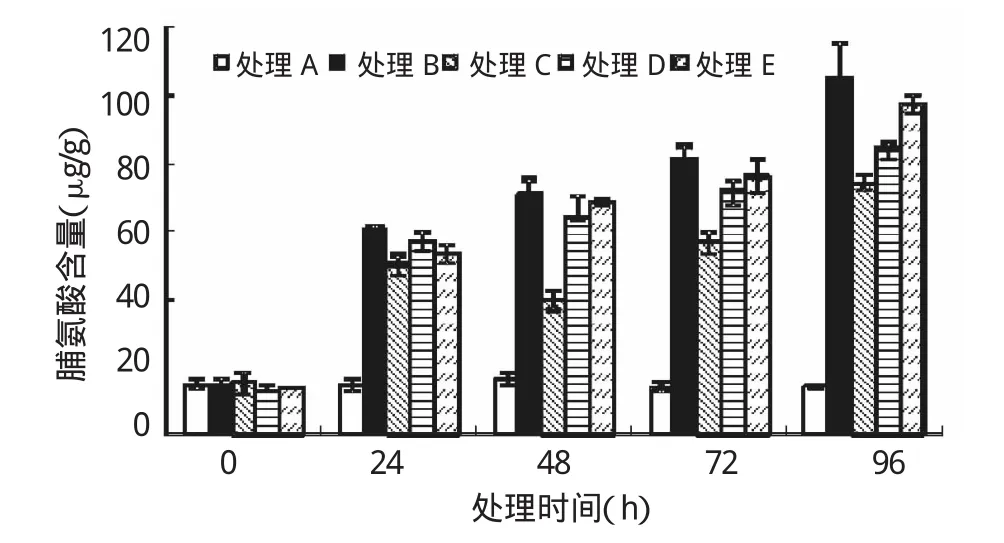
圖1 外源NO對Pb脅迫下亞麻幼苗中脯氨酸的影響
2.2 Pb脅迫下SNP處理對亞麻幼苗中丙二醛(MDA)含量的影響
由圖2可知,脅迫開始時各處理含量無顯著差異(P>0.05)。隨脅迫時間的延長,處理B、E葉片內(nèi)MDA含量隨之逐漸升高,在96 h時達到最大值,與對照差異極顯著(P<0.01),較對照提高190.64%、159.15%;處理C、D中MDA含量逐漸升高,至72 h時達到最大值,與對照差異極顯著(P<0.01),較對照提高136.88%、140.92%,而后隨之降低。SNP處理在脅迫各時間段,其MDA含量均低于單純Pb脅迫(處理B)。至96時處理C、D、E的MDA含量較處理B降低了44.21%(P<0.01)、13.35%(P<0.05)、12.15%(P<0.05),其中以處理C效果最佳。由此看出,SNP能夠緩解Pb協(xié)迫下亞麻幼苗葉片中MDA含量的升高。
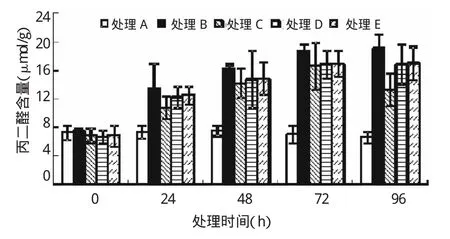
圖2 外源NO對Pb脅迫下亞麻幼苗中丙二醛的影響
2.3 Pb脅迫下SNP處理對亞麻幼苗中抗氧化酶(SOD、CAT和POD)活性的影響
由圖3可知,在Pb脅迫96 h內(nèi),SNP對亞麻幼苗SOD、CAT和POD活性具有顯著的影響。Pb脅迫開始時,SNP各處理CAT活性均高于單純脅迫(處理B)。隨著Pb脅迫時間的延長,處理B、C、D、E中CAT活性呈先升高后逐漸降低的趨勢,在24 h時CAT活性達到最大值,均高于對照處理,其中以處理C效果顯著(P<0.05),較處理B提高了14.30%;24 h后,各處理CAT活性均快速下降,處理B下降程度較處理C、D、E快,至96 h達到最低值,均低于對照處理,其中以處理C的CAT活性下降速率最慢。可知,外源SNP能夠降低Pb脅迫幼苗葉片CAT活性的下降速率,提高CAT活性,以處理C效果最為顯著。
脅迫初期,SNP處理POD活性均高于對照。隨著脅迫時間的延長,POD活性呈先升高后下降的趨勢(圖3b)。在48 h時,Pb、SNP處理組POD活性達到最大值,其中處理C的POD活性最大,較對照提高了122.04%(P<0.01);隨著脅迫時間延長,各處理組POD活性均下降,其中處理B的POD活性下降速率最大,在96 h降至最低,顯著低于對照(P<0.05)和處理C(P<0.01)。說明外源NO可提高亞麻幼苗逆境下POD活性。
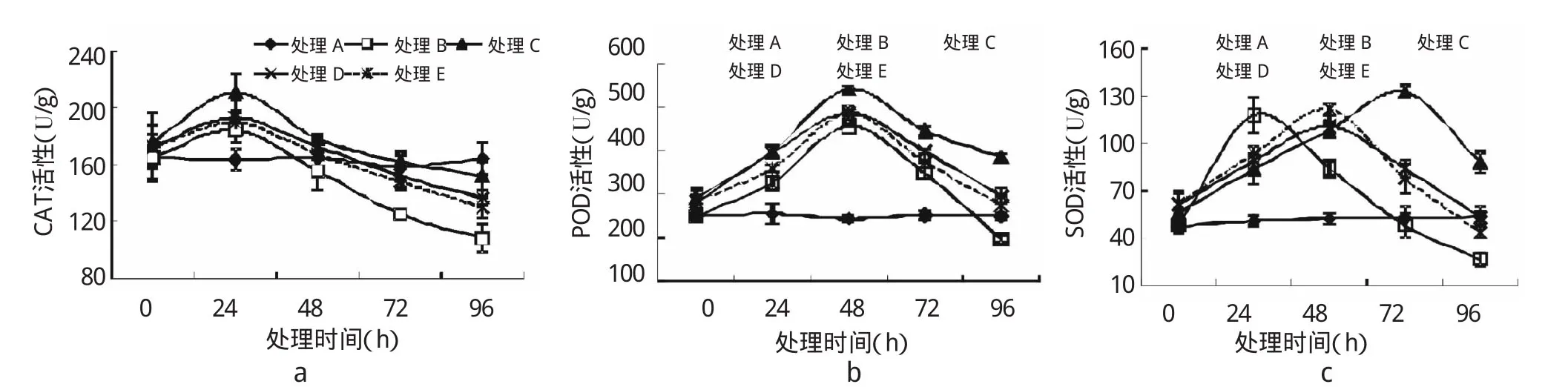
圖3 外源NO對Pb脅迫下亞麻幼苗中SOD、CAT、POD酶活性的影響
由圖3c可知,在脅迫初期,SNP各處理SOD活性均高于對照;隨著脅迫時間的延長,處理B、C、D、E的SOD活性呈先升高后下降的趨勢。其中處理B在24 h時SOD活性達到最大值;處理D、E在48 h達到最大值;處理C在72 h時達到最大值,說明SNP處理可緩解亞麻幼苗超氧陰離子的生成。其后降低過程中處理B中SOD活性下降速率最快,處理C最慢,說明處理C效果最佳。
3 小結(jié)與討論
1) 研究結(jié)果表明,NO緩解了Pb脅迫下亞麻幼苗葉片中丙二醛含量的升高,促進脯氨酸含量升高,提高了過氧化氫酶、過氧化物酶、超氧化物歧化酶等抗氧化酶的活性,減緩抗氧化酶的活性Pb脅迫下的下降速率,緩解葉片受到的氧化損傷。且保護效應與SNP的濃度相關(guān),0.1mmol/LSNP處理效果顯著優(yōu)于1.0mmol/LSNP處理。即NO具有清除植物體內(nèi)活性氧,促進抗逆性物質(zhì)的積累,調(diào)節(jié)抗氧化酶活性的功能。
2)植物在逆境脅迫時,植物體內(nèi)會產(chǎn)生大量的活性氧,若逆境時間過長就會導致細胞受到氧化損傷,引發(fā)細胞膜脂質(zhì)過氧化反應,導致細胞膜裂解和丙二醛含量增加。本研究對丙二醛含量測定的結(jié)果說明,外源NO對細胞膜具有良好的保護作用,可減輕Pb脅迫對其造成的傷害,這與王憲葉等人外源NO能夠緩解滲透脅迫下的小麥幼苗葉片膜脂過氧化,提高其抗性的結(jié)論吻合[21]。
3)植物體內(nèi)脯氨酸的積累在一定程度上反映了植物的抗逆性。本研究表明,外源NO能促進Pb脅迫下亞麻幼苗葉片中游離脯氨酸含量的積累,這與NO不僅可以提高黑麥草的抗冷性和番茄的抗鹽性[14,22],還能增強了亞麻的抗重金屬Pb能力,以及李源等人在蠶豆上取得的結(jié)果相吻合[23]。
4)Pb脅迫對這3種抗氧化酶的誘導效果并不一致,這可能與Pb脅迫過程中SOD、POD和CAT在膜脂質(zhì)過氧化過程所起的不同作用有關(guān),如SOD可以清除超氧陰離子,其產(chǎn)物是過氧化氫,過氧化氫含量的增加,導致了CAT失活。同時,H2O2和O2-有可能與CAT形成復合物,抑制了CAT的活性[24]。
[1]夏增祿, 穆從如,孟維奇,等.Cd、Zn、Pb及其相互作用對煙草小麥的影響[J].生態(tài)學報,1984,4(3):231-236.
[2]安建平,焦成瑾,王廷璞,等.Cd2+脅迫對黃瓜幼苗生物膜損傷和保護酶的影響[J].甘肅農(nóng)業(yè)科技,2006(4):4-7.
[3]任繼凱,陳清朗,陳靈芝,等.土壤中鎘、鉛、鋅及其相互作用對作物的影響[J].植物生態(tài)學與地植物學叢刊,1982,6(4):320-329.
[4]SHEN ZG,LIX D,WANG CC,et al.Lead phytoextraction from contaminated soil with high-biomass plant species[J].Environ.Qual.,2002,31:1893-1900.
[5]楊元根,PATERSON E,CAMPBELL C.城市土壤中重金屬元素的積累及其微生物效應[J].環(huán)境科學,2001,22(3):44-48.
[6]徐 嚴,魏小紅,李兵兵.外源NO對重金屬Cd脅迫下亞麻幼苗葉片抗氧化能力的影響[J].甘肅農(nóng)業(yè)大學學報,2012,47(5):45-49.
[7]張曉平,薛召東,郝冬梅,等.亞麻耐漬的生理機制研究初探[J].中國麻業(yè)科學,2007,29(3):169-172.
[8]王紅梅,金忠民,孫雪瑰,等.鹽脅迫對亞麻幼苗生長的影響[J]. 齊齊哈爾大學學報,2015,21(4):87-89.
[9]王曉琦,沙 偉,徐忠文.亞麻幼苗對干旱脅迫的生理響應[J]. 作物雜志,2005(2):13-15.
[10]張緒成,上官周平,高世銘.NO對植物生長發(fā)育的調(diào)控機制[J]. 西北植物學報,2005,25(1):812-818.
[11]BELIGNIM V,LAMATTINA L.Is nitric oxide toxic or protective[J].Trends in Plant Science,1999,4(8):229-300.
[12]BELIGNIM V,LAMATTINA L.Nitric oxide protects against cellular damage produced bymethylviologen herbicides in potato plants[J].Nitric Oxide,1999,3(3):199-202.
[13]蘇 桐,龍瑞軍,魏小紅,等.外源NO對NaCl脅迫下燕麥幼苗氧化損傷的保護作用[J].草業(yè)學報,2008,17(5):48-53.
[14]蘇 桐,魏小紅,丁學智,等.外源NO與蔗糖對鹽脅迫下番茄幼苗氧化損傷的保護效應[J].生態(tài)學報, 2008,28(4):1558-1564.
[15]趙福庚,劉友良.大麥幼苗多胺合成比脯氨酸合成對鹽脅迫更敏感[J]. 植物生理學報,2000,26(4):243-349.
[16]趙世杰,許長成,鄒 琦,等.植物組織中丙二醛測定方法的改進[J]. 植物生理學通訊,1994,30(3):207-210.
[17]李合生.植物生理生化實驗原理與技術(shù)[M].北京:高等教育出版社,2000:260-261.
[18]CHANDER M S.Enzymic associationswith resistance to rust and pow deymildew in pea[J].Indian Journal of Horticulture,1990,47(3):341-345.
[19]孫 群,胡景江.植物生理學研究技術(shù)[M].楊凌:西北農(nóng)林科技大學出版社,2006:113-115.
[20]DHINDSA R S,PLUMB D P,THORPE T A.Leaf senescence correlated with increased levels ofmembrane permeability and lipid peroxidation and decreased levels dismutase and catalase[J].Journal of Experimental Botany,1982,32:91-101.
[21]王憲葉,沈文彪,徐朗萊.外源NO對滲透脅迫下小麥幼苗葉片膜脂過氧化的緩解作用[J].植物生理與分子生物學報,2004,3(4):195-200.
[22]馬向麗,魏小紅,龍瑞軍,等.外源一氧化氮提高黑麥草抗冷性機制的研究[J].生態(tài)學報,2005,25(6):1269-1274.
[23]李 源,李金娟,魏小紅.鎘脅迫下蠶豆幼苗抗氧化能力對外源NO和H2O2的響應[J].草業(yè)學報,2009,18(6):186-191.
[24]ASADA K.The water-water cycle in chlorop lasts:scavenging of active oxygens and dissipation of excess photons[J].Annual Review of Plant Physiology and PlantMolecular Biology,1999,50:601-639.

