復合酶對紅菇娘果漿酶解條件的優化
徐 偉,李迎楠,高雪清,馬永強
(哈爾濱商業大學食品工程學院,黑龍江 哈爾濱 150076)
復合酶對紅菇娘果漿酶解條件的優化
徐 偉,李迎楠,高雪清,馬永強
(哈爾濱商業大學食品工程學院,黑龍江 哈爾濱 150076)
以紅菇娘為原料、還原糖含量及出汁率為指標,在單因素試驗基礎上,采取正交試驗優化紅菇娘果漿適宜的酶解條件。結果表明:紅菇娘果漿酶解最優工藝條件為:復合酶添加量0.3g/L、酶解溫度65℃、酶解時間70min。在此條件下得到的紅菇娘果漿還原糖含量為52.1mg/g,出汁率為83.26%。使用復合酶酶解紅菇娘果漿可有效提高其還原糖含量和出汁率。
紅菇娘;復合酶;酶解條件;還原糖含量
紅菇娘,學名酸漿(Physalis alkekengi L. var. franchetii),為茄科酸漿屬多年生草本植物,野生資源豐富,主要生長在黑龍江、吉林等地[1]。紅菇娘果實中含有豐富的礦物質、人體所需的必需氨基酸及多種生物活性物質[2],具有降壓、抗菌、抗癌等功效[3-7]。紅菇娘常作為藥物被廣泛用于治療傷口愈合、風濕、發熱等疾病[8-9],是一種果藥兼用的經濟植物。
紅菇娘果實中富含黃酮、酸漿苦素、類胡蘿卜素等功能性成分[10-12],并具有一定的加工特性[13],使得它在食品、醫藥領域中日益受到重視。紅菇娘果肉中含有一定量的果膠質、纖維素、木質素等固形物[14],破碎后果汁十分黏稠,使其在果漿生產中壓榨取汁困難,澄清難度加大,導致產品出現混濁、沉淀等現象[15]。復合酶由果膠酶、纖維素酶、木聚糖酶、β-葡聚糖酶組成[16],其中果膠酶可以軟化果肉和果皮組織中的果膠物質,通過降解果膠的多糖鏈,將其分解成半乳糖醛酸和果膠酸[17];纖維素酶分解纖維素產生寡糖和纖維二糖,最終水解為葡萄糖[18];木聚糖酶可將半纖維素降解為低聚糖和木糖[19];β-葡聚糖酶可以水解植物細胞壁中的結構性非淀粉多糖[20]。選用該復合酶處理紅菇娘果漿,能夠明顯降低果漿的黏度,提高出汁率;使果漿中功能性成分充分地溶出;并且有效抑制果漿褐變,增加澄清度及穩定性[21-22]。本研究采用單因素和正交試驗法優化紅菇娘果漿酶解的工藝條件,減少其在加工過程中的損失,以期為紅菇娘果漿的工業化生產提供理論依據。
1 材料與方法
1.1 材料與試劑
酸漿屬紅菇娘果實來源為黑龍江省依蘭縣。
復合酶:果膠酶(≥15萬U/mL)、纖維素酶(≥10萬U/ mL)、木聚糖酶(≥5萬U/mL)、β-葡聚糖酶(≥5萬U/mL)寧夏和氏璧生物技術有限公司;硅藻土、DNS、酒石酸鉀鈉、3,5-二硝基水楊酸均為國產分析純。
1.2 儀器與設備
BS 224S電子天平 賽多利斯科學儀器(北京)有限公司;UV-9100紫外-可見分光光度計 北京瑞利分析儀器公司;XMTD-204數顯恒溫水浴鍋 天津市歐諾儀器儀表有限公司;JYL-C022料理機 九陽股份有限公司;電子萬用爐 北京市永光明醫療儀器有限公司;高速離心機 北京京立離心機有限公司;循環水式多用真空泵 鄭州長城科工貿有限公司。
1.3 方法
1.3.1 紅菇娘果漿制備
完全成熟的紅菇娘,去除宿萼、果柄后,進行清洗,按照料水比1:1(g/mL)加蒸餾水打漿,得到新鮮的紅菇娘果漿[23]。此時,紅菇娘果漿還原糖含量為47.3mg/g,出汁率為77.16%。
1.3.2 還原糖含量測定
配制1.0mg/mL葡萄糖標準溶液,分別取0.0、0.2、0.4、0.6、0.8、1.0、1.2mL,加入1.5mL DNS試劑后,沸水中加熱5min,流動水冷卻至室溫;加入21.5mL水定容后,在波長540nm處測其吸光度[24]。得到葡萄糖標準曲線方程為:y=0.263x-0.0219(R2=0.9997)。
將一定量的果漿5000r/min條件下離心處理15min,取2mL上清液,按標準溶液的測定方法測定540nm波長處吸光度,根據標準方程計算還原糖含量。
1.3.3 單因素試驗
1.3.3.1 酶添加量對紅菇娘果漿酶解的影響
取紅菇娘果漿分別添加復合酶0、0.05、0.1、0.2、0.3、0.4、0.5g/L,充分攪拌后50℃水浴酶解50min,取出后采用硅藻土真空抽濾、靜置,測定還原糖含量和出汁率。1.3.3.2 酶解溫度對紅菇娘果漿酶解的影響
取紅菇娘果漿分別添加復合酶0.2g/L,充分攪拌后在45、50、55、60、65、70℃水浴酶解50min,取出后采用硅藻土真空抽濾、靜置,測定還原糖含量和出汁率。
1.3.3.3 酶解時間對紅菇娘果漿酶解的影響
取紅菇娘果漿分別添加復合酶0.2g/L,充分攪拌后50℃水浴,分別酶解30、40、50、60、70min,取出后采用硅藻土真空抽濾、靜置,測定還原糖含量和出汁率。
1.3.4 正交試驗
為確定適宜酶解條件,在單因素試驗基礎上,以酶添加量(A)、酶解溫度(B)、酶解時間(C)3個因素進行正交試驗,通過測定還原糖含量、出汁率指標,進行差異顯著性分析,找出影響果漿品質的主要因素和適宜組合,確定紅菇娘果漿適宜酶解工藝條件。
1.3.5 分析測定方法
還原糖的測定:3,5-二硝基水楊酸比色法[24];出汁率的測定:紅菇娘果漿保溫滅酶結束后,采用硅藻土真空抽濾,得到紅菇娘果汁。按下式計算出汁率。
出汁率/%=(紅菇娘果汁質量/紅菇娘果漿質量)×100
2 結果與分析
2.1 單因素試驗
2.1.1 酶添加量對紅菇娘果漿酶解的影響
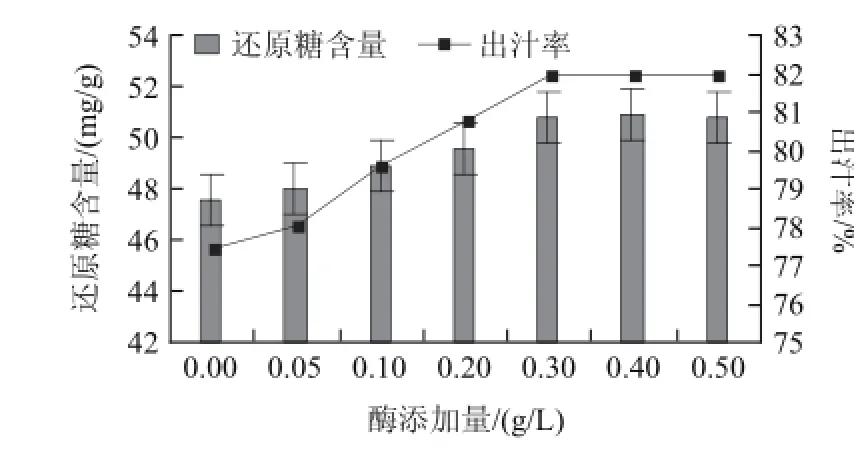
圖1 酶添加量對紅菇娘果漿酶解的影響Fig.1 Effect of enzyme dosage on reducing sugar content and juice yield
圖1 顯示,隨著復合酶添加量的增加(0~0.3g/L),酶促反應速度逐漸增加。紅菇娘表皮及果肉中的纖維素、果膠質等開始分解,還原糖含量和出汁率逐漸增加;復合酶作為一種生物催化劑,與底物的吸附作用具有一定的飽和度,當復合酶用量達到飽和時,增加酶用量對紅菇娘果漿酶解作用影響不大[25]。當復合酶的添加量大于0.3g/L后,紅菇娘果漿還原糖含量和出汁率不再隨酶用量的增加而提高。復合酶的添加量過大,會增加生產成本,并影響紅菇娘果漿的口味。因此,復合酶酶解紅菇娘果漿適宜的添加量為0.3g/L,此時,紅菇娘果漿還原糖含量為50.8mg/g,出汁率為81.94%。
2.1.2 酶解溫度對紅菇娘果漿酶解的影響
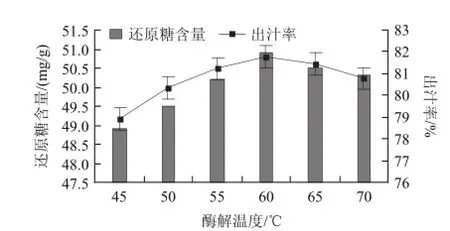
圖2 酶解溫度對紅菇娘果漿酶解的影響Fig.2 Effect of hydrolysis temperature on reducing sugar content and juice yield
一般情況下,纖維素酶最適反應溫度為45~65℃,果膠酶最適反應溫度為50~60℃,β-葡聚糖酶最適反應溫度為20~55℃,木聚糖酶最適反應溫度為50~60℃。各種酶都有其最適溫度,在其最適溫度條件下酶活最高[26]。過高的溫度,可能使酶蛋白變性,酶的活性也因此受到影響[25]。圖2顯示,隨著溫度的升高(45~60℃),還原糖含量和出汁率也逐漸增加,復合酶對果漿細胞破壞作用加強;升高溫度還能提供酶解反應所需的能量[27];同時纖維素、果膠、可溶性蛋白質、氨基酸等大分子物質的溶解度隨溫度升高而增大[28]。因此,復合酶酶解紅菇娘果漿適宜的溫度為60℃,此時,紅菇娘果漿還原糖含量為50.9mg/g,出汁率為81.78%。
2.1.3 酶解時間對紅菇娘果漿酶解的影響
圖3顯示,隨著酶解時間的延長(30~60min),紅菇娘果漿的出汁率及還原糖含量隨之增加。紅菇娘細胞壁吸水漲破,使細胞中的原生質體破裂需要一定的時間。紅菇娘果漿中的果膠在果膠酶作用下分解,生成小分子果膠酸[17];其中的纖維素及半纖維素最終水解為還原糖[18]。當酶解時間長于60min時,紅菇娘果漿的出汁率及還原糖含量與酶解60min時相比,幾乎不再增加。隨著反應時間的延長,紅菇娘果漿中的維生素、酸漿多糖等營養物質受到不同程度的損失[26];而且酶解時間過長,相對成本升高,不利于工業生產。因此,紅菇娘果漿適宜的酶解時間為60min,此時,紅菇娘果漿還原糖含量為50.8mg/g,出汁率為82.02%。
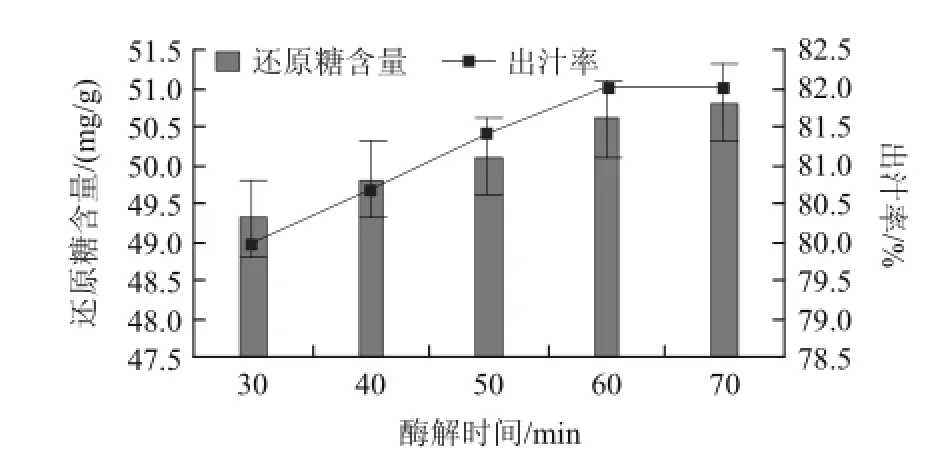
圖3 酶解時間對紅菇娘果漿酶解的影響Fig.3 Effect of hydrolysis time on reducing sugar content and juice yield
2.2 正交試驗
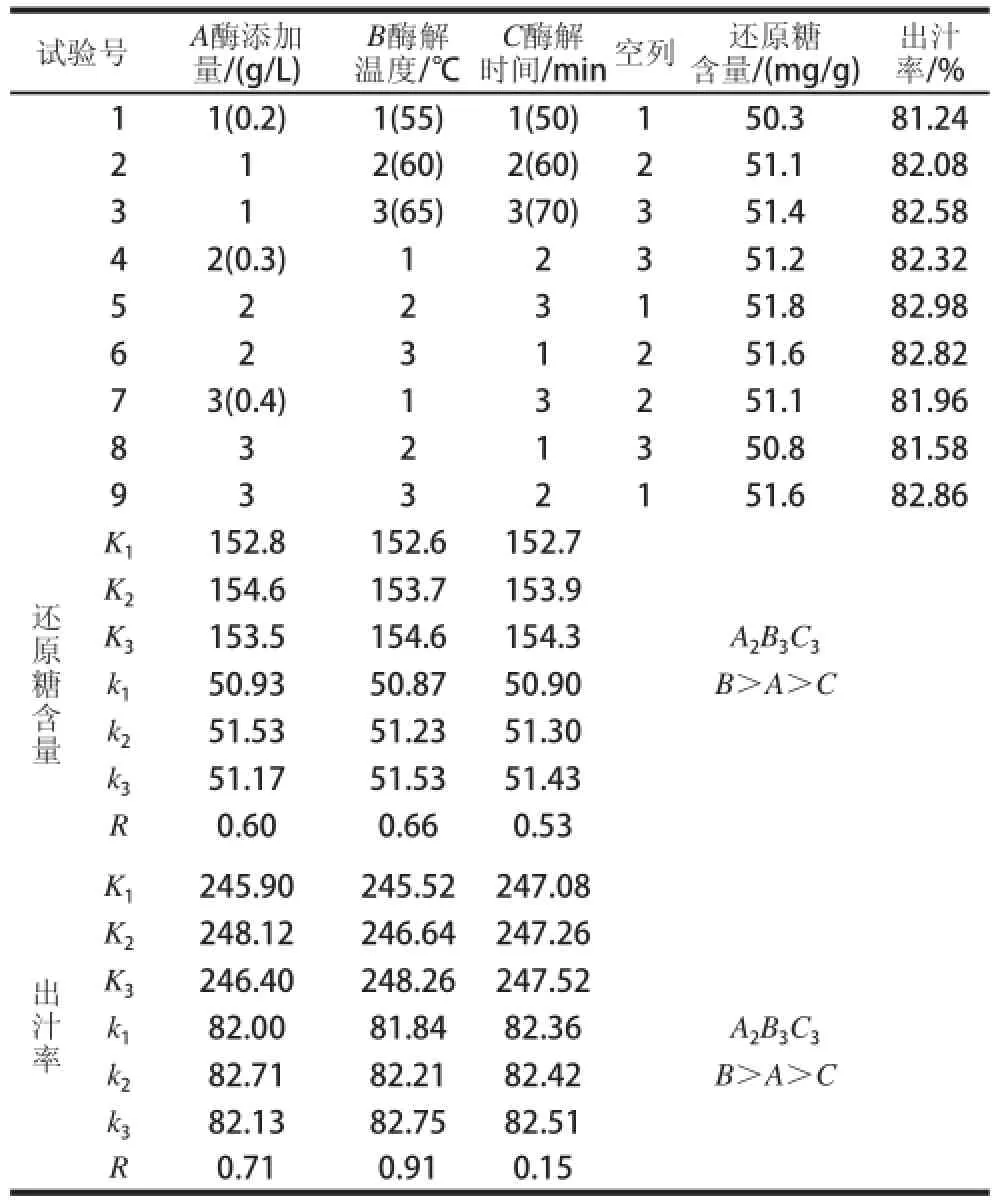
表1 正交試驗設計與結果Table1 Orthogonal array design and results

表2 方差分析Table2 Analysis of variance for reducing sugar content and juice yield
因素試驗和正交試驗,根據計算的k值可以看出,紅菇娘酶解的適宜組合為A2B3C3。即復合酶添加量0.3g/L、酶解溫度65℃、酶解時間70min。經驗證,在此條件下,紅菇娘果漿還原糖含量可達52.1mg/g,出汁率可達83.26%。本實驗采用極差分析法和方差分析法對各因素進行比較分析。由表1、2可知,從極差大小看,各因素影響出汁率及還原糖含量的主次順序是:酶解溫度>酶添加量>酶解時間;此外,方差分析可以看出,溫度對出汁率及還原糖含量的影響顯著(顯著水平設為P<0.05)。綜上分析可以說明,酶解溫度是影響紅菇娘果漿酶解的主要因素。酶添加量及酶解時間對紅菇娘果漿酶解的影響不顯著。
3 結 論
果漿中含有較多的纖維素、果膠、半纖維素、色素等,在長期的儲藏過程中容易發生混濁,甚至發生沉淀,使果漿品質下降[15]。復合酶由果膠酶、纖維素酶、木聚糖酶、β-葡聚糖酶組成,使用該復合酶酶解紅菇娘果漿,增加了其還原糖含量和出汁率,并可以除去大部分易形成沉淀的成分,保持果漿在較長時間內的澄清狀態,保持長期的穩定性[22]。本實驗復合酶酶解紅菇娘的適宜條件為:復合酶添加量0.3g/L、酶解溫度65℃、酶解時間70min。此時,紅菇娘果漿還原糖含量可達52.1mg/g,出汁率可達83.26%。實驗所得到的果漿香味濃郁,顏色紅亮,穩定性好,保持了原有果實的營養成分和保健功能。此外,復合酶酶解對紅菇娘主要功能成分黃酮、酸漿苦素、類胡蘿卜素等物質溶出過程的影響仍有待進一步研究。
[1] 張天民, 付波. 牡丹江市應大力發展毛酸漿栽培[J]. 中國林副特產, 2006(4): 109-110.
[2] 楊曉虹, 陳滴, 周曉平, 等. 酸漿果實無機元素和氨基酸的含量測定[J]. 人參研究, 2000, 12(2): 34-36.
[3] 國家藥典委員會. 中華人民共和國藥典: 一部[M]. 北京: 化學工業出版社, 2000: 296.
[4] ROW L R, RWDDY K S, DHAVEJI K, et al. Pubescenol, a withnolide from physalis pubescence[J]. Phytochemistry, 1984, 23(2): 427-430.
[5] 李萍, 盛巡, 王曉中, 等. 錦燈籠酸漿苦素B對活化多形核中性粒細胞化學發光及H2O2產生的影響[J]. 中國病理生理雜志, 1996, 12(6): 626-627.
[6] 袁呂衡, 周啟貴, 楊飛, 等. 80種中藥水煎液對淋球菌的抑制試驗[J].中國醫院藥學雜志, 1997, 17(11): 508-509.
[7] MAKINO B, OHYA J. Cytotoxic activity of physalins possessing modified skeletal structures against HeLa cells[J]. Pharmazie, 2002, 57(l): 70-71.
[8] ANKRAH N A, NYARKO A K, ADDO P G, et al. Evaluation of efficacy and safety of a-herbal medicine used for the treatment of malaria[J]. Phytother Research, 2003, 17(6): 697-701.
[9] CHOI E M, HWANG J K. Investigations of anti-inflammatory and antinociceptive activities of Piper cubeba, Physalis angulata and Rosa hybrida[J]. Ethnopharmacol, 2003, 89(1): 171-175.
[10] 徐保利, 管慧潔, 李慧, 等. 錦燈籠果實總黃酮提取工藝[J]. 中國實驗方劑學雜志, 2011, 17(21): 33-35.
[11] 李坤, 刁云鵬, 王明東, 等. 錦燈籠果實的化學成分研究[J]. 有機化學, 2010, 30(1): 128-131.
[12] 宋春梅, 張嵐, 葛紅娟, 等. 酸漿類胡蘿卜素的體外抗氧化活性研究[J]. 時珍國醫國藥, 2011, 22(12): 2943-2944.
[13] 王文利. 毛酸漿果醋的工藝研究[D]. 吉林: 吉林農業大學, 2012.
[14] 葛玉, 段玉峰, 劉俊花, 等. 黑龍江酸漿果實及宿萼的成分分析[J].營養學報, 2006, 28(6): 529-530; 533.
[15] 帥希祥, 梁瑞紅, 李俶, 等. 果膠酶澄清南酸棗汁的工藝優化[J]. 食品工業科技, 2013, 34(2): 231-237.
[16] 葛亮. 酶法提高新疆若羌灰棗出汁率的工藝[J]. 食品研究與開發, 2012, 33(9): 27-29.
[17] 張瑤, 蒲彪, 劉云等. 枇杷果漿酶解工藝的響應曲面法優化[J]. 食品科學, 2010, 31(14): 106-110.
[18] 顧方媛, 陳朝銀, 石家驥, 等. 纖維素酶的研究進展與發展趨勢[J].微生物學雜志, 2008, 28(1): 83-86.
[19] 萬紅貴, 王濤, 蔡恒, 等. 木聚糖酶的特性及應用研究[J]. 食品與發酵工業, 2008, 34(3): 92-95.
[20] 韓晶, 李寶坤, 李開熊, 等. β-葡聚糖酶的特性與應用研究[J]. 中國釀造, 2008(17): 4-7.
[21] LANDBO A, KAACK K, MEYER A S. Statistically designed two step response surface optimization of enzymatic prepress treatment to increase juice yield and lower turbidity of elderberry juice[J]. Innovative Food Science and Emerging Technologies, 2007, 8: 135-142.
[22] 龐彩霞, 金英姿. 果膠酶在果蔬飲料中的應用[J]. 內蒙古農業科技, 2008(1): 81-82.
[23] 張圓圓, 王寶剛, 馮曉元, 等. 正交實驗優化酸櫻桃果汁酶解工藝研究[J]. 食品工業科技, 2012, 33(17): 190-193.
[24] 趙凱, 許鵬舉, 谷廣燁. 3,5-二硝基水楊酸比色法測定還原糖含量的研究[J]. 食品科學, 2008, 29(8): 534-536.
[25] 張洪淵, 萬海清. 生物化學[M]. 北京: 化學工業出版社, 2007: 116-117.
[26] 楊芙蓮, 聶小偉. 不同酶解條件對提取紅棗汁效果的探討[J]. 陜西科技大學學報, 2010, 28(4): 37-40.
[27] 劉軍海, 楊海濤, 刁宇清. 復合酶法提取茶多酚工藝條件研究[J]. 食品與機械, 2008, 24(3): 74-80.
[28] 武永福. 酶在速溶綠茶浸提中的應用研究[D]. 重慶: 西南大學, 2011.
Optimization of Enzymatic Hydrolysis Conditions for the Production of Chinese Lantern (Physalis alkekengi) Juice
XU Wei,LI Ying-nan,GAO Xue-qing,MA Yong-qiang
(College of Food Engineering, Harbin Commercial University, Harbin 150076, China)
The enzymatic hydrolysis of pulped Chinese lantern by mixed proteases was optimized using orthogonal array design to increase reducing sugar and juice yield. The optimal enzymatic hydrolysis conditions were determined as 0.3 g/L, 65 ℃ and 70 min for enzyme dosage, temperature and time, respectively. The reducing sugar content and juice yield obtained under these conditions were 52.1 mg/g and 83.26%, respectively. This study indicates that both parameters can be increased by the enzymatic treatment.
Chinese lantern (Physalis alkekengi);mixed proteases;enzymatic hydrolysis condition;reducing sugar content
TS255.4
A
1002-6630(2013)18-0114-04
10.7506/spkx1002-6630-201318023
2013-04-15
徐偉(1963—),女,教授,博士,研究方向為微生物發酵工程。E-mail:xuw@hrbcu.edu.cn

