油茶EMF2基因的全長cDNA克隆及序列分析
鄔萌萌,譚曉風 ,周 榮,詹文勇 ,胡孝義
(1.安徽農業大學 林學與園林學院,安徽 合肥 230036;2.中南林業科技大學 經濟林育種與栽培國家林業局重點實驗室,湖南 長沙 410004;3.安徽省油茶良種工程技術研究中心,安徽 舒城 231340)
油茶Camellia oleifera是我國重要的木本油料樹種[1],廣泛分布于我國南方各省區[2]。油茶秋季開花,春季果實才開始膨大,這期間缺少昆蟲等傳粉媒介,這對其坐果率有一定的影響[3]。因此,改變油茶的花期對于油茶生產具有重大意義。EMF2(EMBRYONIC FLOWER2)基因是植物抑制開花而維持正常營養生長的一個應激基因。當EMF2基因的抑制作用解除后,植物才能實現營養生長向生殖生長的轉變[4-5]。有關研究者發現,EMF2基因編碼PcG蛋白復合物的一個亞基,該復合物能引發許多與開花相關基因的抑制基因位點的核小體組蛋白H3K27me3(組蛋白H3的N端第27位賴氨酸的3甲基化)水平[6-7]。H3K27me3標記由PRC2復合物引發,被PRC1樣復合物識別并維持[8-10],它們的功能缺失都能減弱或消除H3K27me3,導致幼嫩的芽苗也能夠分化出花器官。因此,有關CoEMF2的研究對于油茶開花機理的研究具有重要意義。擬南芥EMF2蛋白正是PRC2復合物的核心組件[11],而目前有關油茶EMF2基因的研究尚未見諸報道。為此,筆者基于茶樹Camellia sinensis EMF2同源基因的一個片段,采用 3′RACE(RACE System for Rapid Amplification of cDNA Ends) 和 5′RACE技術對CoEMF2 基因的全長cDNA進行克隆,同時對基因全長和編碼蛋白進行序列分析與理化性質研究,結果發現了CoEMF2蛋白中含有VEFS-Box結構域和C2H2型鋅指蛋白兩個保守區,這為油茶從芽到開花的誘導的進一步研究提出了新思路。
1 材料和方法
1.1 材 料
實驗所用材料為“華鑫”油茶的組織培養幼苗[12],來自中南林業科技大學經濟林育種與栽培國家林業局重點實驗室。
1.2 方 法
1.2.1 油茶葉片的總RNA提取及反轉錄
采用Invitrogen的總RNA提取Kit(12183-018),并加入CTAB(Cetyltrimethyl Ammonium Bromide上海生工生物工程有限公司),以裂解法提取油茶葉片的總RNA,再用Invitrogen的RACE Kit(18373-019)、(18374-058)進行反轉錄。
1.2.2 特異引物設計及RACE擴增
參照茶樹Camellia sinensis EMF2基因的一個片段,設計3′RACE和5′RACE的首輪及巢式特異引物(見表1)。

表1 特異引物序列Table 1 Sequence of special primers
PCR反應體系(25 μL):5×HS PCR Buffer(Mg+plus)5.0 μL,dDTP Mixture(2.5 mM) 2.0 μL,primer(10 μM)0.5 μL,AUAP(10 μM)0.5 μL,模版 1.0 μL,PrimerSTAR HS DNA Polymerase 0.25 μL,滅菌蒸餾水15.75 μL。
PCR反應程序:94 ℃預變性5 min;94 ℃變性30 s,分別在72、70、68 ℃下退火30 s,72 ℃延伸80 s,每個退火溫度各循環5次;94 ℃變性30 s,65 ℃下退火30 s,72 ℃延伸80 s,20個循環;最后72 ℃延伸8 min,4 ℃下保存。
電泳檢測巢式PCR結果,采用Ambiogen公司的Puprep Gel Extraction Kit回收和純化目的條帶,連接于TransGen公司的pEASYTM-Blunt Zero Cloning Vector載體后,轉化DH5α感受態,于37 ℃下培養,挑選單菌落進行菌液PCR檢測,并將含有目的片段的陽性克隆送至博尚公司測序。
1.2.3 目的基因的全長cDNA克隆及分析
將測序得到的EMF2基因3′端和5′端序列進行拼接,并在NCBI網站上進行比對,獲得油茶EMF2基因的全長cDNA序列。利用Vector NTI軟件獲得油茶EMF2基因理論上的開放讀碼框,并進行氨基酸序列比對;用AnthePro5.0軟件對蛋白跨膜結構進行預測;在網址http://www.expasy.org/cgi-bin/protscale.pl上分析和預測蛋白的親疏水性;采用網址http://www.predictprotein.org/分析蛋白質二級結構;在網址http://cello.life.nctu.edu.tw上進行亞細胞定位預測。
2 結 果
2.1 油茶葉片總RNA的提取結果
油茶葉片總RNA提取后的電泳檢測結果如圖1所示。圖1顯示,28 S與18 S條帶清晰明亮,兩者的總亮度約處于2∶1的狀態中,符合反轉錄和RCAE的實驗要求。

圖1 油茶葉片總RNA提取結果Fig.1 Detection of total RNA in C. oleifera leaf
2.2 目的基因的 3′RACE 與 5′RACE
3′RACE首輪PCR電泳檢測結果顯示,雖然有兩個大小不同的條帶,但經巢式PCR擴增后,檢測到的僅有單一清晰的條帶,約900 bp,進一步進行巢式PCR驗證,結果與預計的相符(如圖2左所示)。5′RACE產物目的條帶十分明亮,約1 700 bp,如圖2右所示。

圖2 3′RACE產物與5′RACE產物的電泳圖Fig.2 Electrophoresis distribution of 3′RACE and 5′RACE products
2.3 CoEMF2基因的全長cDNA序列分析
3′RACE 和 5′RACE 測 序 得 到 892 和 1 801 bp的片段,將二者進行拼接,獲得序列2 210 bp(如圖3所示,圖3的方框為起始和終止密碼子,下劃線為PolyA尾),包含1個完整的1 866 bp CDS 及 37 bp 5′UTR 和 307 bp 3′UTR,編碼621個氨基酸。將其與其它物種EMF2氨基酸序列進行在線比對,結果發現,其與茶樹、葡萄、毛果楊的同源性分別高達97%、80%、81%。因此推測,該序列為油茶EMF2基因的全長cDNA序列。
通過NCBI在線比對后發現,油茶EMF2蛋白含有一個高度保守的VEFS-Box家族區域(如圖4所示)。其中VEFS是VRN2-EMF2-FIS2-Su(z)12的簡稱,VRN2(VERNALIZATION2)為春化作用相關基因[13]、FIS2(FERTILIZATION INDEPENDENT SEEDS2)是胚乳發育相關基因[14]、Su(z)12是染色質表達及精細胞形成的相關基因[15]。
與其它植物該蛋白質序列進行系統樹分析,結果如圖5所示。圖5表明,油茶與茶樹EMF2的親緣關系最接近,在氨基酸序列和保守元件VEFS-Box上也極為相似。根據上述分析結果可以初步斷定,所獲得的序列為油茶EMF2基因的全長cDNA序列,并命之名為CoEMF2。

圖3 油茶EMF2基因的全長cDNAFig.3 Full-length cDNA sequence of C.oleifera EMF2 gene

圖4 油茶EMF2蛋白的保守結構域Fig.4 Conserved domains in C. oleifera EMF2 protein

圖5 油茶與其它物種EMF2的親緣進化關系Fig.5 Phylegenetic tree of EMF2 in C. oleifera and other species
2.4 理化性質分析與結構預測
借助在線軟件分析預測蛋白質的理化性質:CoEMF2的ORF編碼621個氨基酸,分子量為70.54 KD;等電點為6.17,其中負電荷氨基酸殘基(Asp+Glu)的數目為78,正電荷氨基酸殘基(Arg+Lys)的數目為70;分子式可寫成C3108H4875N867O936S37;不穩定系數為53.04,屬于不穩定蛋白質。
疏水性的分析結果如圖6所示。圖6表明,CoEMF2蛋白的疏水指數從-2.733到2.978(橫坐標為氨基酸順序,縱坐標為親、疏水值;“-”表示親水性,“+”表示疏水性),疏水區大于親水區,因此推測,CoEMF2為疏水性蛋白。該蛋白有兩個跨膜區域:分別位于N端的137~153位,方向由外向內;C端的573~591位,跨膜方向由內向外(如圖7所示)。
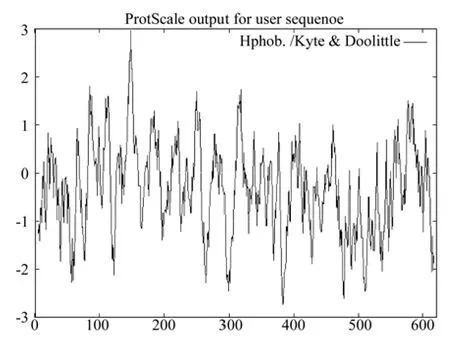
圖6 油茶EMF2蛋白質疏水性分析結果Fig.6 Hydrophobicity analysis of C. oleifera EMF2 protein

圖7 油茶EMF2蛋白跨膜區預測結果Fig.7 Prediction on membrane-spanning region in C. oleifera EMF2 protein
卷曲螺旋預測結果表明,CoEMF2蛋白質中可能存在8個較為明顯的螺旋結構。Predictprotein軟件預測的CoEMF2蛋白的二級結構如圖8所示。圖8中,H表示α螺旋,E表示β折疊,L表示無規則卷曲。該蛋白α螺旋結構為21.74%,β折疊10.95%,無規則卷曲及其它結構67.31%。CoEMF2蛋白的312-333位氨基酸處存在一個C2H2型鋅指蛋白(Zinc finger protein),該蛋白依靠其指型空間結構伸入到DNA雙螺旋的大溝內,通過α螺旋與DNA的堿基形成特異性接觸[16],有助于PRC2復合體結合到染色質上,進而對染色質進行標記修飾。
2.5 亞細胞定位和修飾位點預測
在http://cello.life.nctu.edu.tw網址上對CoEMF2進行亞細胞定位預測,結果見表2。由表2可知,其位于細胞核中的可靠性最高。運用KinasePhos軟件在線對CoEMF2蛋白序列修飾位點進行預測,結果表明了含有55個絲氨酸激酶、25個蘇氨酸激酶、15個酪氨酸激酶潛在磷酸化位點、1個組氨酸磷酸化位點,這說明該蛋白被磷酸化修飾的可能性很大。

圖8 油茶EMF2蛋白質二級結構的預測結果Fig.8 Secondary structure predictions in C. oleifera EMF2 protein
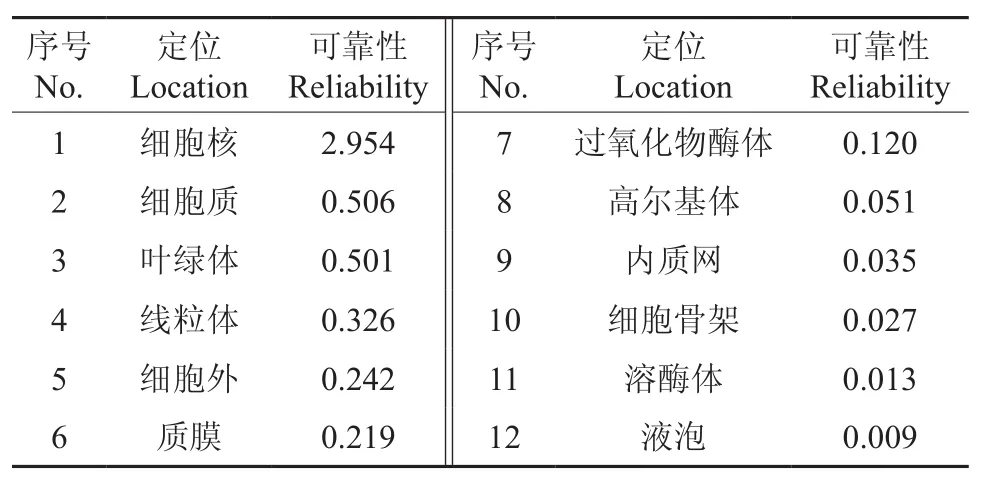
表2 油茶CoEMF2基因亞細胞定位預測結果Table 2 Prediction on subcellular localization in C. oleifera CoEMF2
3 結論與討論
本研究克隆了CoEMF2基因,并利用生物信息學方法對其進行了分析,結果表明:開放閱讀框為1 866 bp,編碼621個氨基酸,蛋白分子量為70.54 kD,其為不穩定的疏水性蛋白。亞細胞定位預測結果表明,CoEMF2位于細胞核中,這與CoEMF2對于染色質進行H3K27me3的功能執行是相一致的。
實驗中發現,CoEMF2蛋白中含有兩個保守區:VEFS-Box結構域和C2H2型鋅指蛋白。CoEMF2蛋白具有VEFS-Box家族基因的保守域結構特征:通過抑制AP1(APETALA1)、CAL(CAULIFLOWER)、FUL(FRUITFULL)等基因的作用從而抑制植物開花[17-18]。同時,VEFS-Box結構域很可能結合鋅指蛋白一起參與到油茶開花的轉錄調節過程中。由于CoEMF2基因在結構和功能上與Su(z)12基因相似,編碼PcG蛋白復合體,而PcG蛋白復合體的下游靶基因中,有開花同源基因AG(AGAMOUS)、AP3(APETALA3)和PI(PISTILLATA)[19-20],所以推測,CoEMF2也會通過對染色質進行標記修飾(例如H3K27me3)來實施對這些下游基因表達的調控,進而控制營養細胞向生殖細胞轉化[21]。
CoEMF2參與組成的PRC2復合物催化H3K27me3的形成,并抑制靶基因的轉錄。若能在體細胞胚培養過程中減弱或消除H3K27me3標記,就可能會增強胚性基因的表達,從而提高脂肪酸生物合成相關基因的表達水平[22-23]。因此,本研究不僅為今后有關油茶從芽到開花的誘導問題的進一步研究提出了新的思路,也為研究油茶愈傷組織的成脂效應奠定了基礎。
參考文獻:
[1] 劉 凱,譚曉風,龍洪旭,等.油茶DGATl基因的全長cDNA序列克隆及分析[J].中南林業科技大學學報, 2012,32(4): 148 - 152.
[2] 中南林學院.經濟林栽培[M].北京:中國林業出版社,1983:127-135.
[3] 胡孝義.油茶種子活性氧相關基因的克隆及樹體RNA干擾技術研究[D].長沙:中南林業科技大學, 2009.
[4] 齊飛艷,陳媛文,張 穎,等.毛竹EMF2類基因原核表達條件優化[J].分子植物育種,2012, 10(4):485-489.
[5] 胡 波.茶樹成花相關基因的cDNA克隆及生物信息學分析[D].福州:福建農林大學,2010.
[6] Holec S, F B. Polycomb group complexes mediate developmental transitions in plants[J]. Plant Physiology, 2012,158:35 - 43.
[7] Schwartz YB, V P. Polycomb silencing mechanisms and the management of genomic programmes[J]. Nature Reviews Genetics, 2007, 8(1):9 - 22.
[8] Lafos M, Kroll P, Hohenstatt ML,et al. Dynamic Regulation of H3K27 Trimethylation duringArabidopsisDifferentiation[J].Plos Genetics, 2011,7(4):134 - 139.
[9] Zheng BL, XM C. Dynamics of histone H3 lysine 27 trimethylation in plant development[J]. Current Opinion in Plant Biology, 2011, 14(2):123 - 129.
[10] Chanvivattana Y, Bishopp A, Schubert D,et al.Interaction of Polycomb-group proteins controlling flowering inArabidopsis[J].Development, 2004,131:5263 - 5276.
[11] Bouyer D, Roudier F, Heese M,et al. Polycomb Repressive Complex 2 Controls the Embryo-to-Seedling Phase Transition[J].Plos Genetics, 2011,7(3):1 - 19.
[12] 范曉明.油茶組織培養技術研究[D].長沙:中南林業科技大學,2011.
[13] Wood CC, Robertson M, Tanner G,et al. TheArabidopsis thalianavernalization response requires a polycomb-like protein complex that also includes VERNALIZATION INSENSITIVE 3[J]. Proceedings of the National Academy of Sciences of the United States of America, 2006,103(39):14631 - 14636.
[14] Luo M, Bilodeau P, Koltunow A,et al.Genes controlling fertilization-independent seed development inArabidopsis thaliana[J]. Proceedings of the National Academy of Sciences of the United States of America, 1999, 96(1): 196 - 301.
[15] Pasini D, Bracken AP, Hansen JB,et al.The polycomb group protein Suz12 is required for embryonic stem cell differentiation[J]. Molecular and Cellular Biology, 2007, 27(10):3769-3779.
[16] 黃 驥,王建飛,張紅生.植物C2H2型鋅指蛋白的結構與功能 [J]. HEREDITAS,2004,26(3): 414 - 418.
[17] Chen L J, Diao Z Y, Specht C,et al.Molecular evolution of VEF-domain-containing PcG genes in plants[J]. Plant and Cell Physiology, 2009, 2:738 - 754.
[18] Pien S, U G, Polycomb group and trithorax group proteins inArabidopsis[J]. Biochimica Et Biophysica Acta-Gene Structure and Expression, 2008, 1769(5 - 6):375 - 382.
[19] Moon Y H, Chen L J, Pan R L,et al. EMF genes maintain vegetative development by repressing the flower program inArabidopsis[J]. Plant Cell, 2003, 15:681 - 693.
[20] Meunier J, Khelifi A, Navratil V,et al.Homology-dependent methylation in primate repetitive DNA[J]. Pro Natl Acad Sci USA, 2005, 102: 5471 - 5476.
[21] Calonje M, R SZ. Complexity beneath the silence [J]. Curr Opin Plant Biol, 2006:530 - 537.
[22] Jiang DH, Wang YQ, Wang YZ,et al. Repression of FLOWERING LOCUS C and FLOWERING LOCUS T by theArabidopsisPolycomb Repressive Complex 2 Components[J].Plos One, 2008, 3(10):163 - 168.
[23] 譚曉風,張黨權,陳鴻鵬,等.油茶查爾酮合酶和異構酶基因的cDNA克隆[J].中南林業科技大學學報,2007,27(1):9-13.

