轉化生長因子-β1誘導小鼠足細胞凋亡實驗研究
王宇暉 童孟立 楊汝春
轉化生長因子-β1誘導小鼠足細胞凋亡實驗研究
王宇暉 童孟立 楊汝春
目的 探討轉化生長因子-β1(TGF-β1)是否能誘導小鼠足細胞株凋亡以及誘導凋亡的途徑。 方法 (1)體外培養小鼠足細胞株;(2)應用不同濃度(10-1~104ng/L)TGF-β1誘導小鼠足細胞凋亡;(3)103ng/L TGF-β1誘導不同時間(12、24、48h)后觀察足細胞凋亡情況;(4)采用流式細胞儀檢測Annexin V、Caspase 3;(5)實時定量PCR及Western印跡法檢測p38絲裂原活化蛋白激酶(p38MAPK)、Smad2、Smad3、Smad7mRNA及蛋白質的表達情況。 結果 (1)小鼠足細胞在不同濃度(10-1~104ng/L)TGF-β1刺激下,細胞凋亡率明顯高于正常對照組(均P<0.05);(2)隨著TGF-β1濃度增加、凋亡時間增加,足細胞凋亡率增高(P<0.05);p38MAPK、Smad2、Smad3、Smad7 mRNA表達增加;TGF-β1103ng/L為最佳誘導小鼠足細胞凋亡濃度,24h為最佳誘導凋亡時間;(3)與正常對照組比較,103ng/LTGF-β1誘導后Caspase 3陽性細胞比率顯著增加(P<0.01),p38MAPK、Smad2、Smad3、Smad7蛋白質表達亦顯著增加(P<0.01)。 結論 TGF-β1能誘導小鼠足細胞凋亡,呈濃度及時間依賴性。TGF-β1通過Smad通路、p38MAPK通路以及線粒體通路誘導小鼠足細胞凋亡。
TGF-β1足細胞 凋亡
足細胞是高度特異性的終末分化細胞,當其出現損傷、凋亡進而壞死、脫落、缺失,就會引起細胞數量減少和密度降低,導致腎小球進行性硬化,最終導致腎功能喪失[1]。足細胞凋亡已被認為是腎臟疾病發展的一種十分重要的機制,其中轉化生長因子-β1(TGF-β1)對足細胞凋亡的調節作用十分重要[2]。TGF-β1是一種多功能的細胞因子,在腎小球硬化時表達增加。越來越多的研究表明足細胞在損傷時表達TGF-β1增加,而TGF-β1通過何種細胞傳導途徑發揮作用尚不明確。本研究旨在進一步明確TGF-β1是否能誘導小鼠足細胞凋亡及其誘導通路。
1 材料和方法
1.1 材料 實驗試劑:小鼠足細胞株購自北京協和醫學院,足細胞培養試劑(RPMI1640培養液、Ⅰ型膠原及0.25%胰蛋白酶)購自美國Gibco公司,FBS(10%)購自杭州四季青公司,小鼠IFN-γ購自美國Sigma公司,流式細胞儀試劑 Annexin V-FITC購自奧地利 Bender MedSystems公司,CaspGLOWTMCaspase 3購自美國BioVision公司,實時定量PCR試劑Trizol Reagent購自Invitrogen公司,Reveraid Frist Strand cDNA Synthesis kit購自加拿大Fermentas公司,引物合成由上海生工生物工程公司完成,Western-印跡法試劑盒及試劑(BCA蛋白分析試劑盒、NE-PER細胞核和細胞質蛋白抽提試劑、ECL Western Blot)購自美國Pierce公司,小鼠抗大鼠p38MAPK、Smad2、Smad3、Smad7、GAPDH抗體購自美國Santa Cruz公司,重組人轉化生長因子-β1試劑購自Peprotech公司。主要儀器:EPICS XL流式細胞儀(美國Beckman Coulter公司),熒光定量PCR儀(FTC3000型,加拿大Funglyn Biotech公司),RNA/DNA calculator(Pharmacia公司),高速冷凍離心機(美國BECKMAN公司),凝膠成像儀(美國Pharmacia Biotech公司)。
1.2 方法
1.2.1 足細胞培養 將小鼠腎小球足細胞株置于含10%FBS的RPMI1640完全培養基中培養,細胞培養瓶中預先經0.1mg/ml膠原Ⅰ37℃處理1h,每瓶細胞加入10U/ml IFN-γ、100U/ml青鏈霉素,于33℃、5%CO2條件下培養箱內培養。細胞于24h后完全貼壁,每2~3d傳代1次,至足夠實驗所需數量。將傳代后足細胞株放入37℃、5%CO2條件下培養箱內培養,14d后足細胞分化成熟,開始進行實驗。
1.2.2 實驗分組 不同濃度:分別以0、10-1、100、101、102、103、104ng/L濃度TGF-β1刺激小鼠足細胞24h,其中0ng/L濃度TGF-β1為正常對照組。不同時間:選擇0、103ng/L作為刺激濃度,分別刺激12、24、48h,其中0ng/L濃度為正常對照組。另外,選擇103ng/L作為刺激濃度,刺激時間為24h,流式細胞儀測定小鼠足細胞Caspase 3陽性細胞數,Western印跡法檢測小鼠足細胞p38MAPK、Smad2、Smad3、Smad7蛋白質的表達。
1.2.3 Annexin V及Caspase 3檢測 (1)Annexin V:收集各孔細胞上清液及細胞,洗滌后調整細胞密度為2×105~5×105/ml;加入Annexin V-FITC后在常溫下孵育洗滌細胞,再加入碘化丙啶,在流式細胞儀上分析。(2)Caspase 3:調整細胞密度106/ml;加入1μl FITC-DEVD-FMK在37℃、5%CO2培養箱中孵育1h;離心細胞洗滌,加入緩沖液再次懸浮細胞,通過流式細胞儀FL-1通道進行檢測。
1.2.4 p38MAPK、Smad2、Smad3、Smad7mRNA表達檢測 采用實時定量PCR方法檢測,定量PCR檢測每個基因設3復孔,數據以3次實驗測定結果進行統計,采用雙ΔCt的方法計算目的基因表達量,每個樣品目的基因表達量除以GAPDH表達量即為樣品基因相對含量。用Trizol提取細胞RNA;核酸分析儀測定RNA樣品濃度;1.5%瓊脂凝膠(agarose gel)2~4μl RNA上樣,電泳檢測RNA完整性;合成cDNA第一鏈;以25μl反應體系進行PCR擴增。引物設計:運用Primer Premier 5結合Dnastar分析軟件及網上BLAST分析,設計并合成引物。引物序列:GAPDH上游序列為TGGCCTTCCGTGTTCCTAC,下游序列為GAGTTGCTGTTGAAGTCGCA;p38MAPK上游序列為GGGACACCCCCTGCTTATCT,下游序列為TCCCTGCTTTCAAAGGACTGG;Smad2上游序列為AATACGGTAGATCAGTGGGACA,下游序列為CAGTTTTCGATTGCCTTGAGC;Smad3上游序列為TCTCCCCGAATCCGATGTCC,下游序列為 GCTGGTTCAGCTCGTAGTAGG;Smad7上游序列為GCATTCCTCGGAAGTCAAGAG,下游序列為CCAGGGGCCAGATAATTCGT。每個樣本均采用3復孔。PCR擴增條件:95℃30s、95℃5s、60℃30~34s,共40個循環。
1.2.5 p38MAPK、Smad2、Smad3、Smad7蛋白質表達檢測 采用Western印跡法檢測。刮下細胞洗滌后,按100:1加入細胞裂解液和蛋白酶抑制劑(100ul+1μl),充分裂解后,離心取上清液。按BCA法測蛋白濃度。樣品與2×上樣緩沖液1∶1混合,煮沸5min,在12%SDS-聚丙烯酰胺凝膠進行SDS-PAGE電泳分離,轉膜,封閉后分別加入小鼠抗大鼠p38MAPK、Smad2、Smad3、Smad7和內參照GAPDH一抗(1∶200),一抗用封閉液稀釋,4℃孵育過夜。TBST洗膜3次,15min/次。將膜在1∶1 000稀釋的抗兔IgG-HRP中室溫孵育1h,TBST洗膜3次,將膜貼在ECL發光液上,曝光,凝膠成像分析系統進行掃描分析,系統直接得出結果。
1.3 統計學處理 采用SPSS17.0統計軟件,計量資料以表示,先進行正態分布及方差齊性檢驗,符合正態分布及方差齊性,則用方差分析;非正態分布及方差齊性,則用秩和檢驗。
2 結果
2.1 不同濃度TGF-β1誘導后小鼠足細胞凋亡情況比較 見表1。
由表1可見,10-1~104ng/L TGF-β1誘導后小鼠足細胞凋亡率及壞死率均明顯高于正常對照組(均P<0.05);隨著TGF-β1誘導濃度的升高,細胞凋亡率及壞死率呈不同程度升高(均P<0.05)。
2.2 不同濃度 TGF-β1誘導后 p38MAPK、Smad2、Smad3、Smad7 mRNA表達量 見表2。
由表2可見,小鼠足細胞在不同濃度TGF-β1刺激下,p38MAPK、Smad2、Smad3、Smad7 mRNA表達量逐漸增加,至101ng/L時達到1.5倍,至103ng/L時達到2倍以上。
2.3 不同時間誘導后小鼠足細胞凋亡情況的比較 見表3。
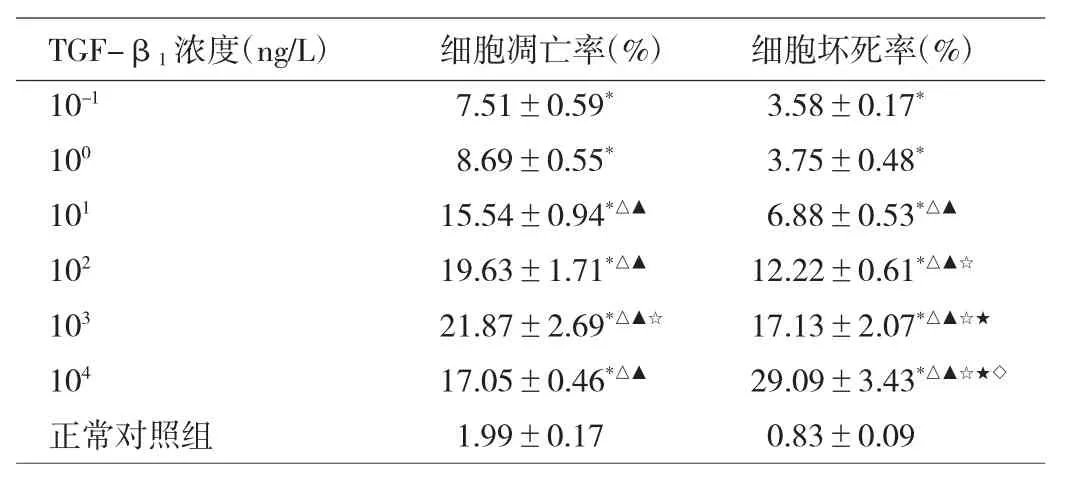
表1 不同濃度TGF-β1誘導后小鼠足細胞凋亡情況比較
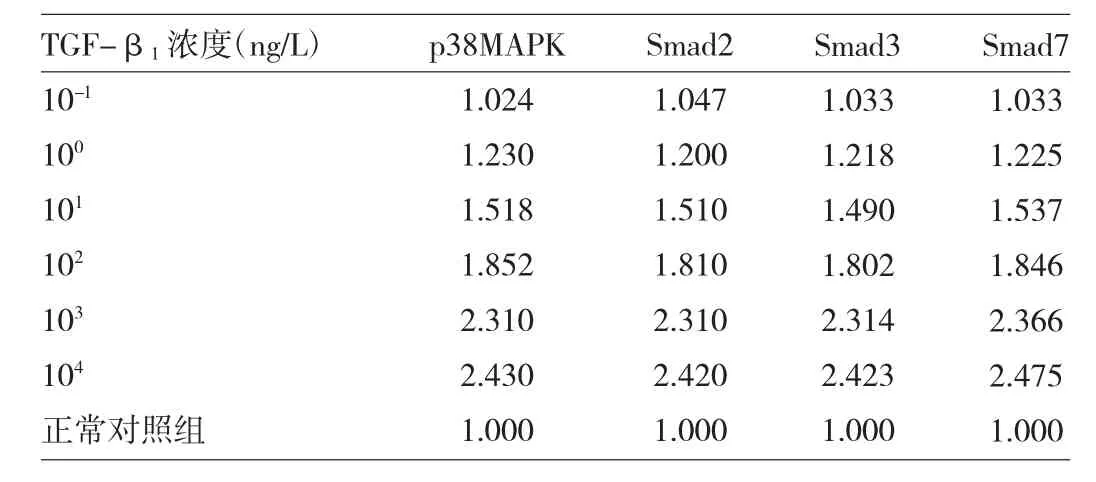
表2 不同濃度TGF-β1誘導后p38MAPK、Smad2、Smad3、Smad7 mRNA表達量

表3 不同時間誘導后小鼠足細胞凋亡情況的比較
由表3可見,與正常對照組比較,誘導12、24、48h后足細胞凋亡率及壞死率均明顯增加,差異有統計學意義(P<0.01);與誘導12h比較,誘導24、48h后足細胞凋亡率明顯增加(P<0.01)。誘導后48h細胞壞死率明顯高于誘導12、24h組(P<0.01)。
2.4 不同時間誘導后p38MAPK、Smad2、Smad3、Smad7mRNA表達量 見表4。
由表4可見,誘導12h后,p38MAPK、Smad2、Smad3、Smad7 mRNA表達不明顯,誘導24h后p38MAPK、Smad2、Smad3、Smad7 mRNA表達量升高(達1.5倍),誘導48h后p38MAPK、Smad2、Smad3、Smad7mRNA表達明顯升高(達2倍)。
2.5 103ng/L TGF-β1誘導小鼠足細胞24h后Caspase 3及p38MAPK、Smad2、Smad3、Smad7蛋白質表達量 誘導24h后Caspase 3陽性細胞比率為(62.93±5.88)%,顯著高于正常對照組的(4.73±1.38)%,差異有統計學意義(P<0.01)。p38MAPK、Smad2、Smad3、Smad7蛋白質表達情況見圖1、表5。
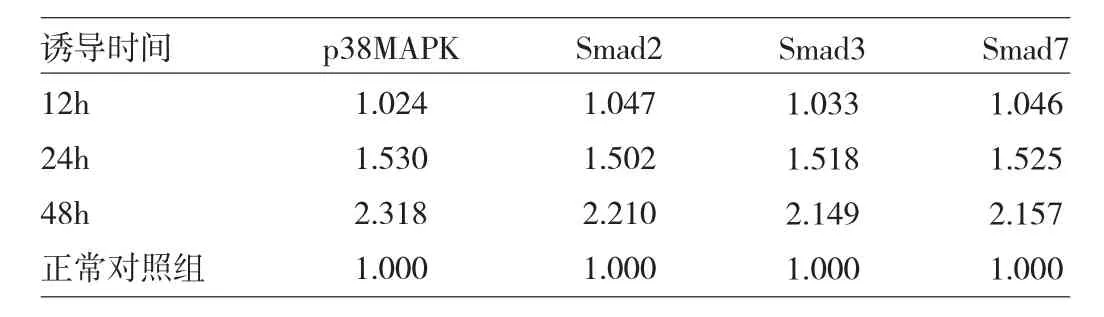
表4 不同時間誘導后p38MAPK、Smad2、Smad3、Smad7 mRNA表達量
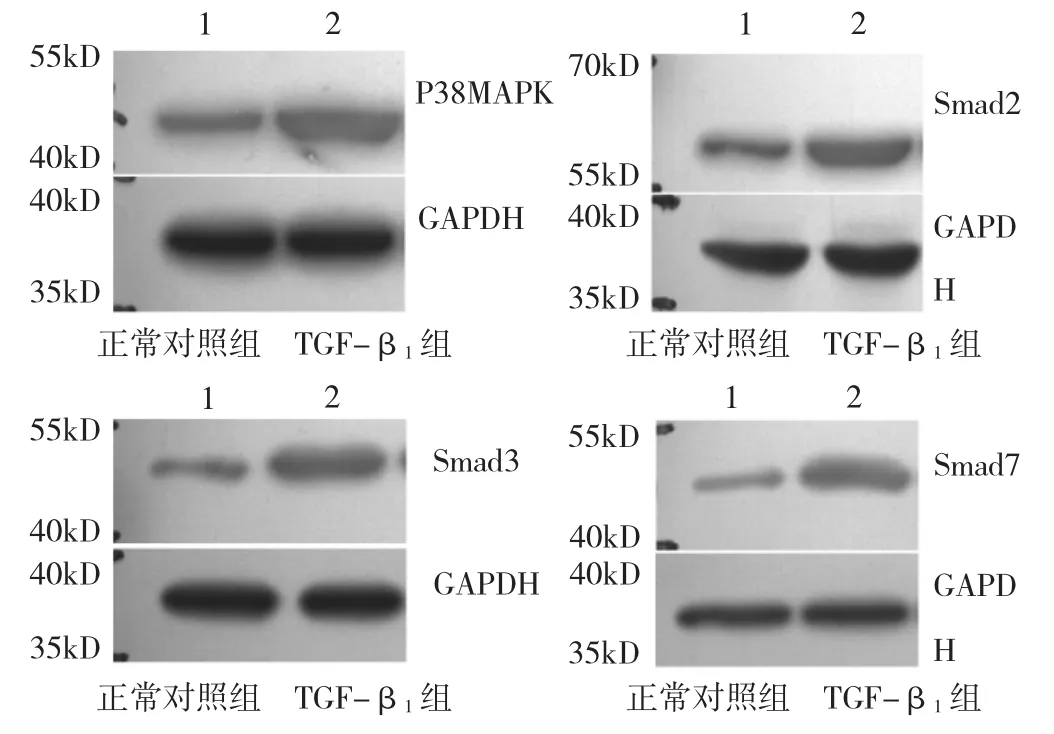
圖1 小鼠足細胞p38MAPK、Smad2、Smad3、Smad7蛋白質表達電泳圖
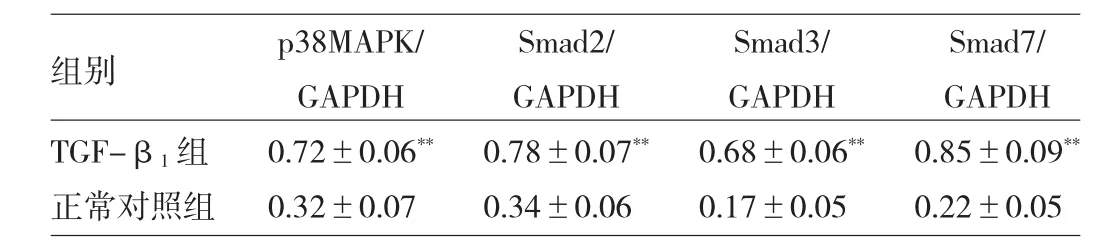
表5 p38MAPK、Smad2、Smad3、Smad7蛋白質表達量
由圖1和表5可見,TGF-β1組p38MAPK、Smad2、Smad3、Smad7蛋白質表達量均顯著高于正常對照組,差異均有統計學意義(均P<0.01)。
3 討論
足細胞屬于高度分化細胞,有獨特復雜的結構,參與腎小球毛細血管襻濾過屏障的構成。在人類及動物模型的腎小球疾病如微小病變、局灶節段腎小球硬化、塌陷型腎病、膜性腎病、新月體腎病、糖尿病腎病和狼瘡腎炎等中,都發現有足細胞損傷。足細胞損傷包括:裂孔隔膜結構和成分的改變[3]、肌動蛋白細胞骨架的調節異常等[4],嚴重的足細胞損傷則是細胞凋亡[5]或足細胞與腎小球基底膜(GBM)及其連接異常導致足細胞從基底膜脫落[6]。足細胞損傷及脫落在蛋白尿的發生以及腎小球硬化進展中起關鍵作用。研究表明,足細胞丟失20%就可以引起系膜擴張、一過性輕度蛋白尿;足細胞丟失20%~40%可出現少量蛋白尿,球囊粘連和局灶節段腎小球硬化;足細胞丟失>40%,球囊粘連顯著增加,腎小球硬化增多,持續大量蛋白尿,腎功能異常[7]。
多種應答機制可以導致足細胞數量的減少,包括凋亡、足細胞從GBM上脫落以及足細胞增殖能力的喪失[8]。足細胞凋亡已被認為是腎臟疾病發展的一種十分重要的機制,其中TGF-β1對足細胞凋亡的調節作用非常重要。TGF-β1在大多數細胞內起調節生長、分化和凋亡的作用。Schiffer等[9]的研究發現,2周齡的TGF-β1轉基因小鼠,其足細胞凋亡率比野生型小鼠增加20倍。TGF-β1誘導足細胞凋亡的通路如下:(1)Smad通路。研究發現,在培養的足細胞中加入5.0ng/ml TGF-β1可迅速誘導Smad2/3磷酸化,15min即出現磷酸化,并持續8~24h,同時發現TGF-β1能強烈誘導轉基因小鼠和體外培養的足細胞內Smad7蛋白表達上調,上調的Smad7蛋白通過抑制抗凋亡的存活因子(NF-κB)/p65的活化,從而導致足細胞凋亡[9]。(2)p38絲裂原活化蛋白激酶(MAPK)通路。MAPK也是足細胞內重要的信號通路,nephrin可通過p38和JNK MAPK激活作為轉錄因子的激動蛋白,而podocin可明顯加強nephrin的這一信號傳遞[10],MAPK通路的活化與足細胞損傷、足突融合和蛋白尿的發生有關[11]。研究表明,葡萄糖可使足細胞產生過多的TGF-β1,通過p38MAPK使足細胞凋亡增加、數量下降[12]。體外實驗研究發現,足細胞在TGF-β1刺激20min~8h內p38即持續磷酸化;2~12h時Bax表達增加,6h是Caspase 3開始激活,24h后即出現了特異性的DNA片段,加入Caspase 3的抑制劑可以減少TGF-β1誘導的DNA片段產生[9],表明TGF-β1可以通過激活Caspase來誘導足細胞凋亡,此即凋亡的線粒體通路。
本研究結果顯示,隨著TGF-β1誘導劑量的增加,足細胞凋亡細胞數目增加,在103ng/L濃度時最明顯,至104ng/L濃度時足細胞凋亡數目并未增加,但壞死細胞數增多。因此本研究選擇103ng/L作為誘導足細胞凋亡最佳誘導濃度。小鼠足細胞在103ng/L TGF-β1刺激下,隨著TGF-β1刺激時間延長,足細胞凋亡數目亦逐步增加,但刺激48h和24h之間差異無統計學意義,并且誘導48h后壞死細胞數目顯著增加。定量PCR實驗顯示,隨著TGF-β1誘導劑量、誘導時間的延長小鼠足細胞Smad2、Smad3、Smad7 mRNA表達增加。同時,Western印跡法顯示,與正常組相比,TGF-β1組Smad2、Smad3、Smad7蛋白質的表達明顯增加,提示TGF-β1誘導小鼠足細胞凋亡是通過Smad通路完成的。隨著TGF-β1誘導劑量、誘導時間的延長,小鼠足細胞p38MAPK mRNA表達亦增高,TGF-β1組p38MAPK蛋白質表達增加,Caspase 3陽性細胞數也明顯增多,提示TGF-β1亦激活了p38MAPK通路,通過線粒體通路誘導小鼠足細胞凋亡。TGF-β1能通過Smad通路、p38MAPK通路、線粒體通路等誘導小鼠足細胞凋亡,并呈濃度及時間依賴性,抑制TGF-β1表達或拮抗TGF-β1可能是防治足細胞凋亡的重要手段之一。
[1] Wiggins R C.The spectrum of potocytopathies:a unifying view of glomerular diseases[J].Kidney Int,2007,71(12):1205-1214.
[2] Wada T,Pippin J W,Terada Y,et al.The cyclin-dependent kinase inhibitor p21 is required for TGF-beta1-induced podocyte apoptosis[J].Kidney Int,2005,68(4):1618-1629.
[3] Michaud J L,Lemieux L I,Dube M,et al.Focal and segmental Glomerulosclerosis in mice with podocyte-specific expression of mutant alpha-actinin-4[J].J Am Soc Nephrol,2003,14(5):1200-1211.
[4] Verma R,KovariI,SoofiA,et al.Nephrin ectodomain engagement results in Src kinase activation,nephrin phosphorylation,Nck recruitment,and actin polymerization[J].J Clin Invest,2006,116(5): 1346-1359.
[5] Zou M S,Yu J,Nie G M,et al.1,25-dihydroxyvitamin D3 decreases adriamycin-induced podocyte apoptosis and loss[J].Int J Med Sci,2010,7(5):290-299.
[6] Mundel P,and Shankland S J.Podocyte biology and response to injury[J].J Am Soc Nephrol,2002,13(12):3005-3015.
[7] Wharram B L,GoyalM,Wiggins J E,et al.Podocyte depletion causes glomerulosclerosis:Diphtheria toxin-induced podocyte depletion in rats expressing human diphtheria toxin receptor transgene [J].J Am Soc Nephrol,2005,16(10):2941-2952.
[8] Xavier S,Niranjan T,Krick S,et al.TβRI independently activates smad-and CD2AP-dependent pathways in podocytes[J].J Am Soc Nephrol,2009,20(10):2127-2137.
[9] Schiffer M,Bitzer M,Roberts I S D,et al.Apoptosis in podocytes induced by TGF-β and Smad7[J].The Journal of Clinical Investigation,2001,108(6):807-816.
[10] Huber T B,Kottgen M,Schilling B,et al.Interaction with podocin facilitates nephrin signaling[J].J BiolChem,2001,276(45):41543-41546.
[11] Koshikawa M,Mukoyama M,Mori K,et al.Role of p38 mitogen-activated protein kinase activation in podocyte injury and proteinuria in experimental nephrotic syndrome[J].J Am Soc Nephrol,2005,16(9):2690-2701.
[12] Dalla VM,Masiero A,Roiter AM,et al.Is podocyte injury relevant in diabetic nephropathy?Studies in patients with type 2 diabetes [J].Diabetes,2003,52(4):1031-1035.
TGF-β1induces apoptosis of mouse podocytes in vitro
WANG Yuhui,TONG Mengli,YANG Ruchun.
Department of Nephrology, Hangzhou Hospital of Traditional Chinese Medicine,Hangzhou 310007,China
Objective To investigate the effect of TGF-β1on apoptosis of mouse podocytes and its signal pathway. Methods Cultured mouse podocytes were treated with different concentrations of TGF-β1(0,1x10-1~104ng/L)for 24 h,or treated with 103ng/L TGF-β1for different time duration(12,24,48h).Annexin V and Caspase 3 were measured by flow cytometry.The mRNAs and proteins of P38MAPK,Smad2,Smad3 and Smad7 were detected by real time PCR and Western blotting. Results Compared to controls(0ng/L TGF-β1)the ratio of apoptotic podocytes and mRNA expressions of p38MAPK,Smad2,Smad3 and Smad7 were increased in TGF-β1(10-1~104ng/L)treatment groups in a concentration and time-dependent manner(P<0.05). Treatment with TGF-β1(103ng/L)for 24 h induced maximal apoptosis in podocytes.The ratio of Caspase3-positive podocytes was increased after treated with TGF-β1(103ng/L,24h)compared to controls(P<0.01). Conclusion TGF-β1induces the apoptosis of mouse podocytes time-dependently and dose-dependently,in which Smad,p38MAPK signal pathway and mitochondrion might be involved.
TGF-β1Podocyte Apoptosis
2013-03-15)
(本文編輯:歐陽卿)
浙江省中醫藥管理局立項資助課題(2006C108)
310007 杭州市中醫院腎內科

