氯化鋰對肝癌細胞BEL-7402增殖、周期的影響及其作用機制
徐杰偉 蔣桂星 曹利平
氯化鋰對肝癌細胞BEL-7402增殖、周期的影響及其作用機制
徐杰偉 蔣桂星 曹利平
目的 探討氯化鋰對人肝癌細胞BEL-7402增殖、周期的影響及其作用機制。 方法 應用MTT法及DNA PREP細胞周期法檢測BEL-7402經氯化鋰作用后的增殖及周期改變情況,Western blot檢測糖原合成激酶-3(GSK-3)、失活pGSK-3及其下游分子CyclinD1的表達情況。 結果 氯化鋰可顯著抑制BEL-7402的增殖,并呈時間、劑量依賴性(P<0.05);氯化鋰可使BEL-7402的G0/G1期比例明顯降低、G2/M期比例顯著升高(P<0.05);氯化鋰作用后GSK-3、失活pGSK-3及CyclinD1蛋白的表達水平均明顯升高(P<0.05)。 結論 氯化鋰可抑制肝癌細胞增殖,其機制可能是通過抑制GSK-3活性并上調CyclinD1表達使肝癌細胞阻滯于G2/M期。
肝癌 糖原合成激酶-3 氯化鋰 CyclinD1
糖原合成激酶-3(glycogen synthase kinase-3,GSK-3)是普遍存在于真核細胞生物中的一種絲氨酸蘇氨酸蛋白激酶,可參與多種細胞生理過程,包括細胞增殖、分化及存活[1]。近年的研究發現,GSK-3異常表達可致腫瘤的發生。氯化鋰是GSK-3的高度選擇性抑制劑,具有抑制腫瘤細胞增殖、影響癌基因表達及誘導凋亡的作用[2]。本研究旨在探討氯化鋰對肝癌細胞增殖、周期影響及其對GSK3、CyclinD1表達的影響。
1 材料和方法
1.1 材料 人肝細胞癌株BEL-7402由中國科學院典型培養物保藏委員會細胞庫提供,氯化鋰、四甲基偶氮唑藍(MTT)購自Sigma公司;鼠抗人GSK-3α/β單克隆抗體(克隆號:sc-7291)、兔多抗磷酸化GSK-3(pGSK-3)βser9(克隆號:sc-11757)、pGSK-3αser21(克隆號:sc-16308)均購自Santa Cruz公司,兔抗人CyclinD1多克隆抗體(克隆號:2261-1)購自EPITMICS公司,βactin一抗為Santa Cruz公司產品。羊抗兔IgG-HRP標記二抗及羊抗鼠IgG-HRP標記二抗購自聯科生物技術有限公司,ECL為美國Pierce公司產品,PVDF膜由Millipore公司生產。蛋白酶抑制劑購自Sigma公司,DNA PREP細胞周期檢測試劑盒購自Beckman Coulter公司。
1.2 方法
1.2.1 細胞培養及細胞生長抑制率測定 BEL-7402細胞用含10%FBS(青霉素、鏈霉素100U/ml)的RPMI 1640培養液,置于37℃、5%CO2培養箱中培養。取對數生長期BEL-7402細胞,按5×103個/孔接種于96孔培養板,培養24h待細胞貼壁后加入濃度梯度(0、5、10、20、40、80mmol/L)PBS溶解的氯化鋰,對照組加等量PBS,每個實驗組做3個復孔。分別培養24、48、72h后每孔加入MTT溶液(5mg/ml)20μl,37℃繼續培養2.5~4h,吸棄孔內培養上清液。每孔加入150μl DMSO,振蕩10min。用酶聯免疫檢測儀測定490nm處吸光度(OD)值。每組取3次實驗平均值,計算各組細胞生長抑制率。生長抑制率=(1-藥物組OD值/對照組OD值)×100%。
1.2.2 細胞周期分析 取10、20nmol/L氯化鋰分別處理BEL-7402細胞24h及48h,對照組加等量PBS,收獲細胞按DNA PREP細胞周期檢測試劑盒說明書進行操作,加50μl DNA PREP LPR打孔10min,加500μl DNA PREP Stain室溫避光30min,上流式細胞分析儀檢測DNA含量,應用Multicycle for Windows軟件分析細胞周期分布。
1.2.3 Western blotting檢測 取10、20mmol/L氯化鋰處理BEL-7402細胞后48h收集細胞,加入細胞裂解液,提取細胞總蛋白,用BCA試劑盒檢測蛋白質濃度,制備10%SDS-PAGE凝膠,每孔上樣30μl,經電泳、轉膜、封閉,依次加入β-actin、GSK-3α/β、pGSK-3βser9、pGSK-3αser21、CyclinD1抗體(1∶1 000)4℃過夜,洗膜后,二抗室溫孵育1h,再洗膜后用適量ECL孵育3min,用 ImageQuant LAS4000mini機器自動顯影,使用Quantity One軟件分析條帶像素值。蛋白相對表達量=各個蛋白的凈像素值/actin的凈像素值,實驗重復3次。
1.3 統計學處理 采用SPSS16.0統計軟件,所得數據以表示,組間比較采用單因素方差分析。
2 結果
2.1 氯化鋰作用后BEL-7402細胞生長抑制率的變化 不同濃度的氯化鋰對BEL-7402細胞增殖均有明顯的抑制作用,隨著藥物濃度梯度升高,OD值明顯降低,細胞生長抑制率明顯增加,差異有統計學意義(P<0.05);且隨著作用時間的延長,細胞生長抑制率也明顯增加,各濃度氯化鋰作用72h細胞生長抑制率均最大,差異有統計學意義(P<0.05),見圖1。
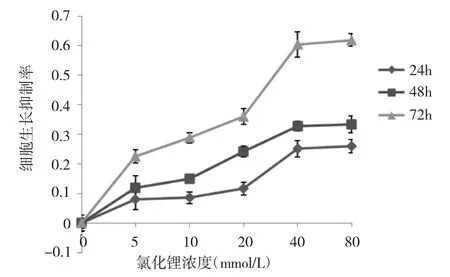
圖1 不同濃度、不同時間氯化鋰作用于肝癌細胞后增殖變化
2.2 氯化鋰作用于BEL-7402細胞后其細胞周期變化見圖2。

圖2 不同濃度及不同時間氯化鋰作用后BEL-7402細胞周期的變化
由圖2可見,加入10、20mmol/L的氯化鋰分別培養24、48h后,G0/G1期比例低于對照組,而G2/M期比例顯著高于對照組(P<0.05)。
2.3 氯化鋰作用后GSK-3、pGSK-3βser9、pGSK-3αser21、CyclinD1蛋白的表達情況 以β-actin為內參照,對照組、氯化鋰10mmol/L及20mmol/L作用48h組總GSK-3蛋白相對表達量分別為:1.193±0.068、1.361± 0.081、1.822±0.059;pGSK-3βser9蛋白相對表達量分別為 1.011±0.057、1.354±0.089、1.828±0.078;pGSK-3αser21蛋白相對表達量分別為0.706±0.042、0.930±0.065、1.239±0.084;CyclinD1蛋白相對表達量分別為0.907± 0.014、1.389±0.036、2.644±0.044。與對照組比較,氯化鋰10mmol/L及20mmol/L作用48h后使總GSK-3、失活GSK-3及CyclinD1均上調,差異有統計學意義(均P<0.05),見圖3。
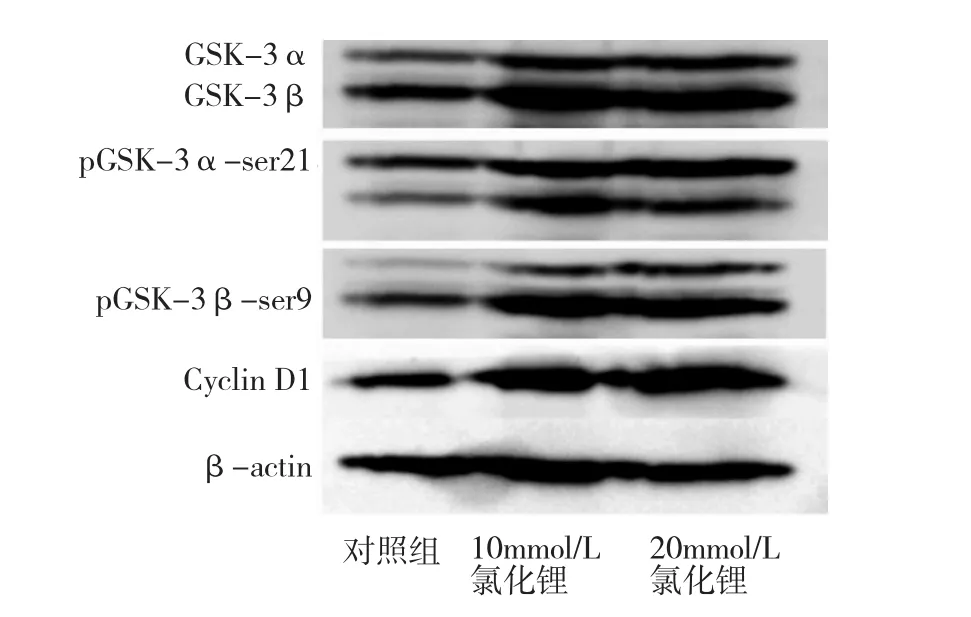
圖3 氯化鋰作用后相關蛋白表達情況
3 討論
早期的研究發現,氯化鋰可用于治療痛風。1949年,澳大利亞學者Cade首先采用碳酸鋰治療精神性興奮,證明它是預防或治療躁狂或躁狂憂郁性躁狂期的有效藥物[3]。此后大量研究表明,鋰離子可有效抑制腫瘤細胞生長,如在前列腺癌細胞、胰腺癌細胞等癌細胞中,氯化鋰能使細胞阻滯于G2/M期或通過誘導細胞凋亡進而抑制細胞生長[4-5]。進一步的研究發現,氯化鋰主要通過影響GSK-3的活性調節腫瘤細胞生長。1996年,Klein等[6]首次報道了鋰離子可選擇性抑制GSK-3。研究表明,GSK-3在多種腫瘤的發生、發展過程中其重要調節作用,可見氯化鋰發揮抑制腫瘤細胞生長的作用可能主要通過抑制GSK-3活性實現。
GSK-3是存在于真核細胞生物中的一種多功能絲/蘇氨酸蛋白激酶,其在哺乳動物中有兩種亞型,包括GSK-3α和GSK-3β,兩者生物學功能相似。若GSK-3α第21位的絲氨酸和 GSK-3β第9位的絲氨酸被磷酸化,則GSK-3的活性下降。相反,GSK-3α第279位的酪氨酸和 GSK-3β第216位的酪氨酸被磷酸化,則GSK-3的活性增強[7]。GSK-3最初的生物學作用主要是作為糖代謝調節酶參與調節糖代謝的功能,近年來發現GSK-3異常激活與腫瘤發生、發展關系密切。活性GSK-3能促進卵巢癌細胞增殖,應用氯化鋰抑制GSK-3活性后可抑制卵巢癌細胞增殖及存活[8];此外,抑制GSK-3β活性還可通過下調存活蛋白survivin的表達誘導白血病細胞凋亡,抑制白血病細胞生長[9]。這些研究提示GSK-3是多種腫瘤細胞增殖和生存的促進因子。
目前,GSK-3參與腫瘤發生、發展的具體機制尚不明確。由于參與調節的底物及信號通路眾多,其調節腫瘤發生、發展的機制非常復雜。研究發現,GSK-3可通過相關信號蛋白、結構蛋白和轉錄因子等影響腫瘤惡性轉化及發展。如GSK-3是轉錄因子NF-κB活化的關鍵激酶[10]。NF-κB的異常激活可通過上調抗凋亡基因Bcl-2、IAP等的表達促進細胞增殖、抑制凋亡。此外,GSK-3還可調節與細胞增殖密切相關的CyclinD1蛋白及轉錄因子β-catenin等。因此,作為GSK-3的特異性抑制劑,氯化鋰可作為一種非常有用的研究工具用于對GSK-3β廣泛的生物學功能研究。
本研究結果顯示,氯化鋰可顯著抑制肝癌細胞增殖,并呈劑量及時間依賴性,氯化鋰作用后可使肝癌細胞被阻滯在G2/M期;另外還發現,氯化鋰作用后總GSK-3、失活GSK-3(pGSK-3βser9、pGSK-3αser21)及Cyclin D1表達顯著上調。筆者推測氯化鋰可能通過抑制GSK-3活性進而上調Cyclin D1的表達使肝癌細胞生長受到抑制。而既往研究表明,Cyclin D1是細胞周期的正向調控蛋白,在細胞周期關鍵限速點G1-S轉換中起重要作用,它能夠促使細胞由G1期進入S期,加速細胞增殖。但本文結果顯示,氯化鋰作用后肝癌細胞周期停滯于G2/M期,因此筆者認為,氯化鋰抑制GSK-3活性后,雖然上調Cyclin D1的表達,促進肝癌細胞從G1期進入S期,但之后可能使更多的癌細胞阻滯于G2/M期,因此G0/G1期比例顯著下降,而G2/M比例升高。但GSK-3如何使肝癌細胞進一步阻滯于G2/M期的具體機制仍需更深入的研究。
[1] Grimes C A,Jope R S.The multifaceted roles of glycogen synthase kinase 3beta in cellular signaling[J].Neurobiol,2001,65: 391-426.
[2] Zhang F,Phiel C J,Spece L,et al.Inhibitory phosphorylation ofglycogen synthase kinase-3(GSK-3)in response to lithium.Evidence for autoregulation of GSK-3[J].J BiolChem,2003,278(35): 33067-33077.
[3] CADE J F.Lithium salts in the treatment ofpsychotic excitement[J]. Practitioner,1949,163(976):337-344.
[4] Liao X,Zhang L,Thrasher J B,et al.Glycogen synthase kinase-3beta suppression eliminates tumor necrosis factor-related apoptosis-inducing ligand resistance in prostate cancer[J].Mol Cancer Ther,2003,2:1215-1222.
[5] Mamaghani S,Patel S,Hedley D W.Glycogen synthase kinase-3 inhibition disrupts nuclear factor-kappaB activity in pancreatic cancer,but fails to sensitize to gemcitabine chemotherapy[J]. BMC Cancer,2009,30(9):132.
[6] Klein P S,Melton D A.Amolecular mechanism for the effect of lithium on development[J].Proc Natl Acad Sci USA,1996,93(16): 8455-8459.
[7] Jope R S,Johnson G V.The glamour and gloom of glycogen synthase kinase-3[J].Trends Biochem Sci,2004,29:95-102.
[8] Cao Q,Feng YJ.Glycogen synthase kinase-3beta(GSK-3beta) promotes proliferation of ovarian cancer cells in vitro[J].Zhonghua Zhong Liu Za Zhi,2006,28:804-809.
[9] Holmes T,O'Brien T A,Knight R,et al.Glycogen synthase kinase-3beta inhibition preserves hematopoietic stemcell activity and inhibits leukemic cell growth [J].Stem Cells,2008,26: 1288-1297.
[10] Hoeflich K P,Luo J,Rubie E A,et al.Requirement for glycogen synthase kinase-3beta in cell survival and NF-kappaB activation[J].Nature,2000,406:86-90.
Effect of lithium chloride on proliferation and cell cycle of human hepatoma cells
XU Jiewei,JIANG Guixing,CAO Liping.
Department of Surgery,the Second Affiliated Hospital,Zhejiang University School of Medicine,Hangzhou 310009,China
Objective To investigate the effect of lithium chloride (LiCl)on cell proliferation,cell cycle of human hepatoma cells and its mechanism. Methods Cultured human hepatoma BEL-7402 cells were treated with different concentrations of LiCl. Cell proliferation was measured by MTT assay and cell cycle was examined by DNA PREP cell cycle assay.The expressions of GSK-3,inactivated GSK-3 and CyclinD1 were determined by Western blot. Results LiCl inhibited BEL-7402 cell proliferation in a concentration-and time-dependent manner.After LiCl treatment the percentage of G0/G1 phase was significantly reduced,the G2/M phase was significantly increased,and the expression levels of GSK-3,inactivated GSK-3 and CyclinD1 were up-regulated. Conclusion LiCl can inhibit the proliferation of BEL-7402 cells,in which inactivation of GSK-3 and up-regulation of CyclinD1 may be involved leading to cell cycle arrest in G2/M phase.
Liver cancer Glycogen synthase kinase 3 Lithium chloride CyclinD1
2013-01-14)
(本文編輯:歐陽卿)
310009 杭州,浙江大學醫學院附屬第二醫院肝膽外科
曹利平,E-mail:cao@zju.edu.cn

