直腸癌組織腫瘤轉移消失蛋白的表達及其臨床意義
張海峰 李金海 戴華衛 孫廣正 翟華偉
直腸癌組織腫瘤轉移消失蛋白的表達及其臨床意義
張海峰 李金海 戴華衛 孫廣正 翟華偉
目的 探討腫瘤轉移消失(MIM)蛋白在直腸癌組織中的表達及其結合臨床分期對直腸癌預后的指導意義。 方法采用免疫組織化學方法檢測MIM蛋白在直腸癌組織,直腸腺瘤組織,直腸正常組織中的表達,并用單因素分析其與臨床病理參數的關系。用Spearman等級相關分析MIM蛋白表達水平與直腸癌患者TNM分期的關系。Kaplan-Meier生存曲線分析直腸癌患者5年生存率情況。 結果 直腸癌組織MIM蛋白表達陽性率(83.2%)較直腸正常組織的21.6%和直腸腺瘤組織的28.8%均明顯增高(均P<0.05);MIM蛋白表達水平與直腸癌患者是否處于腫瘤早期、是否有3枚以上淋巴轉移和腫瘤分化程度有關(均P<0.05),與直腸癌患者的性別、年齡、腫瘤直徑、CEA水平、腫瘤位置高低均無關(均P>0.05)。MIM蛋白表達水平與臨床TNM分期呈正相關,即臨床TNM越晚期MIM蛋白表達水平越高(P<0.05)。MIM蛋白陽性患者5年生存率明顯低于陰性及弱陽性患者(P<0.05)。 結論 MIM蛋白高表達可能與直腸癌的發生及生物學行為有關,并提示預后不良。
癌 直腸組織 腫瘤轉移消失蛋白 臨床研究
【 Abstract】 Objective To investigate the expression of MIM (missing in metastasis)protein in rectal carcinoma and its clinicopathological significance.Methods The expression of MIM protein was detected by immunohistochemistry in tissue samples of rectal carcinoma(n=143),rectal adenoma(n=14)and normal rectal mucosa(n=37).Correlation between MIM expression and clinicopathological parameters was analyzed with Spearman rank regression.Postoperative 5-year survival was evaluated using Kaplan-Meier survival curve. Results The expression of MIM in rectal carcinoma was higher than those in normal rectal tissue(U=179.000,P<0.05)and rectal adenoma(U=112.500,P<0.05).The expression of MIM protein was correlated with clinical stage,lymphatic metastasis and tumor differentiation (separately U=256.000,227.000,236.500,all P<0.05),but not correlated with gender,age,tumor diameter,CEA level and tumor location(P>0.05).MIM expression was also correlated with TNM stage of rectal cancer(r=0.369,P<0.05).The 5-year survival in patients with positive MIM expression was significantly poorer than those with negative or weakly positive expression (32.6%vs 67.8%,χ2=6.712,P<0.05). Conclusion High expression of MIM protein may be associated in progression of rectal carcinoma and poor prognosis.
【 Key words】 Carcinoma Rectal tissue Missing in metastasis protein Clinical research
提高直腸癌診療水平、改善患者預后的主要措施是早期診斷和早期治療,因此研發早期分子標志物以提高對直腸癌診斷及預后判斷的水平是目前研究的重點[1]。腫瘤轉移消失(missing in metastasis,MIM)蛋白又稱腫瘤轉移抑制(metastasis suppressor 1,MTSS1)蛋白,是一種新發現的蛋白,參與多種腫瘤的生長轉移過程并有著廣闊的應用前景[2]。本研究通過免疫組化法觀察MIM蛋白在不同病理類型直腸癌組織中的表達情況,分析其對直腸癌的臨床意義。
1 材料和方法
1.1 病理標本 (1)直腸癌組:本院2004-01—2007-01手術切除的143例直腸癌患者的手術標本均行病理檢查確診為直腸癌,患者男81例,女62例,年齡36~82歲,平均57.7歲,術前均未行放療或化療。(2)直腸腺瘤組:同期經術后病理檢查證實為直腸腺瘤的14例患者的手術標本,患者年齡41~78歲,平均58.1歲。(3)直腸正常組織:取自上述37例直腸癌患者距腫瘤邊緣3cm以上的正常直腸組織,且病理檢查證實無癌細胞。
1.2 免疫組化染色檢測 MIM抗體 (兔多克隆抗體)及二抗購自美國eBioscience公司。使用LAB VISION 2D
1.3 結果判定 細胞膜及胞質有棕黃色染色為陽性反應,高倍鏡下計數500個細胞。綜合細胞染色強度和陽性細胞百分率作為判斷標準:不著色0分,淺黃色1分,棕黃色2分,深棕色3分;無染色陽性細胞為0分,陽性細胞<25%為1分,25%~50%為2分,51%~75%為3分,>75%為4分。染色強度和陽性百分率的乘積>3分為免疫反應陽性,按乘積分數將染色結果分為4個等級:陰性(-)0~2分,弱陽性(+)3~5分,中等陽性(++)6~8分,強陽性(+++)9~12分。
1.4 統計學處理 使用SPSS 13.0統計軟件。組間等級相關資料的比較采用秩和檢驗。兩因素相關性采用Spearman等級相關分析。繪制Kaplan-Meier生存曲線,采用Log-rank法檢驗生存率,檢驗水準α=0.05。
2 結果
2.1 MIM蛋白在直腸良惡性組織中的表達 MIM蛋白在絕大多數直腸癌組織中表達為陽性,有些甚至是強陽性,陽性表達位于胞質區域,部分胞質染色為棕黃色或棕褐色,細胞核內無表達(圖1a);而在大多數直腸腺瘤和正常組織中表達為陰性,少部分為弱陽性(圖1b、c)。MIM蛋白表達陽性率直腸正常組織為21.6%,直腸腺瘤組織為28.8%,兩者之間的差異無統計學意義(U=89.000,P>0.05);而直腸癌組織陽性率為83.2%,遠高于正常組織與直腸腺瘤組織,差異均有統計學意義(U=179.000、112.500,均P<0.05),詳見表1。另外早期(TNM分期為Ⅰ、Ⅱ期)直腸癌組織陽性率78.8%,亦高于正常組織與直腸腺瘤組織,差異均有統計學意義(U=228.000、198.000,均P<0.05),詳見表2。
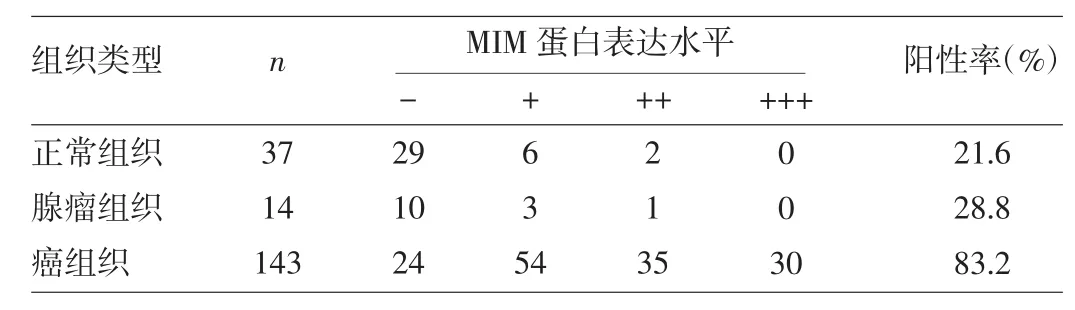
表1 不同直腸組織MIM蛋白表達水平的比較(例)
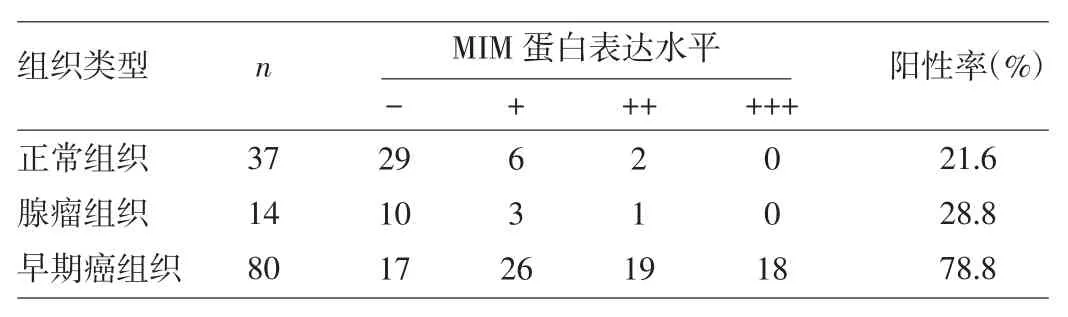
表2 直腸正常、腺瘤組織與早期直腸癌組織的MIM蛋白表達水平的比較(例)
2.2 直腸癌組織中MIM蛋白的表達與臨床病理參數的關系 MIM蛋白在直腸癌組織中的表達與性別、年齡、腫瘤大小、CEA水平及腫瘤位置高低無關,而與腫瘤是否處于早期、是否有3枚以上區域性淋巴結轉移以及分化程度有關,詳見表3。MIM蛋白表達水平與臨床TNM分期間呈正相關,即臨床TNM分期越晚,所對應的MIM蛋白表達水平越高,詳見表4。
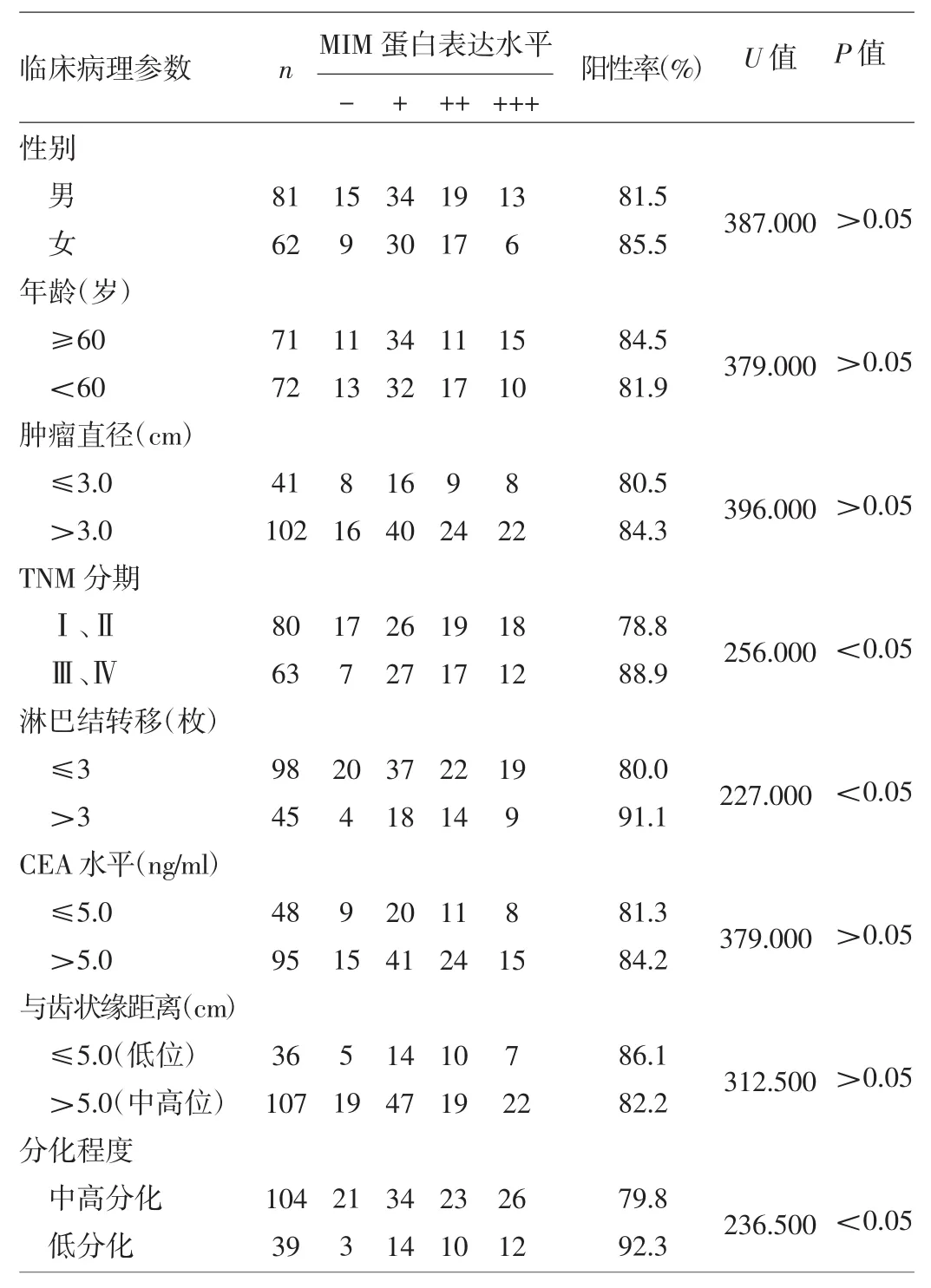
表3 臨床病理參數與直腸癌組織中MIM蛋白表達的關系(例)
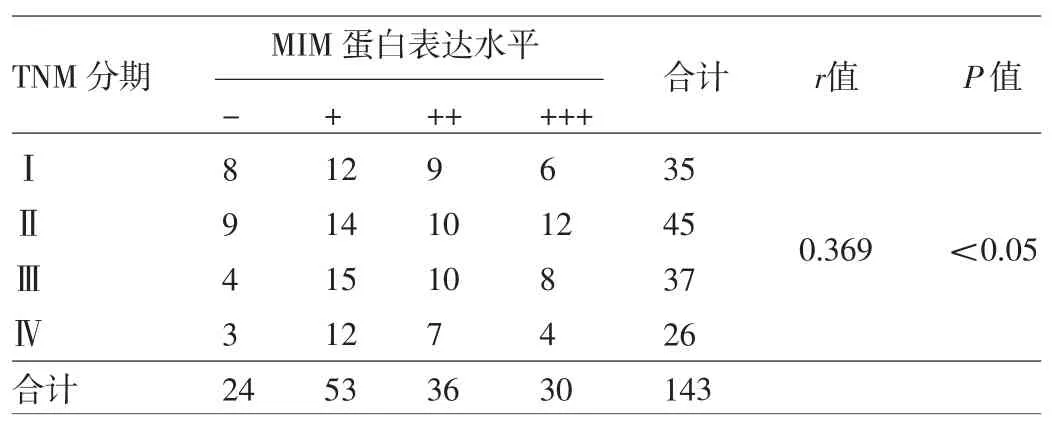
表4 TNM分期與直腸癌組織中MIM蛋白表達的關系(例)
2.3 MIM蛋白表達與直腸癌患者生存率的關系 143例直腸癌患者術后隨訪5年,其中10例失訪,實際隨訪133例。MIM蛋白陰性及弱陽性者共隨訪到87例,死亡28例,5年生存率為67.8%;MIM蛋白中等陽性和強陽性者共隨訪到46例,死亡31例,5年生存率32.6%, MIM蛋白陰性及弱陽性者5年生存率明顯高于MIM蛋白中等陽性和強陽性表達者,差異有統計學意義(χ2= 6.712,P<0.05),見圖2。
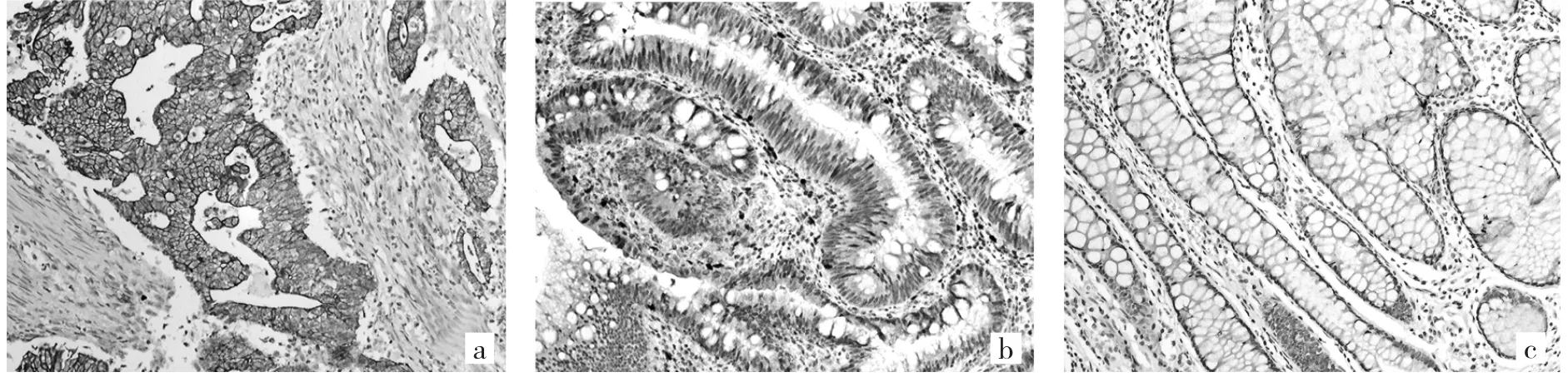
圖1 MIM蛋白在不同病理類型直腸組織中的表達(a:直腸癌中MIM蛋白強陽性表達;b:直腸腺瘤中MIM蛋白弱陽性表達;c:直腸正常組織中陰性表達;免疫組織化學染色,×200)
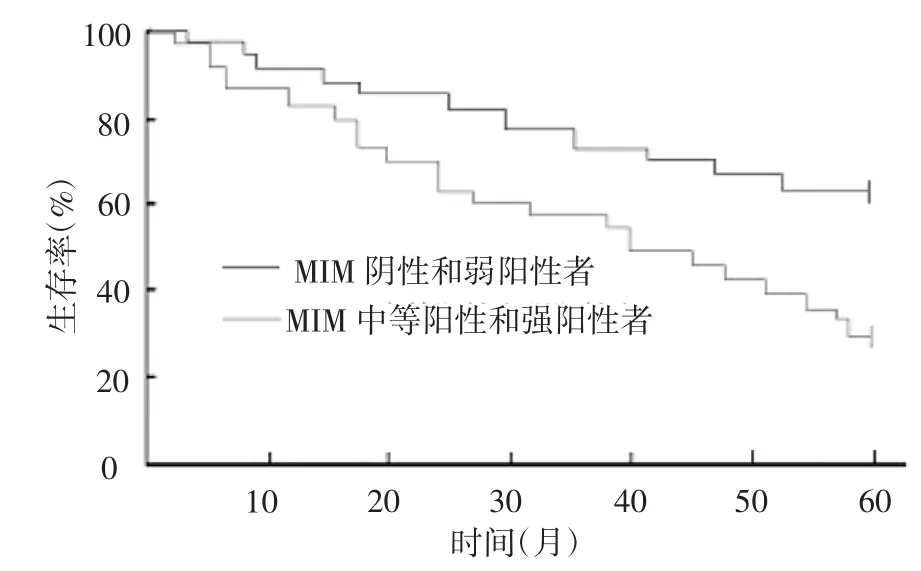
圖2 MIM蛋白表達與直腸癌患者的生存率關系
3 討論
MIM蛋白在腫瘤中的作用目前仍在探索之中。MIM基因最先由Lee等[3]于2002年在研究膀胱癌的轉移機制時通過改良的mRNA差異顯示技術發現,并認為該基因是腫瘤轉移抑制基因。Parr等[4]發現MIM蛋白在乳腺癌細胞中扮演一個控制轉移特性的角色,MIM蛋白低表達的乳腺癌患者,其生存率低,預后差。Dawson等[5]研究表明,MIM蛋白通過調控表皮生長因子信號通路從而抑制頭頸部鱗癌的轉移。以上研究都支持了MIM蛋白是一種新的腫瘤轉移抑制因子的觀點。但隨著研究的深入,越來越多的研究發現MIM蛋白還有諸多其他作用。Ma等[6]首次報道了人肝細胞癌中MIM mRNA的過表達可導致MIM蛋白的過表達,可促進肝細胞癌的早期發展。Xie等[7]認為MIM蛋白是一種多功能蛋白,在促進腫瘤的侵襲和轉移過程中發揮作用。這一觀點與Lee等[3]所認為的MIM基因是腫瘤轉移抑制基因的結論完全相反。Ma等[6]認為既往對MIM蛋白作用的研究結果不盡一致,甚至完全相反的原因可能與MIM蛋白表達具有組織類型特異性有關。此外,Mattila等[8]認為MIM基因不是腫瘤轉移抑制基因,而是作為與Rac、actin以及actin偽足形成相關蛋白相作用的支架蛋白。Lin等[9]認為可直接作用于肌動蛋白,并通過細胞內信號轉導途徑影響細胞骨架,與cortactin一起參與血小板源生長因子信號轉導途徑,從而改變細胞與基質間的黏附狀態。
MIM蛋白在腫瘤中所發揮的作用機制也是目前研究的熱點。MIM蛋白是一種新的肌動蛋白結合蛋白,基因定位于8q24.1上,通過結合細胞內不同的分子改變肌動蛋白的動力學特點,參與細胞骨架的重塑、信號轉導和轉錄活化等[10]。調節MIM蛋白表達的具體機制目前尚不清楚,可能與DNA甲基化相關,但MIM蛋白作為信號通路蛋白已得到證實。Callahan等[11]發現MIM基因是一個應答基因,它可能有Gli轉錄激活功能,MIM蛋白可與鋅指轉錄因子Glil/Gli2及Sufu結合形成三元復合體促進Gli介導的轉錄,激活Hedgehog(Hh)-Glioblas-toms(Gli)信號通路,因此,編碼MIM的基因被認為是SHh相關通路的基因,是SHh-Gli通路的新成員,在成瘤和瘤體生長過程中起促進作用,從而促進腫瘤細胞的增殖與侵襲。
在直腸癌的臨床治療中,有無淋巴結轉移及轉移淋巴結的數量是影響預后的重要因素之一[12]。Moran等[13]的研究表明,如果淋巴結轉移數量大于3枚,其局部復發率顯著升高,且5年生存率也明顯降低。因此,本研究在淋巴結轉移量上選用3枚作為分界點進行研究。本研究結果顯示,在直腸癌組中MIM蛋白的表達率明顯高于直腸正常組織組及直腸腺瘤組,提示其在腫瘤的形成中具有一定作用。此外,MIM蛋白的表達也與腫瘤的臨床病理特點相關,在低分化腫瘤中,陽性表達率明顯高于中、高分化腫瘤,這表明其可能參與腫瘤的分化調控。晚期直腸癌MIM蛋白的表達水平明顯高于早期直腸癌,且MIM蛋白表達水平與直腸癌TNM分期呈正相關,并也與是否有3枚以上淋巴轉移相關,這些結果提示MIM蛋白的表達與腫瘤的生物學行為相關,可能是腫瘤惡性程度的一種表現。以上研究結果提示MIM蛋白可能在直腸癌形成及進展中發揮重要作用,但具體機制仍需進一步研究。
總之,MIM蛋白在直腸癌早期就已經高表達且陽性表達者5年生存率下降,提示MIM蛋白可能成為早期發現及評估直腸癌等惡性腫瘤預后的重要指標之一,為臨床治療及預后評估提供新的靶點。
[1]呂有勇,于君.基因組醫學與結直腸癌的早期防治[J].中國普通外科雜志,2011,5(6):361-362.
[2]黃修燕,黃自麗,湯釗猷,等.轉移消失蛋白在腫瘤發生發展中的作用[J].腫瘤,2010,2(4):170-172.
[3]Lee Y G,Macoska S,Korenchuk S,et al.MIM,a potential metastasis suppressor gene in bladder cancer[J].Neoplasia,2002,4: 291-294.
[4]Parr C,Jiang W G.Metastasis suppressor 1(MTSS1)demonstrates prognostic value and anti-metastatic properties in breast cancer [J].Eur J Cancer,2009,45:1673-1683.
[5]Dawson J C,Timpson P,Kalna G,et al.Mtts1 regulates epidermal growth factor signaling in head and neck squamous carcinoma cells[J].Oncoqene,2011,19:1038-1047.
[6]Ma S,Guan X Y,Lee T K,et al.Clinicopathological significance of missing in metastasis B expression in hepatocellular carcinoma [J].Hum Pathol,2007,38:1201-1206.
[7]Xie F,Ye L,Ta M,et al.MTSS1:a multifunctional protein and its role in cancer invasion and metastasis[J].Front Biosci(Schol Ed), 2011,3:621-631.
[8]Mattila P K,Salminen M,Yamashiro T,et al.Mouse MIM,a tissue-specific regulator of cytoskeletal dynamics,interacts with ATP-actin monomers through its C-terminal WH2 domain[J].J Biol Chem,2003,278:8452-8459.
[9]Lin J,Liu J,Wang Y,et al.Differential regulation of cortactin and N-WASP-mediated actin polymerization bv missing in metaslasis(MIM)protein[J].Oncogenc,2005,24:2059-2066.
[10]Saarikangas J,Mattila P K,Varjosalo M,et al.Missinginmetastasis MIM/MTSS1 promotes actin assembly at intercellular junctions and is required for integrity of kidney epithelia [J].J Cell Sci,2011,15:1245-1255.
[11]Callahan C A,Ofstad T,Horng L,et al.MIM/BEG4 a soni Hedgehog-responsive gene that potentiates gli-dependent transcription[J].Genes Dev,2004,18:2724-2729.
[12]Mizukami Y,Ueda S,Mizumoto A,et al.Diffusion-weighted magnetic resonance imaging for detecting lymph node metastasis of rectal cancer[J].World J Surg,2011,35:895-899.
[13]Moran M R,James E C,Rothenberger D A,et al.Prognostic valve of positive lymph nodes in rectal cancer[J].Dis Colon Rectum,1992,35:978-984.
(本文編輯:沈叔洪)
Expression of MIM protein in rectal carcinoma and its clinicopathological significance
ZHANG Haifeng,LI Jinhai,DAI Huawei,et al.
Department of General Surgery,the Third Affiliated Hospital of Wenzhou Medical College,Rui’an 325200,China
325200 瑞安,溫州醫學院附屬第三醫院普通外科
張海峰,E-mail:zhanghaifeng1020@126.com全自動免疫組化染色儀,以Elivision二步法進行染色。并使用泰康全自動組織脫水機(TKY-TSF)、惠達組織包埋機(HD-310A)、惠達切片機(HD-325B)、惠達組織漂烘儀(HD-330)、OLYMPUS BS51顯微鏡及哈爾濱海慈病理圖文分析系統。石蠟切片常規脫蠟、水化,其余操作按照Elivision試劑盒說明書進行。檢測過程均在自動免疫組化染色儀中按照事先編好的程序完成。
2012-05-07)

