響應面法優化酶法制備豬血紅蛋白抗氧化肽
孔卓姝 劉海杰 成曉瑜 張順亮 潘曉倩
摘 要:以豬血紅蛋白為原料,研究蛋白酶水解制備抗氧化肽的工藝。通過研究酶解時間、酶與底物比、酶種類對制備的抗氧化肽還原力和水解度影響,篩選出最佳蛋白酶及制備抗氧化肽的最佳工藝條件。結果表明:7種酶中,胃蛋白酶的水解度和還原力最佳。胰蛋白酶和胃蛋白酶復合水解比單酶水解的水解度提高了11.83%,還原力沒有顯著性差異。在此基礎上設計單酶響應面,得到最佳還原力酶解條件為:酶解溫度37.31℃、pH1.95、酶與底物比3526.74U/g。脫色條件為活性炭用量3%、pH4.0、溫度70℃、脫色時間1h,粉末狀活性炭的脫色率達到85.69%,蛋白質損失率20.32%。
關鍵詞:豬血紅蛋白;抗氧化肽;蛋白酶;活性炭
Optimization of Enzymatic Preparation of Antioxidant Peptide from Porcine Hemoglobin
KONG Zhuo-shu1,2,LIU Hai-jie2,CHENG Xiao-yu1,*,ZHANG Shun-liang1,PAN Xiao-qian1
(1. China Meat Research Center, Beijing 100068, China;
2. College of Food Science and Nutritional Engineering, Agricultural University, Beijing 100083, China)
Abstract:The enzymatic preparation of antioxidant peptides from porcine hemoglobin was studied. The effects of enzymatic hydrolysis time, enzyme/substrate ratio, and different proteases on the degree of hydrolysis (DH) and reducing power (RP) of antioxidant peptides were examined. Finally, the optimum enzyme and hydrolysis conditions for preparing antioxidant peptides were established. Pepsin was the best among seven proteases tested as evaluated by both DH and RP of antioxidant peptides. The combined use of pepsin with trypsin increased the DH by 11.83% compared with its single use without leading to a significant difference in the RP. Employing response surface methodology, the optimum hydrolysis conditions using pepsin alone were determined as follows: hydrolysis temperature of 37.31 ℃, initial pH 1.95 and enzyme/substrate ratio of 3526.74 U/g. The resulting hydrolysate was decolorized by adding 0.3% of activated charcoal and incubating at 70 ℃ for 1 h. Under this condition, the decolorization efficiency was 85.69% and the protein loss was about 20.32%.
Key words:porcine hemoglobin;antioxidant peptides;protease;activated carbon
中圖分類號:TS251.93 文獻標志碼:A 文章編號:1001-8123(2013)09-0001-06
2012年,我國豬肉產量持續增長達到5335萬t,與上年相比增長5.6%。年末生豬存欄47492萬頭,增長1.6%;生豬出欄69628萬頭,增長5.2%[1]。在豬肉產量迅速增加的同時,作為生豬屠宰加工的重要副產品——豬血也大量產生。在生產中,大量豬血的排放不僅浪費資源,而且對環境造成了污染。我國對豬血的利用極少,除了做一些血豆腐、血腸等,大多用在動物飼料中,有效利用豬血的產品比較單一。而在國外,豬血大多被用來開發肽類試劑、藥物以及功能性食品添加劑等。
近年來,從動物和植物中得到的生物活性肽受到廣泛關注。由于這些蛋白資源十分豐富和廉價,而且通過水解蛋白得到的生物活性肽價格便宜、安全性高、工藝簡單、便于工業化生產,因此也受到越來越多科學家和各國政府的關注。水解得到的生物活性肽具有低黏度、起泡性和溶解度高等特點。生物活性肽主要分為內源性生物活性肽和外源性生物活性肽兩種。內源性生物活性肽天然存在于機體或組織的內部,含量很低,而外源性生物活性肽一般都以無活性的形式存在于蛋白質氨基酸序列中,可以通過水解蛋白質的方法進行大量制備,具有很大的工業化應用潛力。實驗證明,要想從大豆中獲得大量的功能性肽,需要嚴格控制酶解的反應條件[2]。目前抗氧化肽的研究不僅僅局限在植物抗氧化肽的提取,例如核桃[3],在動物中提取抗氧化肽也得到了廣泛關注,例如雞胸肉[4]、鯊魚[5]、牛奶[6]等。而豬血中含有大量的血紅蛋白,血紅蛋白生物活性肽具有許多重要的功能活性[7],可被開發為功能食品、醫藥及化妝品等具有高附加值的生物制品。
最近幾年,蛋白質酶解的研究很多,不僅是單酶酶解,為了提高水解的效率,很多人開始研究復合酶解。何莉萍等[8]在中性蛋白酶和堿性蛋白酶水解玉米蛋白中已經發現采用中性蛋白酶和堿性蛋白酶復合水解玉米蛋白比單一酶水解的效果好。李磊等[9]也在微波復合酶水解植物蛋白制取小分子多肽研究中發現微波加熱和復合酶水解是將蛋白分解成多肽的高效方法。本實驗首先研究了豬血中提取生物活性肽最佳酶的篩選,其次對單酶水解和雙酶復合水解進行比較,最后通過響應面優化單酶酶解工藝并研究了豬血血紅蛋白酶解液的活性炭脫色效果。
1 材料與方法
1.1 材料與試劑
新鮮豬血,采自北京資源集團。
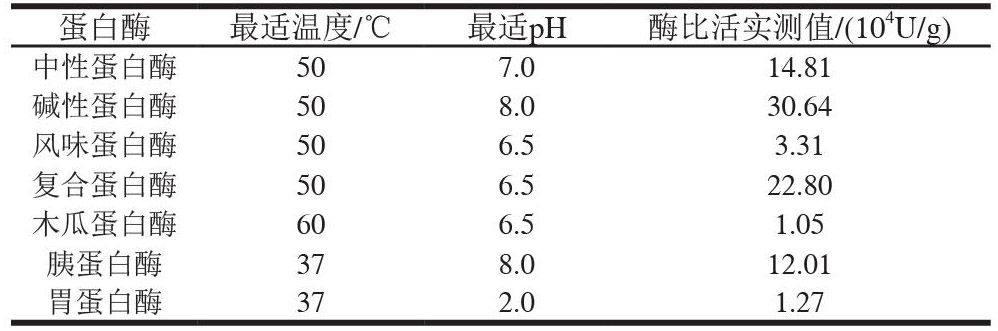
氫氧化鈉、鹽酸、三氯化鐵、鐵氰化鉀、三氯乙酸(均為分析純) 北京化工廠;酪氨酸 北京奧博星生物技術責任有限公司;Folin-酚 美國Sigma公司;甲醛溶液(分析純,含量37.0%~40.0%) 西隴化工股份有限公司;中性蛋白酶(枯草芽孢桿菌)、堿性蛋白酶(枯草桿菌)、風味蛋白酶、復合蛋白酶(米曲霉) 諾維信(中國)投資有限公司;木瓜蛋白酶(木瓜)、胰蛋白酶(胰臟)、胃蛋白酶(豬胃) 國藥集團化學試劑有限公司。
1.2 儀器與設備
PB-10型數顯酸度計 賽多利斯科學儀器有限公司;KDY-9820凱氏定氮儀 北京市通潤源機電技術有限責任公司;GL-20G-II型臺式高速離心機 上海安亭科學儀器廠;SHZ-88型水浴恒溫振蕩器 金壇市醫療儀器廠;PR203型電子天平 梅特勒-托利多儀器有限公司;GZX-9240 MBE型電熱鼓風干燥箱 上海博訊實業有限公司醫療設備廠;SCIENTZ-IID型超聲波細胞破碎機 北京久潤天誠科技發展有限公司;KQ-600DE型數控超聲波清洗器 昆山市超生儀器有限公司;T6新世紀紫外-可見分光光度計 北京普析通用儀器有限責任公司。
1.3 方法
1.3.1 豬血紅蛋白制備
在屠宰過程中采集血液,并迅速加入檸檬酸鈉(5g/L)抗凝,4℃保存。將新鮮豬血在4℃、8000×g條件下高速冷凍離心10min,獲得紅血球及血漿;收集紅血球加入同等體積的蒸餾水,超聲波細胞破碎輔助溶血20min,然后在4000×g、4℃條件下冷凍離心10min,得到血紅蛋白溶液4℃保存,備用。
1.3.2 血紅蛋白含量測定
采用凱氏定氮法[10]。
1.3.3 酶活力測定
采用Folin-酚法[11]。
1.3.4 豬血紅蛋白酶解物的制備
取血紅蛋白溶液90℃加熱10min后,均質10min,在各酶最適溫度及pH值條件下(表1)加入酶制劑,并根據各自實驗條件進行酶解反應,酶解過程不斷攪拌,并且通過添加1mol/L NaOH溶液或HCl溶液保持pH值不變。按照要求取一定量的酶解液,沸水浴10min,冷卻,調節pH值至7.0左右,8000×g離心15min得到酶解液,上清液備用。
1.3.5 水解度的測定
采用雙指示劑甲醛滴定法[12]。每隔1h取出血紅蛋白水解物。取1mL酶解物2份,分別置于三角瓶中,加50mL水溶解充分。其中1份加中性紅指示劑,用NaOH標準溶液滴定至琥珀色為終點;另1份加百里酚酞及中性甲醛,搖勻、靜置,用NaOH標準溶液滴定至淡藍色為終點。記錄2次消耗的堿液體積。按式(1)計算。
(1)
式中:V1為用百里酚酞作指示劑時標準堿溶液的滴定體積/mL;V2為用中性紅作為指示劑時標準堿溶液的滴定體積/mL;V3為酶解液過濾的體積/mL;N為標準堿液濃度/(mol/L);m為樣品質量/g;0.014為氮的毫克當量;V為取樣測量體積/mL。
1.3.6 還原力的測定[13]
取待測液1mL,加入2.5mL 0.2mol/L磷酸緩沖液(pH6.6)和2.5mL質量分數1%的鐵氰化鉀溶液混勻,50℃水浴20min后急速冷卻,加入2.5mL質量分數10%三氯乙酸(TCA)溶液,充分混勻后3000×g離心10min。取上清液2.5mL,加入2.5mL蒸餾水及0.5mL質量分數1%的三氯化鐵充分混勻,室溫反應10min后于波長700nm處測定吸光度(A700nm)。吸光度越大,說明還原力越強,比較酶解物、豬血紅蛋白溶液的還原力。
1.3.7 色素含量的測定[14]
用722S分光光度計在色素的最大吸收波長處(388nm)測其吸光度,對于濃度太高的溶液,因其色素含量太高,可以采取示差法[15]進行測定。
式中:OD1和OD2分別為脫色前溶液和脫色溶液后在波長388nm的光密度值。
1.3.8 蛋白質損失率的測定[16]
蛋白質含量的損失趨勢可以反映出氨基酸和多肽含量損失的趨勢,用紫外分光光度計分別測波長280、260nm處的吸光度。
式中:F為校正因子,由OD280nm/OD260nm查表得F值;D為石英比色皿的厚度/cm;N為稀釋倍數;OD280nm為樣品液在波長280nm的光密度值。
1.3.9 酶法制備豬血紅蛋白抗氧化肽的工藝優化
1.3.9.1 蛋白酶的篩選
(1)蛋白酶的初選
選取中性蛋白酶、堿性蛋白酶、風味蛋白酶、復合蛋白酶、木瓜蛋白酶、胰蛋白酶、胃蛋白酶,在各酶最佳水解溫度、pH值和統一酶和底物比(800U/g)條件下進行豬血紅蛋白水解實驗,水解8h,研究不同酶作用下豬血紅蛋白酶解液的水解度和還原力的變化規律。
(2)蛋白酶的復選
根據上述結論,選擇3種酶,在其最適溫度及pH值條件下加入酶制劑啟動酶解反應,酶與底物比分別為1000、1500、2000、2500、3000U/g,反應時間6h。選取最佳酶解酶和底物比。
(3)雙酶酶解與單酶酶解比較
采用胰蛋白酶,在其最適溫度和pH值條件下,加酶量1500U/g,酶解3h;然后調節至胃蛋白酶的最適水解溫度和pH值,加入胃蛋白酶1500U/g,酶解3h,得到酶解液。比較胰蛋白酶和胃蛋白酶復合酶解與上述得到的最佳蛋白酶在3000U/g條件下單酶酶解所得酶解液,以選取最佳水解方式。
1.3.9.2 酶解條件響應面優化試驗
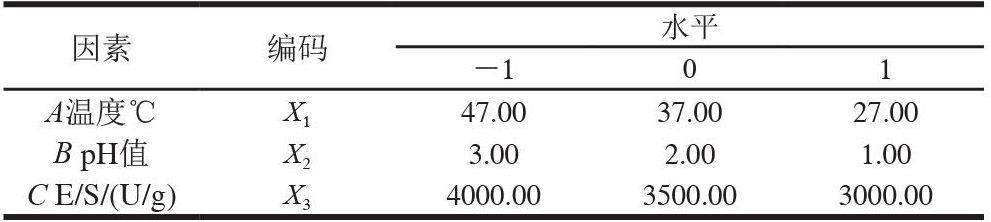
根據前期實驗研究結果,固定水解酶為胃蛋白酶,酶解反應時間6h,選取溫度、pH值、酶與底物比(E/S)進行3因素3水平響應面試驗,因素水平編碼見表2。
以還原力作為提取抗氧化肽效果好壞的主要評價指標。將上述酶解方法及條件下得到的酶解上清液作為樣品測定其還原力。
1.3.9.3 活性炭脫色工藝對酶解血紅蛋白多肽還原力的影響
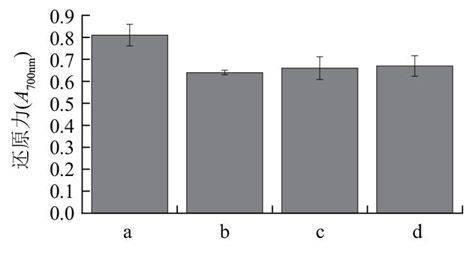
由于血紅蛋白酶解液具有不易接受的紅褐色,將其直接應用于食品及藥物領域受到一定限制,因此一般進行脫色工藝改變其色澤。將具有最佳還原力的酶解液冷凍干燥保存、備用。陳文輝等[17]研究發現:當活性炭用量3%、pH 4.0、溫度70℃、脫色時間1h時,豬血酶解液的脫色效果明顯。在此條件下,分別取酶解物1g溶于100mL水中,標號a、b、c、d。調節酶解物溶液的pH值至4.0。b、c、d分別加入0.03g的粉末狀、無定形粒狀、片狀的活性炭。b、c、d在70℃條件下水浴1h。
1.4 統計分析
本實驗所有結果均重復3次,取平均值。采用Duncan多重比較檢驗法進行顯著性檢驗,在P<0.05水平上差異顯著。采用Origin軟件進行統計分析。
2 結果與分析
2.1 蛋白酶的篩選
2.1.1 初選
由于酶自身特異性導致對蛋白質底物的作用位點有較大區別,使得各自水解得到的短肽在數量及生物活性方面都存在較大不同,如胰蛋白酶是1種絲氨酸內切酶,其僅能水解R1為Arg或Lys殘基側鏈的肽鍵;風味蛋白酶是1種內切酶與外切酶的混合酶,其內切作用位點多為芳香族氨基酸。因此,隨著血紅蛋白酶解時間的延長,酶解產物的活性肽序列不斷變化,導致具有生物活性的肽段在不同時間段總體含量不同。7種蛋白酶酶解過程水解度和還原力的變化如圖1所示。
由圖1B可知,血紅蛋白經7種蛋白酶酶解所得的水解液與血紅蛋白溶液相比,還原力都有所增加,在360min時,血紅蛋白酶解液的水解度為:胃蛋白酶>胰蛋白酶>木瓜蛋白酶>中性蛋白酶>堿性蛋白酶>復合蛋白酶>風味蛋白酶。各酶的最高還原力為:胃蛋白酶>胰蛋白酶>中性蛋白酶>木瓜蛋白酶>堿性蛋白酶>復合蛋白酶>風味蛋白酶。圖1A、圖1B比較可以發現,一定的水解可以提高血紅蛋白溶液的還原力,但是還原力并不是與水解度的大小成正相關,血紅蛋白酶解液還原力的大小還受其他因素的影響,例如不同酶的特異性水解位點的不同等。有研究表明,蛋白質水解的抗氧化性與自身氨基酸的組成有關[18]。
因為本實驗主要研究抗氧化肽的酶法提取,根據水解度的變化以及還原力的不同,最終選胃蛋白酶、胰蛋白酶、中性蛋白酶做下1步實驗。
2.1.2 復選
胃蛋白酶、胰蛋白酶、中性蛋白酶分別在它們的最適pH值和溫度以及不同的酶與底物比的條件下反應,反應時間6h。
由圖2可知,隨著酶與底物比的增加,水解度逐漸上升最終趨于平穩,還原力也有所上升。并且雖然胰蛋白酶的水解度與胃蛋白酶相比,相差不大,但是其還原力明顯低于胃蛋白酶。這可能與胃蛋白酶的結構,以及水解的特異性位點有關,胃蛋白酶水解的肽端大多是具有苯環的芳香氨基酸、帶支鏈的疏水性氨基酸等,可能會對提高酶解液的還原力有一定幫助。胃蛋白酶的還原力明顯高于其他兩種酶。
2.1.3 雙酶酶解與單酶酶解比較
由表3可知,在反應溫度、pH值、時間等相同的條件下,胰蛋白酶和胃蛋白酶復合水解能有效提高水解度,但是酶解液的還原力并沒有明顯的下降。其原因可能是:胰蛋白酶是1種絲氨酸內切酶,而胃蛋白酶主要作用于具有苯環的芳香族氨基酸、帶支鏈的疏水性氨基酸等的肽端。因此這兩種酶復合水解比單一酶水解效果好,水解度高。復合水解比單酶水解的水解度提高了11.83%,酶解液還原力下降了0.08%,無明顯變化。
由2.1節可知,酶解液的水解度與還原力之間沒有直接的相關性,因此水解度并不適合作為抗氧化肽制備中的主要評價指標。其原因可能是酶解液的還原力的大小與酶解過程中產生不同活性肽的序列不斷變化,在不同時間段抗氧化活性肽的含量不同[19]。所以,在后續的試驗中,將把還原力作為抗氧化肽工藝優化中的主要指標。
2.2 響應面分析試驗
2.2.1 響應面試驗結果
響應面試驗設計見表4,方差分析見表5。由表5可知,影響酶解液還原力的因素依次是E/S 2.2.2 響應面優化 a. 酶解pH值與E/S b. 酶解溫度與E/S c. 酶解溫度與pH值 圖 3 溫度、pH值和E/S對還原力影響的響應面 Fig.3 Response surface plots for the effect of three hydrolysis conditions on RP 圖3表明,溫度對酶解液的還原力影響較為明顯,這可能主要因為溫度低時,蛋白酶的活性較差,不能完全酶解血紅蛋白,所以還原力較低,而當溫度過高時,不僅蛋白酶可能變性,而且所產生的抗氧化肽也可能發生變性,而失去還原力。
通過Design Expert軟件分析,血紅蛋白通過胃蛋白酶酶解所得酶解液還原力最好的工藝條件為:酶解溫度37.31℃、pH1.95、酶與底物比3526.74U/g,此時所得酶解液的還原力為2.665。
2.3 脫色活性炭的選擇
a.對照;b.粉末型活性炭;c.粒狀活性炭;d.片狀活性炭。
圖 4 不同活性炭脫色對還原力的影響
Fig.4 Effect of different forms of activated carbon on RP
由表6可知,粉末狀活性炭脫色率最好達到85.69%,蛋白質損失率達到20.32%,略高于粒狀活性炭的蛋白質損失率。其原因可能是:活性炭具有較大的表面積,而且炭粒中還有更細小的孔——毛細管,有很強的吸附性能。酶解液中含有大量的大分子蛋白質,因此隨著活性炭表面積的增加,不僅對色素的吸附增加而且對蛋白質的吸附也增加。由圖4可知,通過粉末狀活性炭處理的酶解液的還原力略低于其他兩種活性炭,與脫色前相比降低了21.02%。這是由于隨著活性炭粒徑的增加,蛋白質、肽類等物質損失增加,使得酶解液的還原力下降。由表6和圖4可以看出粉末狀活性炭的脫色效果較好,且與其他兩種相比對酶解液的還原力影響差別不大,因此選擇選擇粉末狀活性碳作為酶解液脫色劑。
3 結 論
篩選試驗結果表明,7種蛋白酶中,胃蛋白酶為最佳的酶解血紅蛋白制備抗氧化肽的蛋白酶。復合水解實驗發現,胰蛋白酶和胃蛋白酶復合水解比單酶水解所得酶解液的水解度提高了11.83%,而酶解液的還原力無明顯變化。在酶解時間360min條件下,經響應面優化所得酶解最佳條件為:酶解溫度37.31℃、pH1.95、酶與底物比3526.74U/g,此時酶解液的還原力為2.665。脫色試驗表明,粉末狀活性炭的脫色率達到85.69%,高于其他兩種活性炭,而蛋白質損失率20.32%,低于其他兩種活性炭,通過粉末活性炭脫色所的酶解液的還原力較原酶解液降低了21.02%。
雖然豬血成分復雜特殊,但是近年來越來越多的研究表明豬血對提高機體免疫力、抗癌、健體等方面具有重要作用,另外豬血中還含有人體所必需的無機鹽,特別是鐵的含量極其豐富。血紅蛋白酶解液中除了抗氧化肽,還含有許多功能性肽(如抗菌肽、ACE等)及其他雜質,如何高效率提純凈化抗氧化肽有待進一步研究。
參考文獻:
[1] 新華社. 2012年國民經濟和社會發展統計公報[EB/OL]. (2013-2-23) [2013-8-23]. http://news.xinhuanet.com/politics/2013-02/23/c_114772758_4.htm.
[2] Adler-Nissen J. Determination of the degree of hydrolysis of food protein hydrolysates by trinitrobenzenesulfonic acid[J]. Journal of Agricultural and Food Chemistry, 1979, 27(6): 1256-1262.
[3] Chen Ning, Yang Hongmei, Sun Yi, et al. Purification and identification of antioxidant peptides from walnut (Juglans regia L.) protein hydrolysates[J]. Peptides, 2012, 38(2): 344-349.
[4] Sun Yangying, Pan Daodong, Guo Yuxing, et al. Purification of chicken breast protein hydrolysate and analysis of its antioxidant activity[J]. Food and Chemical Toxicology, 2012, 50(10): 3397-3404.
[5] Bougatef A, Hajji M, Balti R, et al. Antioxidant and free radical-scavenging activity of smooth hound (Mustelus mustelus)muscle protein hydrolysates obtained by gastrointestinal proteases[J]. Food Chemistry, 2009, 114(4): 1198-1205.
[6] Pihlanto A. Antioxidative peptides derived from milk proteins[J]. International Dairy Journal , 2006, 16(11): 1306-1314.
[7] Sarmadi B H, Ismail A. Antioxidative peptides from food proteins: a review[J]. Peptides, 2010, 31(10): 1949-1956.
[8] 何莉萍, 劉良忠. 中性蛋白酶和堿性蛋白酶對玉米蛋白水解作用的研究[J]. 食品科學, 2008, 29(3): 152-157.
[9] 李磊, 陳均平, 張海平. 微波復合酶水解植物蛋白制取小分子多肽的研究[J]. 安徽農業科學, 2007, 35(19): 5655-5660.
[10] 許安邦, 林維宣, 張水華, 等. 食品分析[M]. 北京: 中國輕工業出版社, 2009.
[11] 國家標準化管理委員會. GB/T 23527—2009 蛋白酶酶制劑[S]. 北京: 中國標準出版社, 2009.
[12] 黃煥, 王欣, 劉寶林. 魚鱗膠原蛋白水解度兩種測定方法的比較[J]. 食品工業科技, 2010, 31(3): 354-356.
[13] 孫騫, 胡鑫, 羅永康, 等. 豬血紅蛋白抗氧化肽的酶法制備及其體外抗氧化活力觀察[J]. 中國農業大學學報, 2008, 13(4): 77-81.
[14] 馬美湖, 于美娟. 畜禽血液的脫色技術研究進展[J]. 肉類工業, 2004(10): 25-26.
[15] 賈之慎. 無機及分析化學[M]. 北京: 中國農業出版社, 2009.
[16] 于長青, 任泊曉, 修峰. 鵝血酶解液活性炭脫色效果的研究[J]. 中國食品添加劑, 2007(1): 66-69.
[17] 陳文輝, 楊萬根, 馬美湖, 等. 豬血酶解液活性炭脫色方法研究[C]//第五屆中國肉類科技大會論文集. 北京: 中國畜產品研究會, 2009: 338-340.
[18] Thiansilakul Y, Benjakul S, Shahidi F. Compositions, functional properties and antioxidative activity of protein hydrolysates prepared from round scad (Decapterus maruadsi)[J]. Food Chemistry, 2007, 103(4): 1385-1394.
[19] Thiansilakul Y, Benjakul S, Shahidi F. Antioxidative activity of protein hydrolysate from round scad muscle using alcalase and flavourzyme[J]. Journal of Food Biochemistry, 2007, 31(2): 266-287.

