高效抑氨芽孢菌的篩選
劉乃芝,陳 靜,徐 輝,閆福海,谷 巍
(山東寶來利來生物工程股份有限公司,山東 泰安 271000)
隨著我國畜牧業生產規模化、集約化程度的不斷發展,畜禽產生的大量糞尿和有毒有害氣體(例如NH3、H2S、CH4、吲哚、糞臭素等)對環境的污染不斷加劇[1-3]。不僅對人類的健康造成極大的威脅,而且嚴重影響著畜禽健康和生產性能的發揮[4-8]。隨著公眾環境意識的進一步增強,畜禽業對于環境的污染也面臨著很大的壓力;對畜禽糞污的處理國內外已研究出許多方法,除了通過合理的營養配方、科學的畜牧場規劃設計和飼養管理以外,近年來發展起來的微生物處理方法更是研究熱點。微生物除臭即利用微生物進行除臭,因具有除臭效率高、無二次污染、所需設備簡單等優點,成為當前研究的主要方向[9-14]。研究發現,NH3揮發量與糞便中其他致臭物質揮發高度相關(R=0.94),減少NH3揮發,可減少糞便惡臭[15]。氨氣濃度的高低常作為衡量養殖場環境空氣好壞的重要指標之一[16]。因此,篩選高效的氨同化微生物,進行生物脫臭,是控制養殖場惡臭的一個重要研究方向。本研究是在前人研究的基礎上,對本研究室前期土壤和污水中分離的百余株芽孢菌進行氨氮降解菌的篩選,以期獲得降氨、除臭效果最佳的芽孢桿菌,并對其效果進行驗證。
1 材料與方法
1.1 試驗材料
菌種:由寶來利來生物工程股份有限公司生物研究院提供芽孢桿菌127株。
芽孢桿菌培養基:葡萄糖0.2%,蛋白胨1%,氯化鈉0.5%,酵母膏0.5%,pH 7.0。
紫色石蕊的配制:在250mL的燒杯中注入蒸餾水150mL,加入半藥匙石蕊粉末,微熱至50~60℃,攪動加速溶解形成深藍紫色溶液,即原液,備用。不斷攪拌的條件下,在藍紫色石蕊原液中逐滴加入極稀的磷酸溶液,直到溶液變紫為止。若磷酸溶液稍過量,則會調成紅色石蕊。
BTB溶液:1%溴百里酚藍的酒精溶液。
氮素-限制性培養基:葡萄糖2.5 g,NH4Cl 0.125 g,NaCl 0.25 g,MgSO4· 7H2O 0.25 g,Mn-Cl2· 4H2O 0.05 g,K2HPO40.5 g,KH2PO41.6 g,1%ZnSO42mL,CoCl20.002 g,用0.45μm濾膜除菌,pH 7.0~7.2。
抑氨菌富集培養液:(NH4)2SO42.0 g,K2HPO41.0 g,MgSO4· 7H2O 0.5 g,CaCO35.0 g,FeSO4·7H2O 0.4 g,NaCl 2.0 g,蒸餾水 1 000 mL,pH 7.2, 1×105Pa滅菌20min[15]。
1.2 試驗方法
1.2.1 降氨菌的初篩
將芽孢菌127株分別接種到含50mL無菌芽孢桿菌液體培養基中,37℃、180 rpm搖床培養24 h制備成種子液,在無菌超凈臺內用滅菌槍頭吸取少量種子液,點在含有紫色石蕊的氮素-限制性平板培養基上,37℃條件下培養24 h后,在此平板培養基上均勻地覆蓋上BTB溶液,觀察菌落及其周圍的染色環,并測定其直徑大小。根據式(1)評定微生物利用氨的強弱。

其中D為菌環的平均直徑(cm),d為菌落的平均直徑(cm)。平均直徑(cm)=(縱向直徑+橫向直徑)/2,直徑測量值精確到0.01 cm[14]。
1.2.2 降氨菌的復篩
抑氨菌的篩選:將種子液按2%的接種量接入裝有100mL抑氨菌富集培養基的三角瓶中(同時設兩個對照,分別為加入等量的培養基和無菌水),每組兩個重復,37℃,180 rpm搖床培養15 d,每隔3 d檢測1次培養基中的氨氮含量,檢測前在無菌超凈臺中取樣,5 000 rpm離心10min,上清液采用納氏比色法進行氨氮含量的檢測。
1.2.3 對糞便中氨氮的降低效果試驗
將復篩過程中氨氮去除率>20%的菌株進行糞便中氨氮的降低效果試驗。將各菌株以2%接種量(對照組為等量無菌水)添加入裝有100 g新鮮雞糞的三角瓶中,每菌株2個平行,攪拌均勻,并在三角瓶中吊入裝有20mL 2%硼酸吸收液的50mL三角瓶,放置于室溫并密封,每隔24 h取出各組盛有硼酸吸收液的三角瓶,以0.010 68mol·L-1硫酸溶液進行滴定,指示劑為溴甲酚綠-甲基紅指示液,滴定過程中以溶液顏色由藍綠色變成灰紫色為終點。各組取出硼酸吸收液后敞口1 h,之后再放入等量硼酸并重新密封,共測定4 d,計算氨氮濃度及氨氮去除率,其計算式見式2~3[15]。
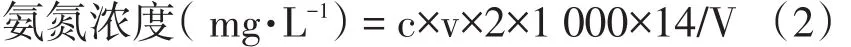
式中c為滴定用硫酸溶液的物質的量濃度,mg·L-1;v為滴定各組硼酸吸收液消耗硫酸溶液體積的平均值,mL;14為氮的質量分數,g·mol-1;V為2%硼酸吸收液體積,mL。
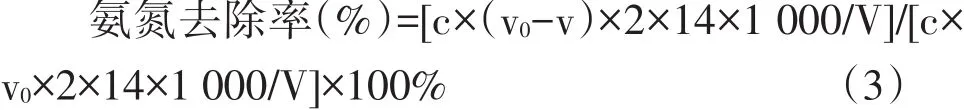
式中,c為滴定用硫酸溶液物質的量濃度,mol·L-1;v0為滴定對照組消耗硫酸溶液體積的平均值,mL;v為滴定菌株純培養液消耗硫酸溶液體積的平均值,mL;14為氮的質量分數,g·mol-1;V為硼酸吸收液體積,mL。
1.3 統計分析
試驗數據采用Excel進行統計分析,結果以平均值表示。
2 結果與分析
2.1 降氨菌的篩選
菌種資源中心提供的127株芽孢菌,經過初步篩選之后,有89株芽孢桿菌菌落周圍形成黃色暈環。其原因為芽孢桿菌接種到氮素限制性鑒別平板培養基上之后,隨著芽孢桿菌對氨同化的進行,培養基中的含氮成分逐漸減少,并被消耗掉,菌落周圍的pH逐步降低,進而使培養基與添加的溴百里酚藍指示劑發生顯色反應,在菌落周圍形成黃色環。由于菌落形態不規則,因此菌落周圍的暈環無法精確測量,通過大批量試驗結果總結發現,只要菌株能在此培養基上生長,就可在菌落周圍見黃色暈環,即該菌株可以利用培養基中的氨氮。通過對89株芽孢桿菌在抑氨富集培養基中的復篩,得到與對照組相比氨氮清除率>20%的有6株,氨氮清除率>20%的菌株見表1。
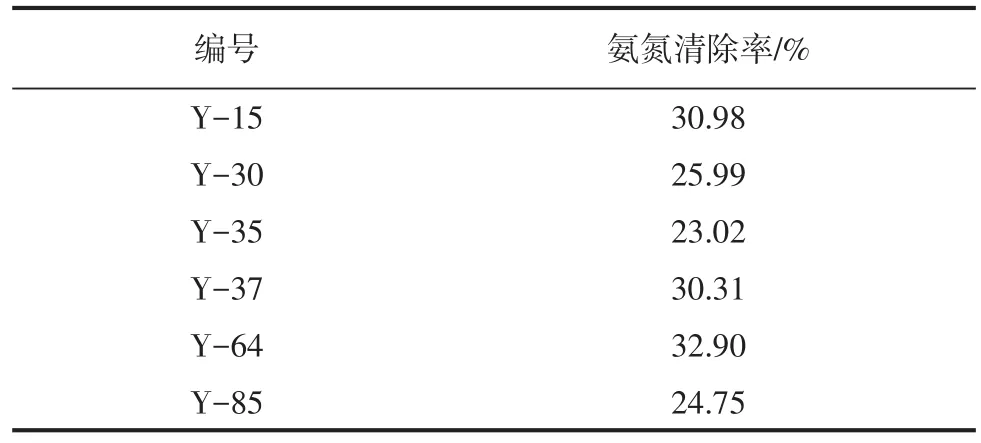
表1 氨氮清除率>20%的菌株
2.2 對糞便中氨氮的降低效果試驗
將前期篩選出的氨氮降解率>20%的6株芽孢桿菌進行糞便中氨氮降低驗證效果試驗。各組的氨氮濃度見表2。
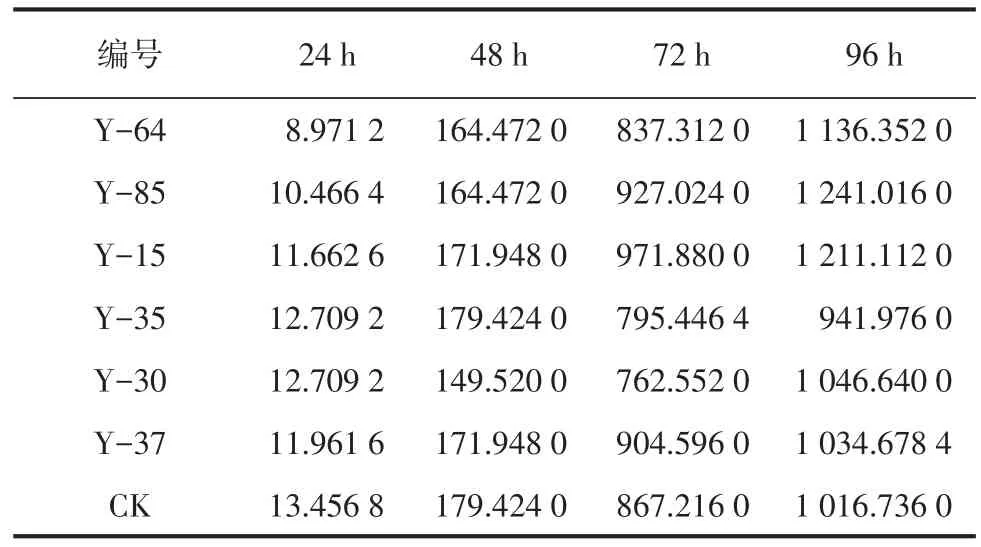
表2 各組不同時段的氨氮濃度mg·L-1
從表2中可以看出,隨著時間的延長,各組的氨氮濃度均逐漸增加并趨于穩定。本試驗中選擇每24 h打開各組蓋子敞口1 h,目的是為了增加容器內的空氣流通,保證芽孢桿菌及糞便中其他需氧菌的正常生長活動,在準確收集各組產生氨氮的基礎上,盡量模擬養殖場的自然環境。
各組不同時段的氨氮去除率見附圖。
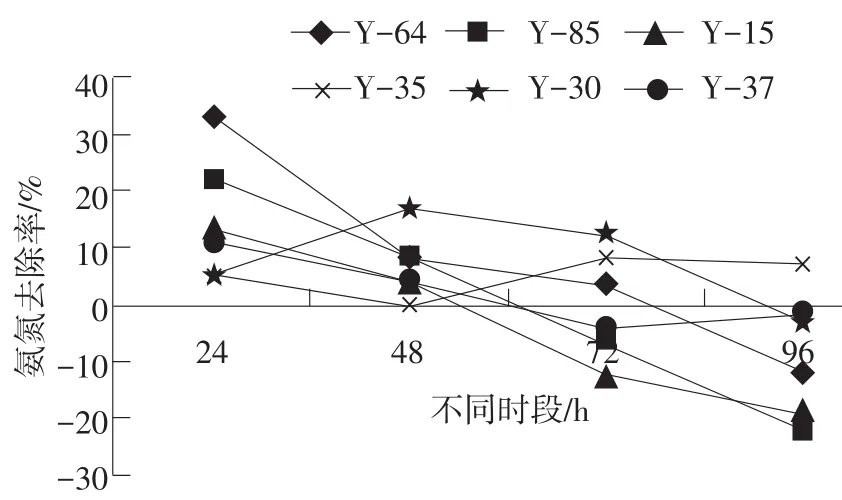
附圖 各組不同時段的氨氮去除率
從附圖中可以看出,隨著時間的延長,各組的氨氮去除率基本呈現逐漸降低的趨勢,24 h各組的氨氮去除率相對較高,其中Y-64組的氨氮去除率為33.33%,Y-85組為22.22%。
3 討論
早在20世紀四五十年代,歐洲等發達國家就進行了除臭方法的研究,除臭微生物的篩選工作也于那時開始起步,近幾年也有研究者分離到了效果更好的菌,KIM等分離到一株能將NH3濃度降低98.5%的乳酸桿菌[9]。我國對除臭微生物的研究起步較晚,昌艷萍等從新鮮雞糞中分離得到菌株J-3和J-6可將NH3濃度分別降低70.46%和35.05%[12]。陳麗園等分離到的菌株10MG可使NH3濃度降低67.95%[13]。馮健等利用自行分離的3株菌和引進的4株菌,進行了除臭效果試驗,發現混合菌對NH3的去除率在67.90%~83.55%[16]。本試驗篩選出的Y-64對糞便中的氨氮降解率在24 h后達到33.33%,表明Y-64具有較好的降低氨氮的作用,可以考慮將其作為益生菌來利用。本試驗中,盡管經復篩篩選出的6株芽孢菌均具有一定降低糞便中氨氮的能力,但同一菌株氨同化能力在復篩和對糞便中氨氮的降解效果試驗兩個階段統計所得的數據不一致,呈現出一定的差異,推測可能是由于抑氨富集培養基中與糞便環境中營養成分和菌群間的差異所導致。本試驗篩選出的芽孢菌具體生理性能及除臭機理有待進一步研究。
[1]Lacey R E,Mukhtar S,Carey JB,etal.A review of literature concerning odors,ammonia,and dust from broiler production facili-ties:1.Odor concentrations and emissions[J].JAppl Poult Res,2004,13(3):500-508.
[2]PowersW J,Angel CR,Applegate T J.Air emissions in poultry production:current challenges and future directions[J].J Appl PoultRes,2005,14(3):613-621.
[3]Siegford JM,PowersW,Grimes-casey H G.Environmental aspects of ethical animal production[J].Poult Sci,2008,87(2):380-386.
[4]Frazer L.Agriculture:Green screen for poultry farms[J].Environ Health Perspect,2008,116(11):477.
[5]Miles DM,Branton SL,Lott BD.Atmospheric ammonia isdetrimental to the performance ofmodern commercial broilers[J].Poult Sci,2004,83(10):1 650-1 654.
[6]Fairchild B D,Czarikck M,Harper L A,et al.Ammonia concentrations downstream of broiler operations[J].J Appl Poult Res,2009,18(3):630-639.
[7]Heederik D,Sigsgaard T,Thorne PS,etal.Health effects of airborne exposures from concentrated animal feeding operations[J].Environ Health Perspect,2007,115(2):298-302.
[8]Donham K J,Wing S,Osterberg D,et al.Community health and socioeconomic issuessurrounding concentrated animal feedingoperations[J].Environ Health Perspect,2007,115(2):317-320.
[9]Kim JD,Kang K H.Isolation of Lactobacillus sakei strain KJ-2008 and its removalof characteristicmalodorousgasesunder anaerobic culture conditions[J].Biosci Biotechnol Biochem,2004,68(12):2 427-2 435.
[10]趙晨曦,蘭時樂,禹逸君,等.雞糞除臭微生物菌群的篩選和應用[J].湖南農業科學,2005(1):68-70.
[11]陳書安,黃為一,趙兵.除臭微生物分離和篩選方法的改進與應用[J].生物技術通報,2006(5):126-129.
[12]昌艷萍,李彥芹,陳娟,等.雞糞除臭放線菌的篩選及組合拮抗試驗[J].湖北農業科學,2007,46(1):60-61.
[13]陳麗園,吳東,夏倫志,等.畜禽糞便除臭微生物的分離與篩選[J].畜牧與獸醫,2008,40(12):59-61.
[14]楊柳,張邑帆,鄭華,等.高效除臭微生物的原位篩選與鑒定[J].上海畜牧獸醫通訊,2012(2):14-16.
[15]陳國營,詹凱,陳麗園,等.蛋雞糞抑氨菌選育及其抑氨機制[J].中國微生態學雜志,2012,24(7):582-587.
[16]馮健,方新,于淼.生物除臭劑在畜禽糞便除臭中的應用試驗[J].現代農業科技,2009(20):286-288.

