3種擬青霉發酵三七及其產物檢測*
武陽陽,虞泓,葛鋒,陳自宏,曾文波
1(昆明理工大學生命科學與技術學院,云南 昆明,650500)2(云南大學中草藥生物資源研究所云百草實驗室,云南昆明,650091)
三七[Panax notoginseng(Burk)F.H.Chen]為五加科人參屬多年生草本植物,是我國傳統的藥用植物[1]。三 七 總 皂 苷 (panax notoginseng saponins,PNS)是三七的主要有效成分,在耐缺氧、抗衰老和提高機體免疫力等方面的藥理作用顯著,且總皂苷和部分單體皂苷在血液系統、心腦血管系統以及抗炎、抗腫瘤等方面均有較好活性[2]。研究表明,植物中天然的人參皂苷含量低,且分子結構不是最佳的活性狀態,通過生物轉化減少皂苷結構中的糖基數目,可將天然皂苷中含量較高的Rg1、Rb1、Rb2、Re轉化為稀有皂苷(如Rd、Rh1、C-K等),可提高其療效和生理活性[3-6]。稀有人參皂苷在治療心腦血管疾病、抗腫瘤方面表現出較好的藥理活性,如人參皂苷Rd可以促進T細胞的增殖,提高天然殺傷細胞的活性,對心腦血管、神經系統和免疫系統等作用獨特,可提高機體的免疫力,有可能成為治療腦卒中的新型臨床治療藥物,是一種很有前景的候選藥物[7-8]。但人參皂苷Rd在植物內的含量很低,且結構復雜,難以化學合成[9]。因此,獲得大量高純度的人參皂苷Rd具有重大的科研意義和應用價值。稀有皂苷可通過生物轉化法獲得,因其效率高、無污染,具有較好的應用前景。
目前,微生物發酵三七在國內外已經得到了極大的關注與發展。大型藥食兼用菌與西洋參進行共培養,可將人參皂苷Rb1等轉化為Rd和C-K,得到稀有皂苷[10]。李國紅等采用枯草芽抱桿菌對三七根進行發酵,從發酵產物中分離得到新的人參皂苷RH4[11]。采用莫勒接霉(Zygorhynchus moelleri)和灰綠犁頭霉(Absidia glauca)可將Rb1專一的轉化為Rd[12]。擬青霉 (Paecilomyces bainier sp.229)可將Rb1大量轉化為 Rd,進一步轉化為 C-K[13]。
冬蟲夏草是我國名貴的藥食用真菌,其主要活性成分有蟲草素、甘露醇、腺苷及微量元素等,具有免疫調節、抗腫瘤、抗炎癥、降血糖和延緩衰老等多方面的作用[14-16],但天然的冬蟲夏草目前已瀕臨滅絕。從冬蟲夏草中分離出的蝙蝠蛾擬青霉、蛹蟲草分離出的蛹草擬青霉和蟬花中分離出的蟬擬青霉,通過人工培養獲得的菌絲體在功效成分、藥理作用以及臨床療效方面與冬蟲夏草相似,為藥食兩用真菌[17]。目前,在蟲草菌種的培養條件優化及其菌絲體功效成分的檢測和藥理作用方面已有不少的研究,但有關與三七共培養的研究還鮮見報道。本研究采用蝙蝠蛾擬青霉、蛹草擬青霉和蟬擬青霉分別固體發酵三七,旨在探討蟲草真菌這一重要微生物是否能轉化三七中的皂苷成分,以期利用藥食兼用蟲草真菌發酵三七獲得稀有皂苷,并合成腺苷、蟲草素和甘露醇等蟲草的功效成分,實現一次發酵過程同時獲得蟲草和三七的藥用成分。
1 材料與方法
1.1 材料
1.1.1 實驗材料
菌株蝙蝠蛾擬青霉 PHEP-2、蛹草擬青霉PMILSM5和蟬擬青霉PCICYL1-3,均保存于云南大學生命科學學院云百草實驗室。
1.1.2 試劑
三七皂苷R1、人參皂苷Re和人參皂苷Rb1,購于中國藥品生物制品檢定所;人參皂苷Rh1、人參皂苷Rg1、人參皂苷 Rd、人參皂苷 F1、人參皂苷 F2、人參皂苷Rg3和人參皂苷C-K,購于南方標準物質網;乙腈、甲醇均為色譜純,其余試劑均為分析純。
1.1.3 儀器
高效液相色譜儀(戴安ULTIMATE 3000 LPG-3400A四元梯度泵,WPS-3000SL自動進樣器,PDA-3000二極管陣列檢測器,TCC-3000柱溫箱,美國戴安儀器公司);Waters Symmetry C18色譜柱(250 mm×4.6 μm,5 μm,100A,美國 Waters 公司);紫外可見分光光度計(T6系列,北京普析通用儀器有限責任公司);DHG-9203A型電熱恒溫鼓風干燥箱(上海精宏實驗設備有限公司)。
1.2 實驗方法
1.2.1 培養基
(1)斜面培養基:洋芋粉20 g/L,蔗糖20 g/L,瓊脂18 g/L,蛋白胨 10 g/L,自然 pH,121℃滅菌 30 min。
(2)種子培養基:葡萄糖20 g/L,蛋白胨10 g/L,酵母粉10 g/L,KH2PO41 g/L,MgSO40.5 g/L。自然pH,121℃滅菌30 min。
(3)發酵培養基:精確稱取5 g過60目篩的三七粉于100 mL三角瓶,加入0.1 mL無機鹽(10 g/L KH2PO4,5 g/L MgSO4),加入去離子水,使最終培養基中基質含水量為60%。自然 pH,121℃滅菌30 min。
1.2.2 培養方法
(1)將菌株蝙蝠蛾擬青霉、蛹草擬青霉和蟬擬青霉分別接入斜面培養基中,于26℃恒溫培養培養5 d。
(2)將已培養好的斜面菌種接入種子培養基中,于恒溫振蕩培養箱中26℃、150 r/min條件下培養5 d,備用。
(3)將發酵好的種子液以5%接種量接入發酵培養基中,于恒溫培養箱中26℃,至菌絲長滿培養基即成固體發酵物。以滅菌后的原藥材為空白對照。
1.2.3 發酵產物的檢測
1.2.3.1 發酵產物皂苷的HPLC測定
至菌絲長滿培養基將發酵產物烘干,粉碎。取0.1 g,3 mL 70%甲醇溶解,0.45 μm 微孔濾膜過濾,上柱檢測。
色譜流動相:乙腈-水梯度洗脫(0~30 min,20∶80;30~60 min,20~45:80~55;60~78 min,45~75:55 ~25;78 ~80 min,75 ~100∶25 ~0;80 min,20∶80);進樣量10 μL;流速1 mL/min;
檢測波長:203 nm;柱溫:30℃。
1.2.3.2 蟲草素和腺苷的HPLC測定
精確稱取蝙蝠蛾擬青霉、蛹草擬青霉蟬擬青霉的發酵產物0.1 g,于3 mL 20%甲醇溶解,超聲90 min,0.45 μm微孔濾膜濾過,進行HPLC檢測。
色譜流動相:甲醇∶水梯度洗脫=15∶85;進樣量10 μL;流速1 mL/min;檢測波長260 nm;柱溫:30℃。
1.2.3.3 甘露醇的測定
按比色法[17]測發酵產物的甘露醇含量。
2 結果與分析
2.1 發酵產物的收率
3種擬青霉在發酵培養基中生長狀況良好,發酵周期20 d。將其發酵產物烘干至恒重,粉碎,計算發酵產物的收率(產物收率 =產物質量 /5 g×100%),見表1。
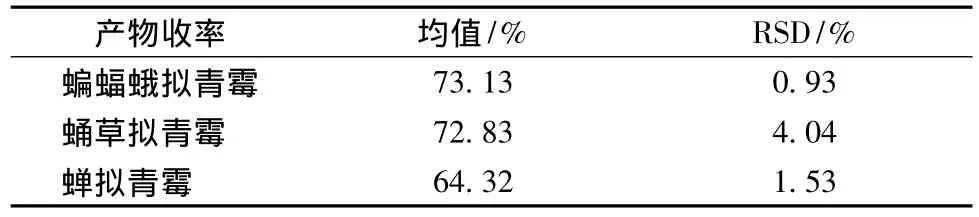
表1 發酵產物的收率(n=3)Table 1 The residue of fermentation productions
蝙蝠蛾擬青霉、蛹草擬青霉和蟬擬青霉均能很好的利用三七中提供的營養物質作為其生長所需,發酵周期為20 d,其發酵產物收率都在70%左右。
2.2 發酵產物皂苷的HPLC分析
經HPLC檢測發酵產物有效成分,表明蝙蝠蛾擬青霉和蛹草擬青霉能夠高產人參皂苷Rd,而蟬擬青霉則無明顯變化,其固體發酵三七的皂苷HPLC色譜圖見圖1。
皂苷產量對發酵底物的得率計算為:皂苷得率=每克產物中皂苷含量 ×產物收率。菌株蝙蝠蛾擬青霉、蛹草擬青霉和蟬擬青霉固體發酵三七的皂苷HPLC檢測結果如表2。經過蝙蝠蛾擬青霉和蛹草擬青霉的發酵,Rd由原藥材的6.17 mg/g,分別增加至25.08 mg/g和25.07 mg/g,增加了3.06倍;同時,小極性皂苷Rh1、F1、F2、Rg3和C-K也有所增加;而三七中主要的皂苷成分R1、Re和Rg1則出現不同程度的下降,Rb1由原藥材的24.04 mg/g分別降至1.25 mg/g和4.24 mg/g。而經過蟬擬青霉的發酵,三七中主要的皂苷成分R1、Re、Rg1和Rb1都有不同程度的下降,同時小極性皂苷 Rh1、F1、Rd、F2、Rg3 和 C-K則有小幅度的增加,但無顯著變化。
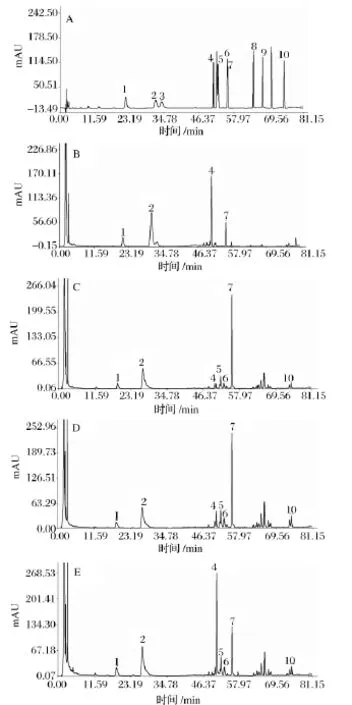
圖1 標準品(A),原藥材(B),蝙蝠蛾擬青霉轉化三七皂苷(C),蛹草擬青霉轉化三七皂苷(D),蟬擬青霉轉化三七皂苷(E)的HPLC色譜圖1-三七皂苷R1;2-人參皂苷Rg1;3-人參皂苷Re;4-人參皂苷Rb1;5-人參皂苷Rh1;6-人參皂苷F1;7-人參皂苷Rd;8-人參皂苷F2;9-人參皂苷Rg3;10-人參皂苷C-KFig.1 HPLC chromatograms of standard compounds(A),raw Panax notoginseng(B),ginsenoside of raw Panax notoginseng biotransformation with Paecilomyces hepiali Chen&Dai(C),ginsenoside of raw Panax notoginseng biotransformation with Paecilomyces militaris Liang(D),and ginsenoside of raw Panax notoginseng biotransformation with Paecilomyces cicadae Samson(E)
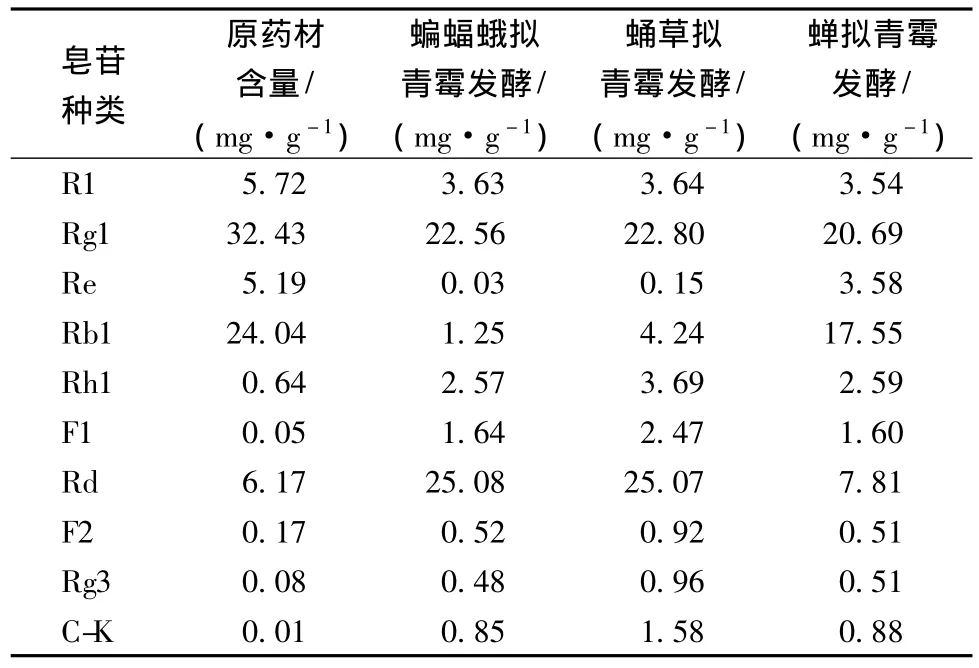
表2 3株擬青霉發酵三七的皂苷含量變化Table 2 The contents of Panax notoginseng saponins fermented by the three Paecilomyces fungi
由人參皂苷轉化途徑[19]可知,在發酵過程中蝙蝠蛾擬青霉和蛹草擬青霉或其生長過程中分泌的豐富酶系可能會水解人參皂苷Rb1的糖基從而轉化為Rd。而蟬擬青霉可能沒有相應的酶系,無法進行人參皂苷的轉化。所選的蝙蝠蛾擬青霉和蛹草擬青霉能夠有效地使三七中主要的大極性皂苷轉化為小極性皂苷,且高產人參皂苷Rd。
2.3 發酵產物腺苷和蟲草素的HPLC分析
蝙蝠蛾擬青霉、蛹草擬青霉和蟬擬青霉發酵產物的腺苷和蟲草素HPLC色譜圖見圖2。
菌株蝙蝠蛾擬青霉、蛹草擬青霉和蟬擬青霉固體發酵三七的腺苷和蟲草素HPLC檢測結果如表3。經過蝙蝠蛾擬青霉的發酵,腺苷含量從原藥材中的21.06 μg/g 增加到發酵產物中的 385.67 μg/g,不含蟲草素;經蛹草擬青霉發酵,產物中腺苷達到167.43 μg/g,蟲草素達到868.53 μg/g;而經蟬擬青霉的發酵,產物的腺苷達到222.07 μg/g,不含蟲草素。
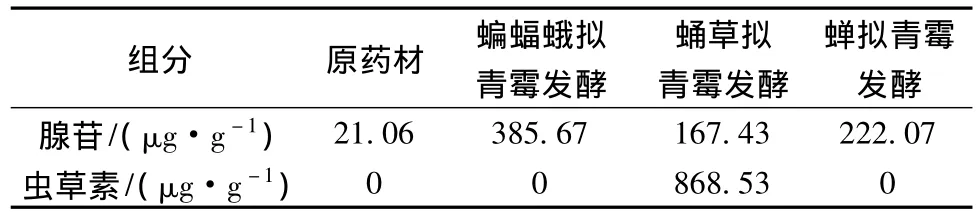
表3 3株擬青霉發酵三七的腺苷和蟲草素含量變化Table 3 The contents of Panax notoginseng adenosine and cordycepin fermented by the three Paecilomyces fungi
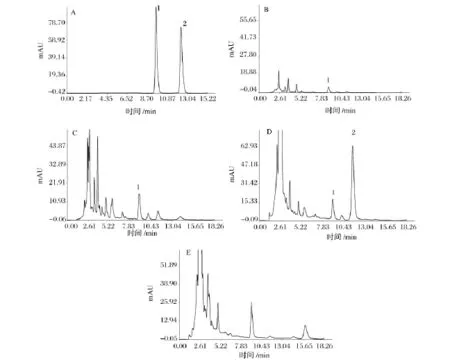
圖2 標準品(A),原藥材(B),蝙蝠蛾擬青霉發酵三七中腺苷和蟲草素(C),蛹草擬青霉發酵三七中腺苷和蟲草素(D),蟬擬青霉發酵三七中腺苷和蟲草素(E)的HPLC色譜圖Fig.2 HPLC chromatograms of standard compounds(A),raw Panax notoginseng(B),adenosine and cordycepin of raw Panax notoginseng fermentation with Paecilomyces hepiali Chen& Dai(C),adenosine and cordycepin of raw Panax notoginseng fermentation with Paecilomyces militaris Liang(D),and adenosine and cordycepin of raw Panax notoginseng fermentation with Paecilomyces cicadae Samson(E)
腺苷是蟲草的主要活性成分,在改善心腦血液循環和防止心律失常等方面有明顯的藥理作用。蝙蝠蛾擬青霉、蛹草擬青霉和蟬擬青霉發酵產物的腺苷含量為 385.76 μg/g、167.43 μg/g 和 222.07 μg/g,介于夏文娟報道的不同產地冬蟲夏草的腺苷含量(142.5 ~396.6 μg/g)之間[20],與野生冬蟲夏草中腺苷含量相當。蟲草素具有抗菌、抗病毒、抗腫瘤,以及抗疲勞、抗衰老,提高人體免疫力等多種功效顯著的生物學活性,但在天然的蟲草中一般含量都不高。蛹草擬青霉發酵產物的蟲草素含量為868.53 μg/g,明顯高于索菲婭等報道的4個不同產地的冬蟲夏草(4.2 ~38.9 μg/g)[21]。由此可知,蝙蝠蛾擬青霉、蛹草擬青霉和蟬擬青霉能夠利用三七中的營養物質發酵,從而有效地提高了腺苷和蟲草素這兩種蟲草功效成分。
2.4 發酵產物甘露醇的含量測定
菌株蝙蝠蛾擬青霉、蛹草擬青霉和蟬擬青霉固體發酵三七的甘露醇檢測結果如表4。
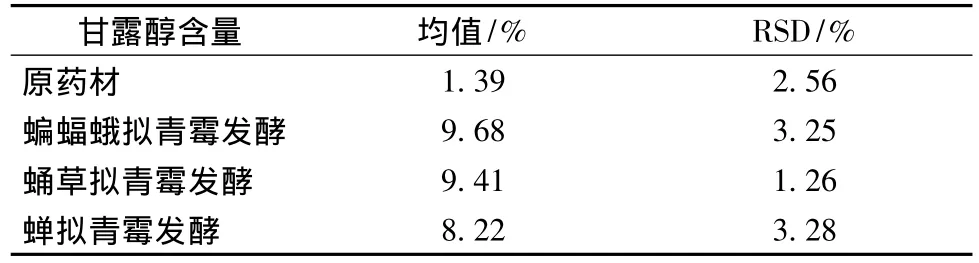
表4 3株擬青霉發酵三七的甘露醇含量變化(n=3)Table 4 The contents of Panax notoginseng mannito fermented by the three Paecilomyces fungi
經擬青霉的發酵,甘露醇含量從原藥材的1.39%增加到了其產物中的9.68%、9.41%和8.22%,介于索菲婭等報道的4個不同產地冬蟲夏草的甘露醇含量(7.85% ~12.03%)之間[22],同時也高于新藥轉正標準WS3-181(Z-60)-94(Z)發酵蟲草菌粉的甘露醇要求。說明所選的蝙蝠蛾擬青霉、蛹草擬青霉和蟬擬青霉都能發酵三七從而產生甘露醇,且與野生的冬蟲夏草中的甘露醇含量相當。
3 討論
微生物發酵中藥,是現代生物技術和中藥研究的完美結合。微生物與中藥共同發酵,可使微生物中豐富的酶系與中藥中復雜的化學成分反應,產生中藥不具有的成分或改變某些成分含量,或可使培養物兼有微生物和中藥的功效成分[11],協同作用增強藥效,使人體可以吸收較完全,提高了治療和保健功效,從而可能為新藥開發提供一種新的途徑,是頗具發展潛力的研究領域。
本研究采用蝙蝠蛾擬青霉、蛹草擬青霉和蟬擬青霉在三七培養基上進行固體發酵,這3種擬青霉都能很好地利用三七中的營養物質進行生長,發酵周期為20 d,其發酵產物收率都在70%左右。通過對發酵產物的皂苷進行HPLC檢測,蝙蝠蛾擬青霉和蛹草擬青霉的發酵產物中,Rb1由原藥材的24.04 mg/g分別降至1.25 mg/g和4.24 mg/g,Rd由原藥材的6.17 mg/g分別增加至25.08 mg/g和25.07 mg/g,增加了3倍。而Rb1和Rd具有相同的糖苷配基,其結構差異僅在C20位上的糖基。Rb1可在葡萄糖苷酶的作用下,斷裂C20位上的末端糖苷鍵,脫去1分子葡萄糖,形成人參皂苷Rd[23],如圖3。由于Rd在西洋參中含0.1% ~0.2%,人參中含0.2% ~0.3%,三七中含0.5% ~0.7%[24],在植物原藥材中含量較低,但 Rd可能成為治療腦中風的新型藥物,具有獨特的藥理作用,因此篩選出可以高產人參皂苷Rd的菌種,優化合適的工業生產條件,對于大規模工業生產稀有人參皂苷以及臨床的應用具有重要意義。目前,已經從蝙蝠蛾擬青霉和蛹草擬青霉中克隆出β-葡萄糖苷酶基因,正在進行該酶的酵母真核表達系統的構建。
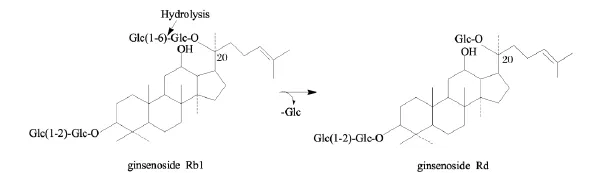
圖3 人參皂苷Rb1到Rd的轉化途徑Fig.3 The transformation pathway of ginsenoside Rb1 into ginsenoside Rd
與此同時,三七中的糖類、氨基酸、脂質、蛋白質和微量元素等也為蝙蝠蛾擬青霉、蛹草擬青霉和蟬擬青霉的菌絲體生長提供了C源、N源和生長因子等營養物質,合成了腺苷、蟲草素和甘露醇這3種蟲草的功效成分。其發酵產物的腺苷含量和甘露醇含量與天然冬蟲夏草中相當,而蛹草擬青霉發酵產物中的蟲草素含量為868.53 μg/g,要遠高于天然冬蟲夏草中的蟲草素含量(4.2 ~38.9 μg/g)。
本研究使用3種擬青霉對三七原藥材進行固體發酵,其中蝙蝠蛾擬青霉和蛹草擬青霉在轉化三七中皂苷的同時合成腺苷、蟲草素和甘露醇這三種蟲草功效成分,一次發酵過程同時獲得蟲草和三七有效成分。采用藥用真菌以三七原藥材為底物進行發酵,三七與真菌構成完整的發酵體系,三七為蟲草菌絲體的生長提供營養物質,使其合成蟲草的相關功效成分,而蟲草真菌所產生的糖苷酶又可對皂苷進行結構修飾,水解其側鏈上的糖基,把原藥材中含量高的皂苷轉化為含量低、活性高的稀有皂苷,改善了藥材中活性化合物的生物利用度,發酵產物兼具三七和藥用真菌的雙重功效,為新藥開發提供新的思路。
[1] 馮陸冰,潘西芬,孫澤玲.三七的藥理作用研究進展[J].中國藥師,2008,11(10):584-589.
[2] 張玉軍.三七中皂苷的藥理研究進展[J].廣西醫學,2009,4(31):589-591.
[3] 趙方允,陳自宏,虞泓,等.微生物轉化人參皂苷的研究[J].中國醫藥生物技術,2010,5(3):216-219.
[4] Sung-Ryong K O,Kang-Ju Chol,Kei Suzukl,et al.Enzymatic preparation of Ginsenosides Rg2,Rh1,and F1[J].Chemical and Pharmaceutical Bulletin,2003,51(4):404-408.
[5] W Zhou,Q Yan,J Y Li,et al.Biotransformation of Panax notoginseng saponins into ginsenoside compound K production by Paecilomyces bainier sp.229[J].Journal of Applied Microbiology,2008,104(3):699-706.
[6] 周超群,周珮.人參皂苷Rd的研究進展[J].中草藥,2009,5(40):832-836.
[7] Berek L,Szabo D,Pitri I B,et al.Effects of naturally occurring glucosides,solasodine glucosides,ginsenosides and parishin derivatives on multidrug resistance of lymphoma cells and leuloeyte functions[J].In Vivo,2001,15(2):151-156.
[8] 李泰平.人參皂苷藥理活性的研究進展[J].生物學教學,2003,28(4):34 -37.
[9] 周超群,史訓龍,李繼揚,等.人參皂苷Rd高產突變株Paecilomyces bainier sp229-7的生長特性和生物轉化[J].復旦學報:醫學版,2010,37(1):59-62.
[10] 付建國.人參皂苷微生物轉化的研究[D].長春:吉林農業大學,2004.
[11] 李國紅,沈月毛,王啟方,等.發酵三七中的皂苷成分研究[J].中草藥,2005,36(4):499-500.
[12] 張薇,孫曉東,張萍,等.專一轉化人參二醇類皂苷Rb1為Rd的真菌菌株的篩選[J].菌物學報,2011,30(2):305-311.
[13] Yan Q,Zhou W,Shi X L,et al.Biotransformation pathways of ginsenoside Rb1 to compound K by β-glucosidases in fungus Paecilomyces Bainier sp.229[J].Process Biochemistry,2010,45(9):1 550-1 556.
[14] 傅嵐,陳作紅.蟲草屬真菌化學成分及藥理作用研究進展.[J].生命科學研究,2004,8(1):1-7.
[15] 李紹平,季暉,李萍,等.冬蟲夏草抗腫瘤作用研究進展[J].中草藥,2001,32(4):373-375.
[16] Da-Qing Jin,Byung-Chul Park,Jae-Seong Lee,et a1.Mycelial extract of Cordyceps ophioglossoides Prevents neuronal cell death and amelioretes β-Amyloid peptide-induced memory deficits in rats[J].Biological and Pharmaceutical Bulletin,2004,27(7):126-129.
[17] 計紅冰,鄒崢嶸.蟲草研究進展[J].農產食品科技,2008,2(2):45-52.
[18] 蔡友華,范文霞,劉學銘,等.比色法測定巴西蟲草菌絲體中蟲草酸的含量[J].現代食品科技,2008,24(1):76-79.
[19] 崔玉娜,張怡軒,趙余慶.利用生物轉化法制備稀有人參皂苷的研究進展[J].中草藥,2009,40(5):676-680.
[20] 夏文娟,曾曉英,袁海龍,等.不同產地冬蟲夏草腺苷含量的測定[J].中國中藥雜志,2001,26(8):540-542.
[21] 索菲婭,蘇俊,姜彥成,等.新疆蟲草與冬蟲夏草中腺苷和蟲草素的HPLC法測定比較[J].中國民族醫藥雜志,2008,3(3):65-67.
[22] 索菲婭,蘇俊,姜彥成,等.新疆蟲草與冬蟲夏草中甘露醇、多糖和氨基酸的含量比較研究[J].新疆農業科學,2008,45(3):517-52.
[23] 弓曉杰.人參皂苷酶代謝產物化學修飾及其抗癌活性研究[D].長春:吉林農業大學,2004.
[24] Shi S,Lian-Wen Q,Guang-Jian D,et al.Red notoginseng:Higher ginsenoside content and stronger anticancer potential than Asian and American ginseng[J].Food Chemistry,2011,125(4):1 299-1 305.

