接觸氧化-水生蔬菜濕地聯合處理太湖藍藻沼液
余亞琴 ,呂錫武,吳義鋒,徐微,趙晉偉
(1.東南大學 能源與環境學院,江蘇 南京,210096;2. 鹽城工學院 土木學院,江蘇 鹽城,224051;3. 安徽農業大學 資源與環境學院,安徽 合肥,230036)
湖泊富營養化和藍藻水華發生是目前全世界共同面臨的重大環境問題之一。就太湖而言,全湖的平均氮磷含量近期一直居高不下, 藍藻水華發生已經成為常態,其污染問題難以在短期內得到根本解決。 這是因為即使在外源輸入減少后,在相當長一段時間內,長期積累在湖泊底泥中的內源營養鹽仍然足以支撐水華藍藻的生長,很難杜絕藍藻水華的發生[1]。及時打撈與收集藍藻是迅速減少水體藍藻濃度的常用手段,同時能將湖中氮磷去除。打撈的藍藻需要及時有效的處理,否則會造成環境的二次污染[2]。太湖藍藻含有大量的高濃度有機物,利用厭氧發酵技術雖能使其得到有效的降解,同時獲得生物質能,但出水難以達到直接排放要求[3-4]。如果大量未經后續處理的沼液排向周圍水體,必然對太湖水環境造成巨大污染,同時造成沼液中大量有機質、及氮磷等營養元素的浪費。本文作者針對太湖藍藻厭氧發酵沼液高有機物高氮磷的特點,采用接觸氧化-水生蔬菜濕地聯合處理太湖藍藻厭氧發酵沼液,研究該組合工藝對污染物的去除特性及處理效果,并對污染物的去除機理進行分析,為太湖藍藻無害化處理與資源化利用提供技術支撐。
1 實驗
1.1 實驗水質
實驗廢水取自于江蘇省宜興市周鐵鎮東南大學太湖藍藻研究基地太湖富藻水厭氧發酵反應器的沼液。其主要水質指標見表 1。太湖藍藻沼液中ρ(BOD5)/ρ(COD)為 0.33~0.47,說明太湖藍藻沼液具有較好的可生化性,同時沼液中蛋白質大量存在,纖維素的含量較大,為沼液后續處理提供難題。
1.2 實驗裝置與方法
實驗裝置如圖1所示。太湖藍藻厭氧發酵沼液經過沉淀后通過蠕動泵進入接觸氧化池,出水經過沉淀池沉淀后進入水生蔬菜濕地,最終通過出水渠排入附近池塘。2011年6月上旬進行系統啟動。接觸污泥取自宜興市清源污水處理廠活性污泥,水生蔬菜濕地移栽宜興當地的空心菜。
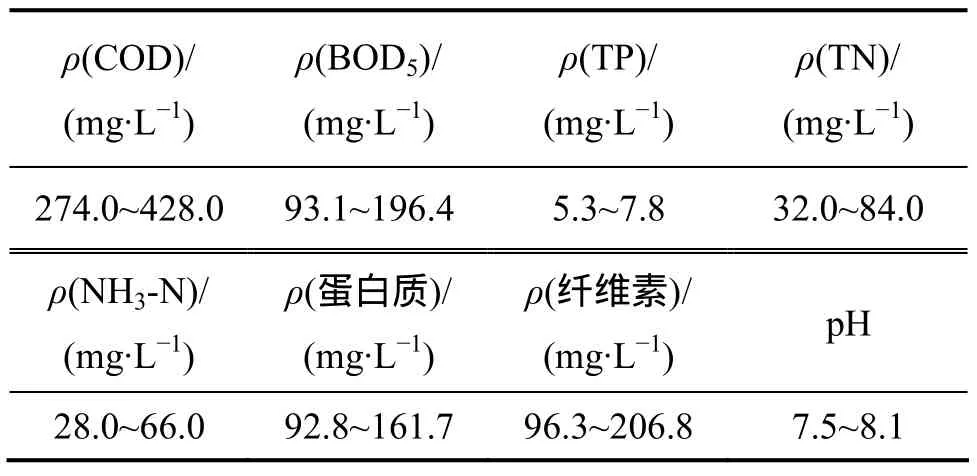
表1 太湖藍藻厭氧發酵沼液水質Table 1 Composition of anaerobically digested effluent of algae from taihu lake
生物接觸氧化池采用PVC板材制成,池體尺寸(長×寬×深)為0.4 m×0.3 m×0.65 m,有效容積為60 L,采用蠕動泵進水。生物接觸氧化池內裝組合填料,填料填充體積分數約為15%。接觸氧化池使用電磁式空氣泵曝氣充氧,設轉子流量計控制曝氣量使DO(質量濃度)處于3~4 mg/L,水力停留時間控制為8 h左右。正常運行兩套生物接觸氧化池出水經過沉淀池沉淀后進入水生蔬菜濕地。
水生蔬菜濕地采用水生植物床,用磚石混凝土建造,內部不填充任何基質。首端為進水配水渠,末端為出水集水渠,中部是植物栽培區。栽培區有1條水槽,為矩形淺池,長、寬、深分別為10,1和0.3 m,池底坡度為1%,水力負荷0.05 m3/(m-2·d) 左右,水深可通過活動堰板調節。
1.3 分析方法
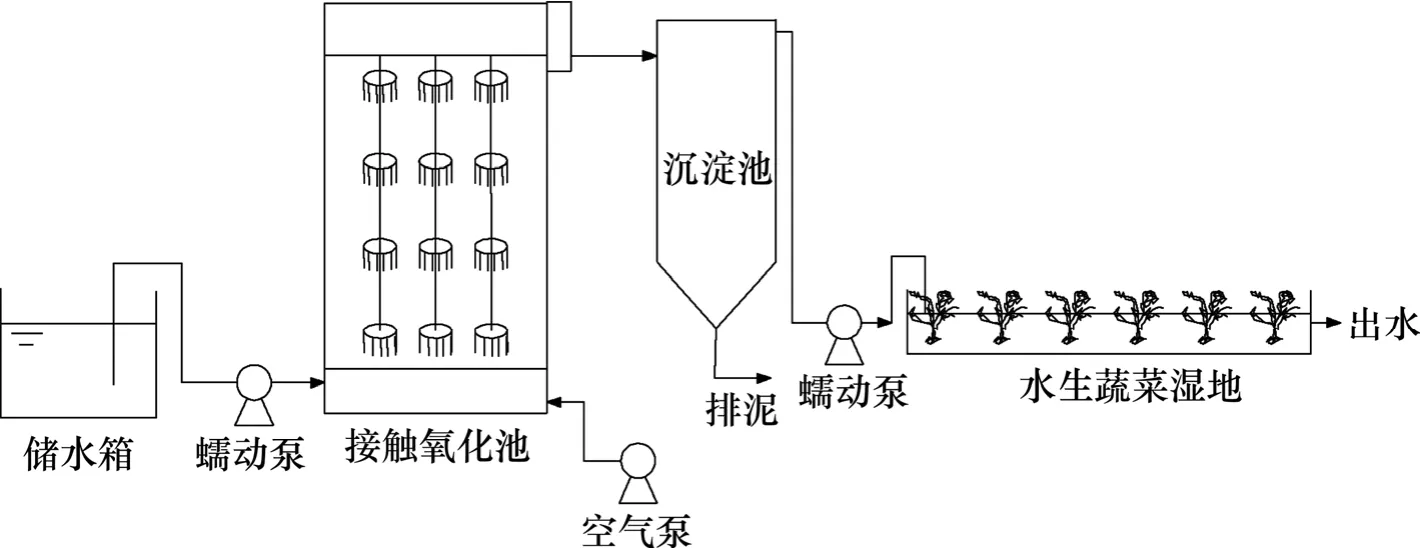
圖1 實驗流程圖Fig. 1 Flow chart of treatment process
水質分析方法采用《水和廢水監測分析方法》[5],其中,COD:重鉻酸鉀法;BOD5:稀釋接種法;pH:玻璃電極法;采用物料平衡方法計算水生蔬菜濕地不同途徑對磷的去除效果[6];藻毒素采用高效液相色譜(HPLC)法測定總微囊藻毒素(TMC-LR)、胞外微囊藻毒素(EMC-LR)[7];難降解有機物采用 GC-MS分析法[8]。
2 結果與分析
中試自2011-06上旬啟動,經過半月接觸氧化池活性污泥馴化和水生蔬菜濕地空心菜的生長。從2011-06下旬開始進行為期45 d夏季的中試實驗,進行過程中系統運行穩定,其中,于 2011-07-20對空心菜收割一次。
2.1 接觸氧化-水生蔬菜濕地組合工藝去除有機物的效能
2.1.1 接觸氧化-水生蔬菜濕地組合工藝對沼液COD去除效果
接觸氧化-水生蔬菜濕地對沼液中COD去除效果如圖2所示。可見:沼液中ρ(COD)為174~428 mg/L,經過接觸氧化池出水一般在110 mg/L以下,通過水生蔬菜濕地太湖富藻水沼液出水一般保持在50 mg/L以下,COD 去除率在80%以上,出水COD達到《城鎮污水處理廠污染物排放標準》(GB 18918—2002)一級排放標準。
2.1.2 接觸氧化-水生蔬菜濕地組合工藝對沼液難降解有機物去除效果
太湖富藻水沼液含有大量難降解微量有機物,通過 GC-MS定性分析沼液、接觸氧化池出水難降解微量有機物組分,分析接觸氧化池對其去除效果。結果如表2和3所示。
分析結果表明:從太湖富藻水厭氧發酵沼液中檢測出相似度50%以上的主要有機污染物有 42種。其中有芳烴類、烴烯烴類、酸、醇、酚,酮、醛、酞胺類。其中已被確認為致癌物1種,促癌物、輔致癌物4種,致突變物1種[9-10],被列入我國環境優先污染物“黑名單”的有8種,屬于美國環保局公布的優先污染物中的有機物有4種[11]。酰胺、吡啶、硝基苯等化合物在水樣中均有發現。這說明太湖富藻水經過厭氧發酵后沼液所含有機物的復雜性。一方面太湖水體受污染,另一方面水體中的植物、微生物等生物體也會釋放有機物[12]。
沼液經過接觸氧化池后,出水所含有機物種類明顯下降。相似度 50%以上的主要有機污染物只有 16種。出水中有15種有機物在進水中未檢出,這些有可能是某種大分子物質的中間產物或者是微生物合成代謝產物,有待進一步研究。接觸氧化池添加組合填料,易于微生物掛膜,由于生物膜自身的結構特點以及氧擴散的限制,生物膜由外向內,可以形成好氧區-缺氧區-厭氧區[13]。接觸氧化池富集大量的微生物群落,微生物群落中不同基因擁有者之間能發生基因交換與基因重組,導致新的降解途徑的進化,從而對難降解有機物產生協調降解的能力[14],消除單一菌種不具備完整的降解難降解有機物的酶系或基因成分的弊端。接觸氧化池中菌膠團能夠產生生物絮凝作用吸附沼液中的有機污染物,從而加快污染物的去除。反應器中輪蟲、纖毛蟲等原生動物吞食水中游離細菌和微小的污泥質點,降低沼液的濁度,并直接代謝水中一些溶解的有機化合物。
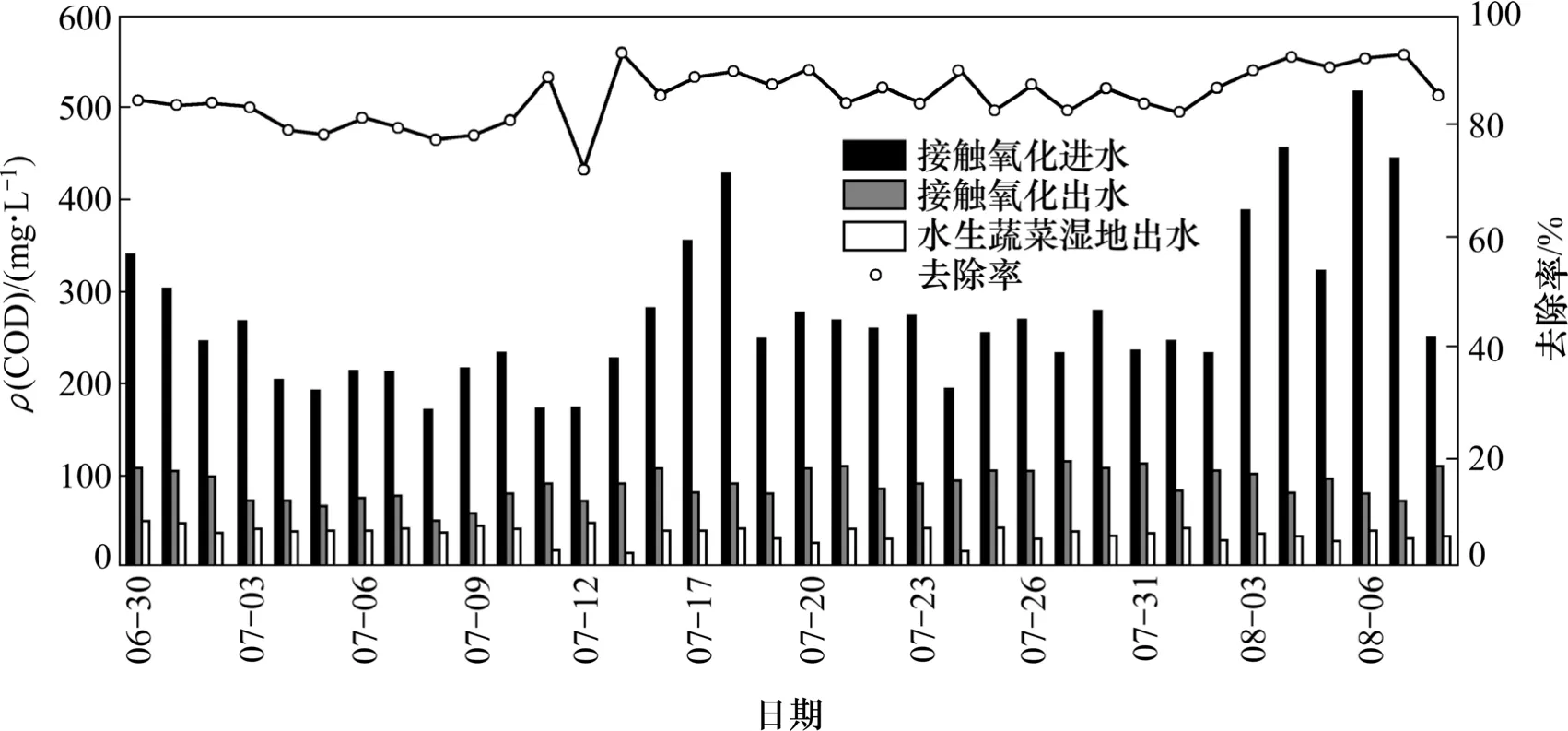
圖2 接觸氧化-水生蔬菜濕地對沼液中COD去除效果Fig. 2 Effect of contact oxidation and aquatic vegetable wetland process on COD removal rate in effluent
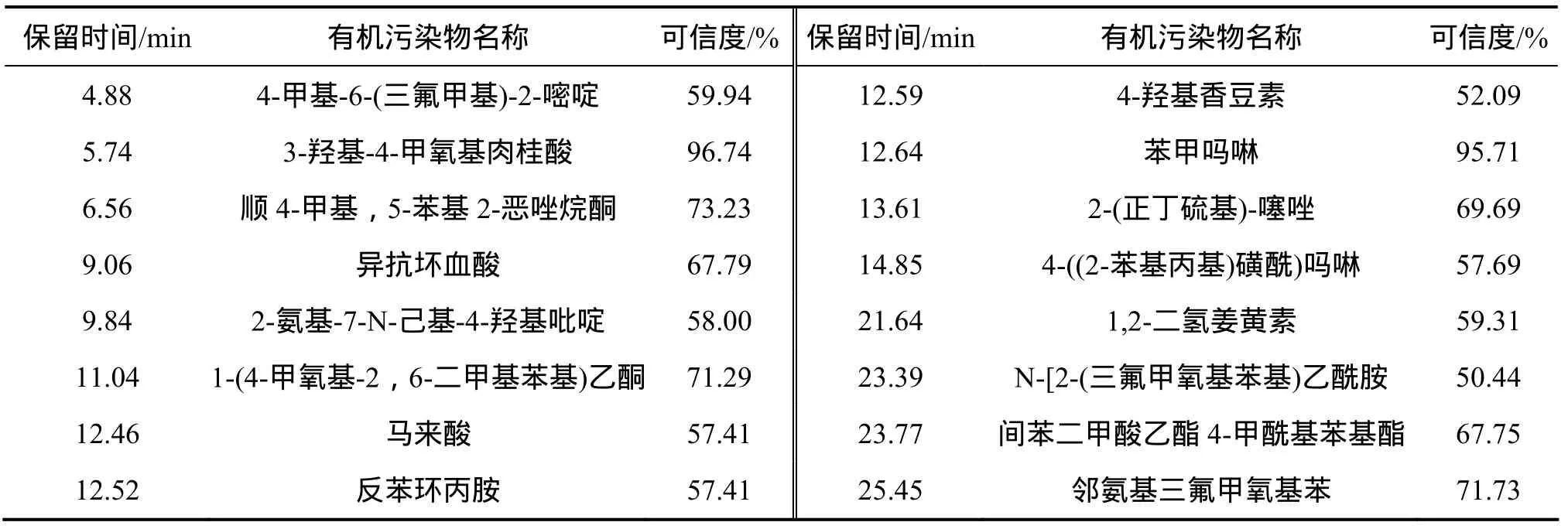
表3 接觸氧化池出水有機物Table 3 Organic pollutants in effluent of contact oxidation tank
2.2 接觸氧化-水生蔬菜濕地組合工藝去除沼液氮的效能
本研究采用的接觸氧化-水生蔬菜濕地組合工藝對太湖富藻水厭氧發酵沼液TN和NH3-N去除效果見圖 3和 4。系統中沼液 TN 質量濃度一般為 32~84 mg/L,接觸氧化池出水TN質量濃度為27~66 mg/L,水生蔬菜濕地出水降低至0.1~5.9 mg/L。水生蔬菜濕地的脫氮效果要大于接觸氧化池。系統對TN的去除率在90%以上。從圖4可以看出:接觸氧化池對NH3-N去除效果較強,經過接觸氧化池,沼液中的NH3-N質量濃度一般降至30~40 mg/L,通過水生蔬菜濕地出水NH3-N平均質量濃度在1.5 mg/L以下。系統對沼液中NH3-N去除率平均達到98%以上。
在接觸氧化池內部設有組合填料,為微生物提供富集的場所。沼液通過反應器底部進水管進入,空氣通過曝氣頭在底部進入反應器,因此反應器在整體上形成基質和溶解氧的梯度分布。太湖富藻水經過厭氧消化后沼液中氮元素主要以氨氮的形式存在,在接觸氧化池中氨氮主要轉化為硝態氮和亞硝態氮,說明脫氮主要是好氧環境下的硝化反應完成。
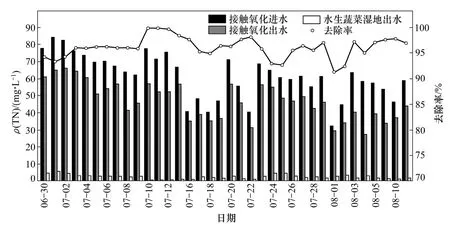
圖3 接觸氧化-水生蔬菜濕地對沼液中TN去除效果Fig. 3 Effect of contact oxidation and aquatic vegetable wetland process on TN removal rate in effluent
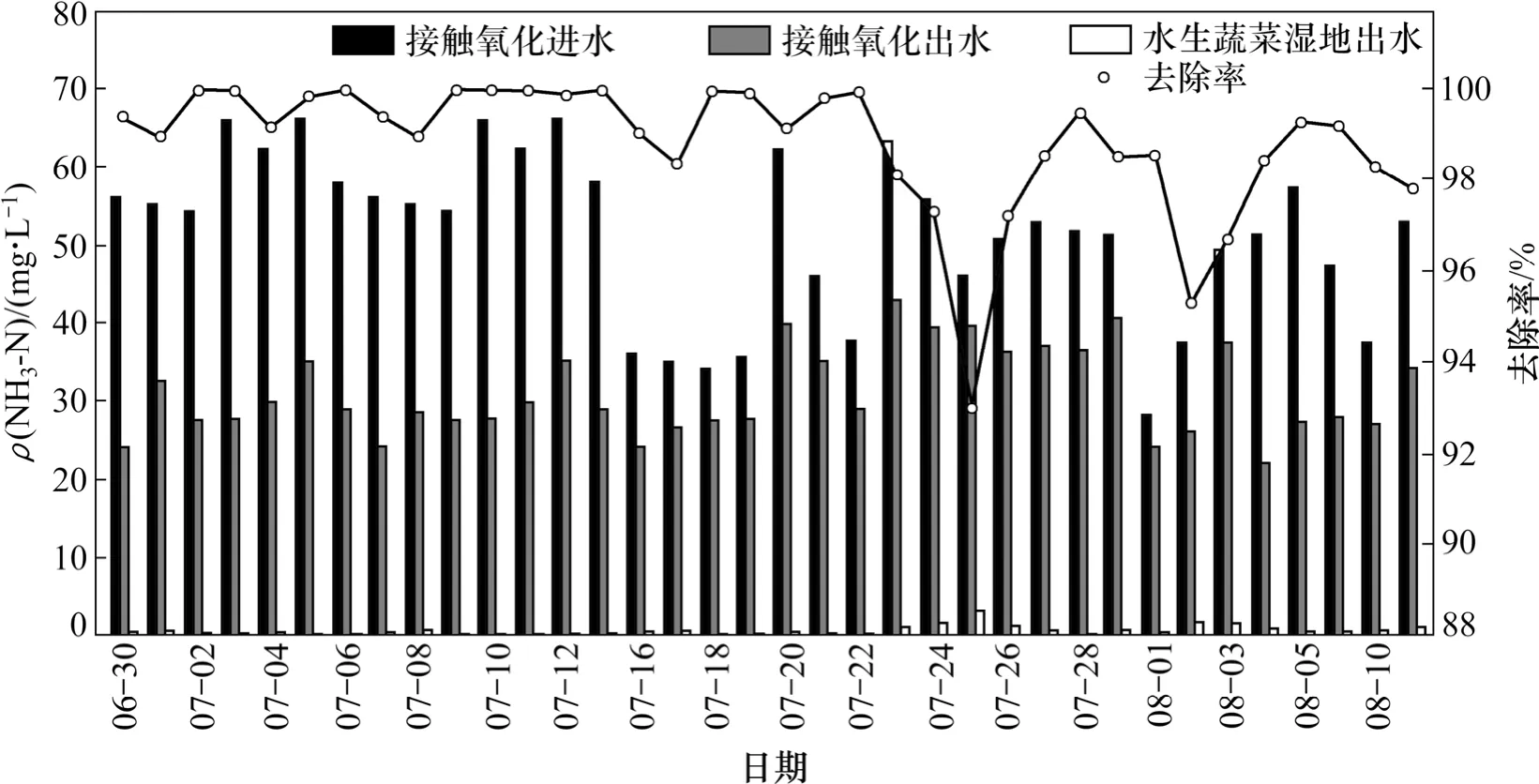
圖4 接觸氧化-水生蔬菜濕地對沼液中NH3-N去除效果Fig. 4 Effect of contact oxidation and aquatic vegetable wetland process on NH3-N removal rate in fffluent
水生蔬菜濕地是由植物-微生物形成的復合生態系統,通過植物根系的過濾攔截、植物吸收和微生物分解等協同作用實現對沼液中氮元素的去除。植物生長季節,綠色植物吸收和微生物反硝化是其脫氮的主要途徑。沼液中部分無機氮可以被空心菜生長所吸收,并隨著空心菜的收割而去除;在 2011-07-30采用電鏡觀察空心菜的根系,發現空心菜龐大發達的根系為微生物的棲息提供巨大的物理表面,同時植物根系表面也是一些有機物沉淀的場所,圖5所示為掃描電鏡觀察空心菜根系。Hansen等[15]進行的實驗表明:水生植物系統的內部擁有大量硝化細菌,其氧化還原電位及硝化的速率均高于未生長水生植物的湖泊沉淀區。水生植物自生的通氣系統有利于 O2在體內傳輸并送至根部,這不僅滿足水生植物在水下無氧環境中的呼吸作用,而且在植物根系周圍形成連續的好氧、缺氧、缺氧微環境,創造出許多串聯或并聯的“A/A/O”微處理單元,為異氧菌、自養菌和反硝化細菌等微生物分別占據的優勢生態位提供條件,通過硝化和反硝化大大提高氮的去除效果。
2.3 接觸氧化-水生蔬菜濕地組合工藝去除沼液總磷的效能
圖6所示為接觸氧化-水生蔬菜濕地對沼液中TP去除效果。從圖6可以看出:系統對太湖富藻水沼液TP去除率在90%以上。沼液經過接觸氧化池后,通過沉淀池排放剩余污泥,對TP的去除率在20%左右;最終經過水生蔬菜濕地后沼液 TP質量濃度在 0.5 mg/L以下,完全達到《城鎮污水處理廠污染物排放標準》(GB 18918—2002)一級A排放標準。
接觸氧化池對磷的去除主要通過聚磷菌好氧聚磷,在沉淀池以排除剩余污泥的形式而排出。人工濕地對磷的去除是通過植物的吸收及攔截、微生物作用及濕地床的物理化學作用等方式共同作用完成的。太湖富藻水厭氧發酵沼液中無機磷在植物吸收及同化作用下可變成植物的ATP(三磷酸腺苷)、DNA(脫氧核糖核酸)及RNA(核糖核酸)等有機成分,通過空心菜被收割而去除磷。經過實驗分析,空心菜吸收磷占磷總量20%左右。微生物除磷主要是通過聚磷菌的過量攝磷而實現,由于水生蔬菜濕地中存在氧的梯度分布,致使系統中交替出現好氧和厭氧狀態,獲得有利于聚磷菌的生境。水生蔬菜濕地中空心菜發達的根系交織成毯狀的墊層為其攔截顆粒態的磷提供便利。實驗結束后,通過截留沉積作用形成底泥而去除的磷占磷總量的73%左右。同時水生蔬菜濕地植物床采用磚石混凝土建造,其中的鈣離子與磷發生反應對磷的去除也起到一部分作用[16]。
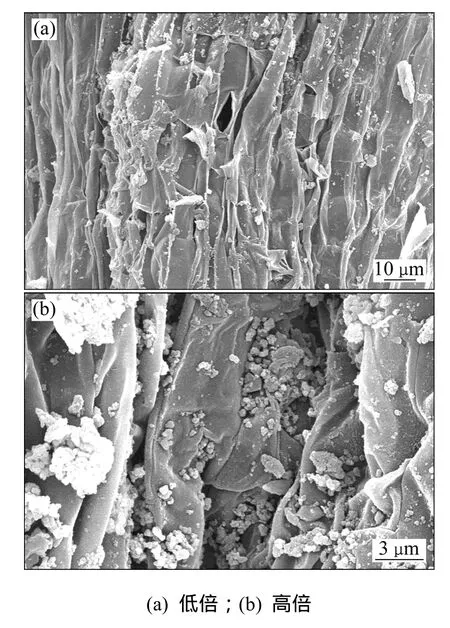
圖5 掃描電鏡觀察空心菜根系Fig. 5 SEM images of ipomoea aquatica roots
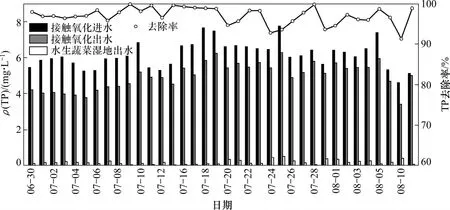
圖6 接觸氧化-水生蔬菜濕地對沼液中TP去除效果Fig. 6 Effect of contact oxidation and aquatic vegetable wetland process on TP removal rate in effluent
2.4 接觸氧化-水生蔬菜濕地組合工藝去除沼液中藻毒素的效能
太湖富藻水經過厭氧發酵,沼液中藻毒素含量會降低,但沼液中依然含有藻毒素[17],太湖藍藻經過厭氧發酵沼液中EMC-LR和TMC-LR質量濃度分別為15.82 μg/L和9.05 μg/L。沼液經過接觸氧化-水生蔬菜濕地組合工藝后藻毒素的變化見表 4。藍藻沼液經過接觸氧化池后,TMC-LR去除率平均為79%,EMC-LR去除率平均為86%,藻毒素的質量濃度大大降低,水生蔬菜濕地出水中藻毒素基本低于0.3 μg/L。
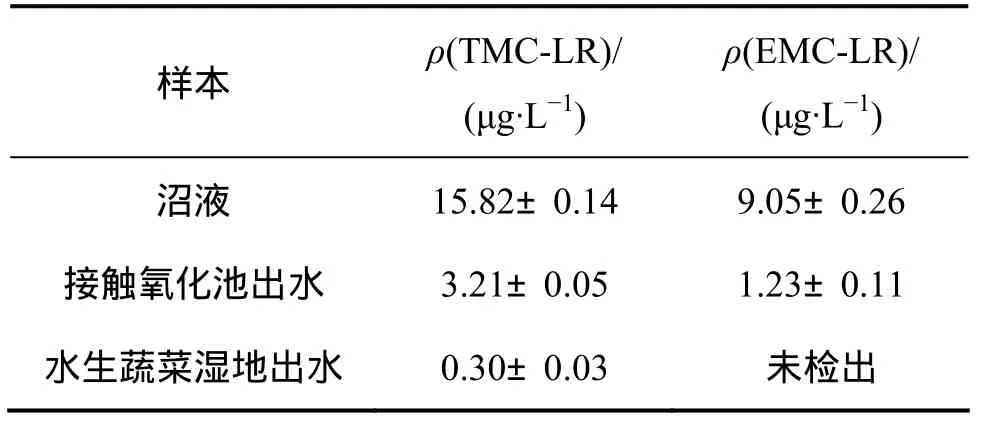
表4 組合工藝對沼液中藻毒素去除效果Table 4 Effect of combined process on algal toxins removal rate in effluent
接觸氧化池對沼液中藻毒素的去除途徑主要包括以下幾個方面:首先接觸氧化池填充比表面積較大的組合填料,其對沼液中未降解的藻類吸附,降低沼液中藍藻的含量;同時接觸氧化池填料中馴化富集大量溶藻菌,附著在填料生物膜表面的藻類進一步被填料中溶藻菌進行溶藻, 釋放出藻細胞內的毒素,再通過藻毒素降解菌進行降解。接觸氧化池在好氧狀態下有利于藻毒素的去除[18]。此外富集在生物膜表面的藻毒素隨著生物膜的脫落通過沉淀池排除接觸氧化池剩余污泥時,會一起排出系統外。水生蔬菜人工濕地為植物、微生物和水中浮游的原生動物和后生動物等共生系統,空心菜龐大根系富集的微生物有利于對胞外藻毒素的降解,植物根系的截留與浮游動物的吞噬,進一步降低胞內藻毒素的含量[19-20]。
3 結論
(1) 太湖富藻水厭氧發酵沼液經過接觸氧化池的處理后,減少污染物的負荷,降低由于高濁度進水對水生蔬菜濕地所造成的堵塞。水生蔬菜發達的根系具有強大的表面積,為攔截顆粒物和微生物的富集提供場所。沼液經過接觸氧化-水生蔬菜濕地處理后,化學需氧量ρ(COD)<50 mg/L、氨氮質量濃度ρ(NH3-N)<1.5 mg/L、總氮質量濃度ρ(TN)<5.9 mg/L、總磷質量濃度ρ(TP)<0.5 mg/L,可滿足《城鎮污水處理廠污染物排放標準》(GB 18918—2002)一級A排放標準。
(2) 接觸氧化池能夠有效去除太湖富藻水厭氧發酵沼液中烷烴類污染物、芳烴及雜環類難降有機物。接觸氧化-水生蔬菜濕地組合工藝對沼液COD去除率可以達到80%以上。
(3) 接觸氧化-水生蔬菜濕地組合工藝能夠有效地降解太湖富藻水厭氧發酵沼液中的微囊藻毒素,系統出水中藻毒素基本低于0.3 μg/L。接觸氧化池填料與水生蔬菜根系的有效截留及富集的大量微生物是藻毒素有效降解的主要因素。
[1] 孔繁翔, 馬榮華, 高俊峰, 等. 太湖藍藻水華的預防、預測和預警的理論與實踐[J]. 湖泊科學, 2009, 21(3): 314-328.KONG Fanxiang, MA Ronghua, GAO Junfeng, et al. The theory and practice of prevention, forecast and warning on cyanobacteria bloom in Lake Taihu[J]. Journal of Lake Sciences, 2009, 21(3): 314-328.
[2] 程真文. 巢湖藻類污染的研究和對策[J]. 水處理技術,2003, 29(4): 247-248.PENG Zhenweng. Research and countermeasures of algae pollution algae pollution in Chaohu Lake [J].Technology of water treatment, 2003, 29(4): 247-248.
[3] 胡萍. 藍藻厭氧發酵產沼氣的研究[D]. 無錫: 江南大學環境與土木工程學院, 2009: 1-2.HU Ping. Study on anaerobic fermentation with blue algae to produce methane[D]. Wuxi: School of Environmental and Civil Engineering, Jiangnan University, 2009: 1-2.
[4] 杜靜, 嚴少華, 常志州, 等. 太湖藍藻產沼氣潛力及復合折流板反應器(ABR)工藝中試[J]. 江蘇農業學報, 2008,24(6): 948-953.DU Jing, YAN Shaohua, CHANG Zhizhou, et al. Potential of methane production of blue algae and its feasibility of fermen- tation with anaerobic baffled reactor[J]. Jiangsu Journal of Agricultural Sciences, 2008, 24(6): 948-953.
[5] 國家環境保護總局. 水和廢水監測分析方法[M]. 第 4版.北京: 中國環境科學出版社, 2004: 210-284.State Environmental Protection Administration of China.National standard methods for water and wastewater quality analysis[M]. 4th eds. Beijing: China Environmental Science Press, 2004: 210-284.
[6] 宋海亮. 水生植物濾床技術改善富營養化水體水質的研究[D]. 南京: 東南大學環境工程與工程系, 2005: 56-57.SONG Hailiang. Study on aquatic plant filter bed system for eutrophicated water quality improvement[D]. Nanjing:Southeast University. Department of Environmental Science and Engineering, 2005: 56-57.
[7] 張立將, 尹立紅, 浦躍樸, 等. 水中微囊藻毒素高效液相色譜檢測與前處理條件優化[J]. 東南大學學報: 自然科學版, 2005, 35(3): 446-451.ZHANG Lijiang, YIN Lihong, PU Yuepu, et al. Optimization in analysis and sample preparation of microcystins in water with high-performance liquid chromatography[J]. Journal of Southeast University: Natural Science Edition, 2005, 35(3):446-451.
[8] 沈幸, 劉云, 鮮啟鳴, 等. 太湖水源地水體中半揮發性有機物的監測[J]. 環境污染與防治, 2006, 28(5): 396-398.SHEN Xing, LIU Yun, XIAN Qiming, et al. Monitoring of semivolatile organic compounds in source water of Taihu Lake[J]. Environmental Pollution & Control, 2006, 28(5):396-398.
[9] 朱惠岡, 俞順章. 飲水中致癌、致突變物(上)[J]. 環境保護,1985(3): 28-30.ZHU Huigang, YU Shunzhang. Carcinogens and matagenicity in drinking water(Ⅰ)[J]. Environmental Protection, 1985(3): 28-30.
[10] 朱惠岡, 俞順章. 飲水中致癌、致突變物(下)[J]. 環境保護,1985(4): 21-23.ZHU Huigang, YU Shunzhang. Carcinogens and matagenicity in drinking water(Ⅱ)[J]. Environmental Protection, 1985(4): 21-23.
[11] 任南琪, 李建政. 環境污染防治中的生物技術[M]. 北京:化學工業出版社, 2004: 127-128.REN Nanqi, LI Jianzheng. Biological technology in the treatment of environmental pollution[M]. Beijing: Chemical Industry Press, 2004: 127-128.
[12] Marona H R N, Schenkel E P, Bergonci J I. Phytotoxic activity of ateleia glazioviana baill, extracts on lettuce seeds[J]. Acta Fram Bonaerense, 2003, 22: 17-20.
[13] 方芳, 王淑梅, 馮翠杰, 等. 好養條件下復合生物膜-活性污泥反應器中的反硝化菌群結[J]. 生態學雜志, 2011,30(3): 430-437.FANG Fang, WANG Shumei, FENG Cuijie, et al.Community structure of denitrifying bacteria in a hybrid AS-biofilm process under aerobic condition[J]. Chinese Journal of Ecology, 2011, 30(3): 430-437.
[14] 董春娟, 呂炳南, 馬立, 等. 微生物群落在難降解物質生物降解中的作用[J]. 哈爾濱工業大學學報, 2003, 35(7):893-896.DONG Chunjuan, Lü Bingnan, MA Li, et al. Importance of microorganism community for degradation of refractory compounds[J]. Journal of Harbin Institute of Technology,2003, 35(7): 893-896.
[15] Hansen J I, Andersen F O. Effects of phragmites roots and rhizomes on nitrification and bacterial numbers in the ediments[C]//Proceedings of the 9th Nordic Symposium on Ediments. Norr Malmo, Weden, 1981: 68-71.
[16] US Environment Protection Agency. Manual-constructed wetlands treatment of municipal wastewaters(EPA/625/R-99/010)[R]. Cincinnati, Ohio: Office of Research and Development, National Risk Management Research Laboratory, 1999: 35-36.
[17] 薛延豐, 李慧明, 石志琦. 藍藻發酵沼液對青菜生物學特性和品質影響初探[J]. 江西農業學報, 2009, 21(10): 59-62.XUE Yanfeng, LI Huiming, SHI Zhiqi. Effects of biogas slurry of blue-green algae on biologica1 characteristics and quality of chinese cabbage[J]. Acta Agriculturae Jiangxi,2009, 21(10): 59-62.
[18] 呂錫武, 稻森悠平, 丁國際. 有毒藍藻及微囊藻毒素生物降解的初步研究[J]. 中國環境科學, 1999, 19(2): 138-140.LU Xiwu, YUHEI Inarnori, DING Guoji. Degradation of microcystis viridis and microcystins with biological reacroes[J]. China Environmental Science, 1999, 19(2):138-140.
[19] Cousins I T, Bealing D J, Janmes H A, et al. Biodegradation of microcystin-LR by indigenous mixed bacterial populations[J]. Water Research, 1996, 30(2): 481-485
[20] Iwami N, Inamori Y. Predation and degradation characteristics of microcystis forming water bloom by combination of functional micro-animals[J]. Japanese Journal Water Treatment Biology,1999, 35(4): 225-233.

