緩激肽多肽片段間非共價作用的質譜研究
陳 琛 儲艷秋 戴新華 方 向 丁傳凡,*
(1復旦大學化學系激光化學研究所,上海200433;2中國計量科學研究院化學計量與分析科學研究所,北京100013)
1 引言
蛋白質分子是一切生命的基礎,1它的結構和功能一直是生命科學領域內人們關注的主要問題之一.2目前大多數的理論認為,影響溶液中蛋白質分子結構的因素有多種,包括疏水作用、氫鍵作用、二硫鍵的形成等.3-5雖然經過數十年來科學家們的不斷努力,已經取得了較大成就和進展,但由于多肽和蛋白質分子的分子內作用力的復雜性,多肽和蛋白質分子的氣相構象等問題仍然需要作進一步深入的探討.6-8
近幾年以來,隨著質譜學技術在生命科學中的廣泛應用,有關氣相多肽和蛋白質分子結構的研究取得了很多進展.隨著軟電離技術的發展,特別是電噴霧電離(ESI)9,10和基質輔助激光解吸電離(MALDI)11,12等技術的出現,多肽和蛋白質樣品在分析過程中,可以“完整”地由溶液進入氣相而被檢測,接近生理狀態下獲得分子相互作用的化學計量比、結合勢和能量等信息.13這種“軟”電離技術不但使得一些熱不穩定、強極性、難揮發的化合物可以被檢測,而且使得質譜的應用范圍從小分子擴展到蛋白質等生物大分子.因此,電噴霧質譜已經成為研究蛋白質以及多肽之間非共價相互作用的有效手段之一.14
質譜學探討氣相多肽分子的結構15具有獨特的優點:第一,可以將感興趣的某一種多肽分子單獨“挑”出來開展研究,因此可以獲得與這種多肽分子一一對應的化學或物理性質信息,而不是眾多分子的平均信息;第二,由于可以獲得去溶劑化情況下多肽分子的結構,因此可以排除溶劑化作用的影響,所得到的多肽主要考慮分子間氫鍵和疏水力的作用;第三,串級質譜分析技術還可以定量或半定量地獲得多肽分子間或分子內相互作用鍵合強度的信息.例如,Koomen等16采用電噴霧質譜法等技術研究了強啡肽1-7和胃泌激素I這兩種多肽間的非共價相互作用.結果發現,在pH 5-7的時候,強啡肽1-7和胃泌激素I可以形成非共價復合物,而且單個多肽不會形成二聚體.
緩激肽分子是由九個氨基酸縮合而成的多肽.緩激肽對于人體而言具有多種功能.17-21例如,緩激肽可以作為一種血漿激肽調節肌肉的收縮和舒張,調節毛細血管的滲透性,作為合成一氧化氮的選擇性前體,可以參與血管緊張素轉化酶抑制劑對心血管起保護作用,對小細胞肺癌起抑制作用等.因此,三維結構的氣相緩激肽的空間構象引起了人們極大的興趣.許多方法被應用于研究緩激肽的結構.例如,Lopez等22用固體核磁共振(NMR)的方法研究了與人體G-蛋白偶聯受體B2結合的緩激肽的結構.Wyttenbach等23用離子色譜的方法研究了緩激肽分子的氣相構象,得到了它們精確的碰撞截面.實驗發現,由基質輔助激光解吸電離得到的三種陽離子形式的緩激肽離子(BK+H)+、(BK+Na)+、(BK-H+2Na)+具有幾乎相同的碰撞截面(2.45±0.03)nm2.并且這些碰撞截面在300到600 K的溫度下是相互獨立的.
值得一提的有Rodriquez等24通過量子化學理論計算,預計氣相緩激肽(序列為RPPGFSPFR)在空間可以形成穩定的構象.對于+1價緩激肽[BK+H]+而言,C端精氨酸殘基的羧基和N端精氨酸側鏈的胍基上的氮原子形成的氫鍵是緩激肽構象穩定的主要因素,也就是說,與溶液中相同,+1價緩激肽[BK+H]+在氣相仍然可以形成兩性離子(zwitterion).可以預見,緩激肽兩端的精氨酸殘基(R)對于其在氣相中的穩定性起著至關重要的作用.
本文選用緩激肽分子(圖1)為研究對象,研究分子內氫鍵對多肽空間結構的影響.Russell等25在對氣相緩激肽離子構象的研究中發現,緩激肽分子中在絲氨酸與脯氨酸之間(圖1中位置1),以及苯丙氨酸與絲氨酸之間(圖1中位置2)易發生斷裂.由此,我們想探討分子的折疊是否由于其兩邊的多肽之間的非共價作用——氫鍵相互作用造成的,因此分別在斷裂位置1合成對應的兩種多肽RPPGFS和PFR,在斷裂位置2合成多肽RPPGF和SPFR.此外,由于Rodriquez等24預計緩激肽兩端的精氨酸殘基(R)可以形成氫鍵,因此,我們又設計合成了去掉N端或者C端精氨酸的多肽PPGFS、PPGF、PF和SPF.采用電噴霧質譜研究了緩激肽兩種斷裂方式產生的多肽,以及緩激肽兩端去掉精氨酸殘基(R)后兩種斷裂方式產生多肽之間的非共價相互作用.通過對非共價復合物離子[A+B+H]+(A,B表示不同的多肽)的碰撞誘導解離,定性地比較了不同多肽間氫鍵的結合強度,并使用質譜滴定法定量地比較了緩激肽兩端是否含有精氨酸對其構象穩定性的影響.
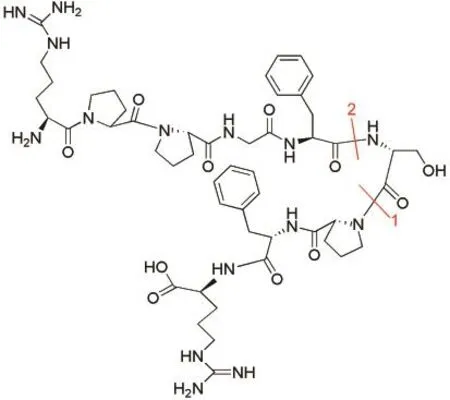
圖1 緩激肽分子結構圖Fig.1 Structure of bradykinin
2 實驗部分
2.1 化學試劑
實驗中所用的多肽樣品RS-6(RPPGFS)、PR-3(PFR)、RF-5(RPPGF)、SR-4(SPFR)、PS-5(PPGFS)、PF-4(PPGF)、PF-2(PF)和SF-3(SPF)購于吉爾生化上海有限公司,中國,其序列及各項參數如表1所示.甲醇(純度99.9%)購于Merck化學試劑公司,德國(Darmstadt,Germany),乙酸(純度99.5%)購于國藥集團化學試劑公司,中國.
2.2 多肽溶液的制備
將8種多肽樣品溶于去離子水中,用含有0.1%醋酸的甲醇溶液(甲醇與水體積比為9:1)稀釋成8×10-5mol·L-1的溶液.任選兩種多肽樣品配制得到摩爾比為1:1的多肽混合液,其中單個多肽的濃度為2×10-5mol·L-1.將得到的28組多肽混合液在25 °C的恒溫箱內反應24 h.另配制單個多肽濃度為2×10-5mol·L-1的8種多肽混合液,在25°C的恒溫箱內反應24 h待用.
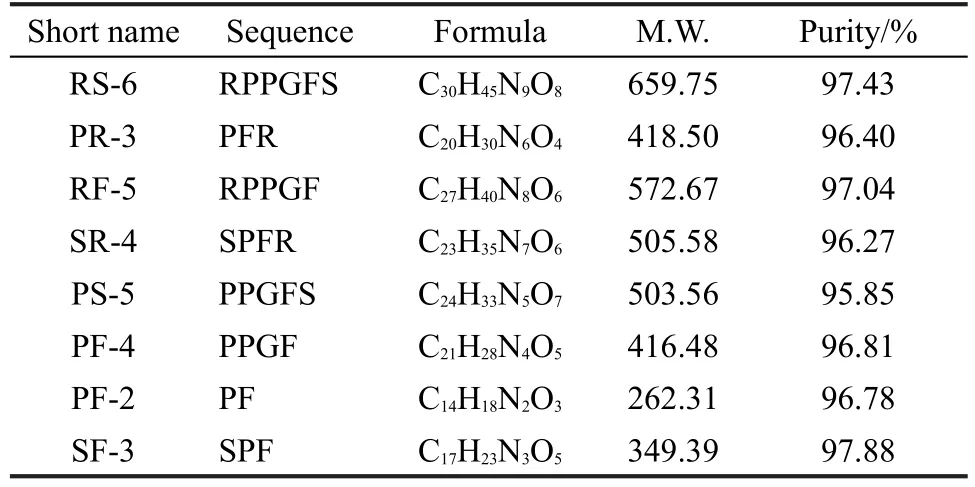
表1 多肽樣品序列及其它參數Table 1 Sequence and other parameters of peptide samples
2.3 電噴霧電離質譜的測定
Finnigan LTQ線性離子阱質譜儀(Thermo Finnigan,美國,m/z2000),電噴霧電離離子源(ESI),正離子掃描模式.采用流動進樣分析(FIA),進樣速率為5 μL·min-1.所用的助噴霧氣和簾氣均為高純氮氣(99.999%).電噴霧電離工作電壓為3.5 kV,毛細管溫度設為350°C.
2.4 碰撞誘導解離實驗
為了探討多肽與多肽相互作用形成的非共價復合物的結合強度,我們在不同的碰撞能量下對其進行了碰撞誘導解離(CID)的實驗.碰撞誘導解離實驗的測定與2.3節中所用儀器相同,氦氣作為碰撞氣體,離子活化參數Q值設為0.25,活化時間為30 ms,隔離寬度設為1m/z.
2.5 結合常數的測定
配制不同摩爾比(1:1、1:2、1:3、1:4、1:5、1:6、1:7、1:8、1:9、1:10)的多肽RS-6和多肽PR-3的混合液、多肽RF-5和多肽SR-4的混合液以及多肽PF-4和多肽SF-3的混合液,經過ESI-MS分析,由公式(1),26計算得到兩個多肽之間的結合常數Kst.定義Kst=[A+B+H]+/([A][B]),定義Ir=Ic/(Ic+Ia),Ir代表質譜峰的相對強度,其中Ic和Ia分別表示非共價復合物[A+B+H]+和多肽A質譜峰的相對強度.Kc是常數,[A]、[B]表示兩個多肽的初始濃度.
3 結果與討論
3.1 電噴霧質譜結果
將合成得到的8種多肽混合溶液進樣,ESI-MS結果顯示,除去單個多肽的質譜峰外,存在兩個多肽間的非共價結合峰,包括[PS-5+PF-4+H]+、[RF-5+PF-4+H]+、[2RF-5+H]+、[RS-6+RF-5+H]+以及具有相同m/z=1076.17的質譜峰[RS-6+PF-4+H]+和[RF-5+PS-5+H]+,如圖2所示.可以發現這些非共價結合峰對應的兩個多肽具有相似的序列,其中一個多肽完全包含另一個多肽的序列,例如多肽PS-5(PPGFS)和PF-4(PPGF),故這類非共價結合峰類似單個多肽二聚體的非共價結合峰,例如[2RF-5+H]+.而m/z=1078.42的結合峰對應[RS-6+PR-3+H]+和[RF-5+SR-4+H]+,是多肽RS-6和多肽PR-3以及多肽RF-5和多肽SR-4在自由競爭的環境下,形成較強的非共價結合質譜峰,而這兩條多肽正好對應緩激肽分子在位置1和2斷裂形成的碎片多肽.由此可以證明緩激肽二級結構中的分子折疊是由于碎片多肽之間較強的氫鍵作用引起的.
3.1.1 不同斷裂位置下碎片多肽之間的相互作用
在斷裂位置1下合成得到兩種多肽RS-6(RPPGFS)和PR-3(PFR),將其以1:1混合反應,得到的質譜圖如圖3(a)所示.m/z=1078.33所對應的分子離子為[RS-6+PR-3+H]+離子,它表明多肽RS-6和多肽PR-3之間存在非共價相互作用并形成了新的復合物.在斷裂方式2下得到多肽RF-5(RPPGF)和SR-4(SPFR),同樣以1:1混合反應,得到的質譜圖如圖3(b)所示.其中m/z=1078.42所對應的分子離子為[RF-5+SR-4+H]+離子,表明多肽RF-5和多肽SR-4之間也存在非共價的相互作用,并且形成了非共價復合物.可見,在這兩處斷裂位置下對應合成的兩條多肽分子都能夠再次結合,并形成非共價復合物,它說明緩激肽分子中這兩條片段之間存在氫鍵作用.
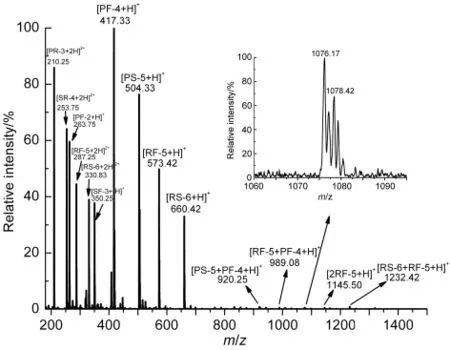
圖2 8個混合肽的電噴霧電離質譜圖Fig.2 ESI mass spectra of 8 mixed peptides
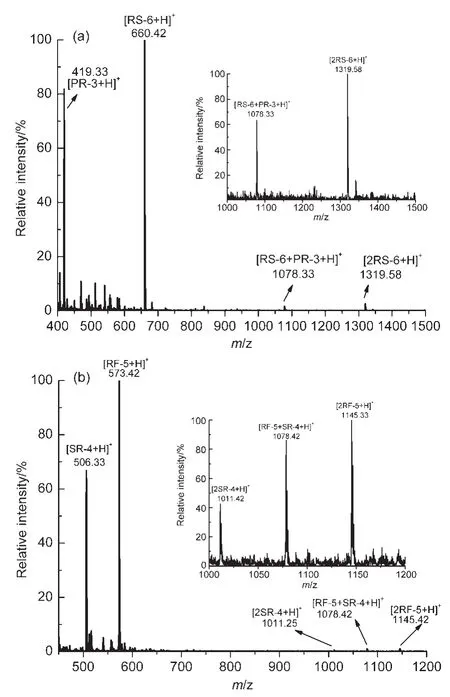
圖3 多肽組合(a)RS-6+PR-3,(b)RF-5+SR-4的電噴霧電離質譜圖Fig.3 ESI mass spectra of peptide mixtures(a)RS-6+PR-3,(b)RF-5+SR-4
3.1.2 去掉N端或C端精氨酸后合成的多肽間的相互作用
將緩激肽分子N端的精氨酸(R)去掉后,在斷裂位置1下合成得到PS-5(PPGFS)和PR-3(PFR)兩種多肽,在相同的條件下以1:1混合反應,得到圖4(a)所示的質譜圖.其中m/z=922.17所對應的分子離子峰為[PS-5+PR-3+H]+離子.在斷裂位置2下合成得到對應序列的多肽PF-4(PPGF)和SR-4(SPFR),同樣條件下反應,得到圖4(b)的電噴霧質譜結果,其中m/z=922.17是形成的非共價結合峰[PF-4+SR-4+H]+.
當將緩激肽分子C端的精氨酸(R)去掉后,斷裂位置1下合成得到RS-6(RPPGFS)和PF-2(PF)兩種多肽,將其以1:1混合反應,發現沒有結合峰的質譜信號出現.將同時去掉緩激肽分子中N端和C端精氨酸后合成得到的多肽PS-5(PPGFS)和PF-2(PF)以1:1混合反應后,也未得到兩者的結合信號.然而在斷裂方式2下,去掉C端精氨酸后合成得到多肽RF-5(RPPGF)和SF-3(SPF);同時去掉N端和C端的精氨酸合成得到多肽PF-4(PPGF)和SF-3(SPF)都能夠形成1:1的非共價復合物,所得到的質譜圖如圖4(c,d)所示.實驗結果表明,緩激肽分子中N端的精氨酸對于兩個多肽間相互作用的影響較小,而C端的精氨酸對其相互作用則影響較大.
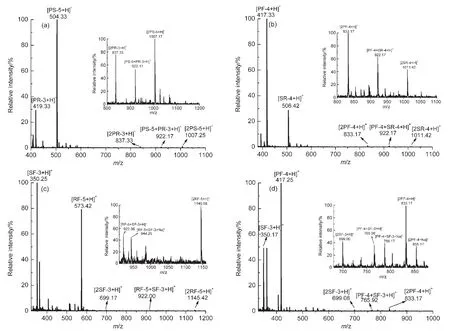
圖4 多肽組合(a)PS-5+PR-3,(b)PF-4+SR-4,(c)RF-5+SF-3,(d)PF-4+SF-3的電噴霧電離質譜圖Fig.4 ESI mass spectra of peptide mixtures(a)PS-5+PR-3,(b)PF-4+SR-4,(c)RF-5+SF-3,(d)PF-4+SF-3
通過以上實驗可以發現,在斷裂位置2下,無論去掉N端或者C端的精氨酸,或者同時去掉N端和C端的精氨酸得到的兩個多肽之間都是可以形成非共價結合的,如圖4中(b,c,d)所示.說明在這種斷裂方式下,由于一條多肽的N端為絲氨酸,它不僅存在一個氨基并且絲氨酸的側鏈上含有羥基基團,從而容易與其他多肽之間形成氫鍵.
Wyttenbach等23的研究表明緩激肽在空間呈現緊密的球形結構(global).在緩激肽的優勢構象中,在多肽序列Ser6-Pro7-Phe8-Arg9位置處有一個β-轉角.而Russell等25在對氣相緩激肽離子構象的研究中發現,緩激肽分子中苯丙氨酸與絲氨酸之間(圖1中位置2)易發生斷裂.因此,絲氨酸位置的β-轉角可能是位置2易發生斷裂的原因.而位置1中連接的是絲氨酸與脯氨酸,眾所周知,脯氨酸的連接位點為容易發生斷裂的位置.有趣的是,我們的研究發現,即使沒有端位的精氨酸,帶有絲氨酸的SPF仍然可以與PPGF結合,表明絲氨酸在緩激肽優勢構象的β-轉角中發揮重要的作用,即對于緩激肽二級結構的穩定起到了重要的作用.
3.1.3 任意兩種多肽間的非共價結合情況
將8種多肽中任意兩種以1:1摩爾比混合反應得到28組混合肽,其結合情況結果如表2所示.通過電噴霧質譜檢測發現,多肽PF-2(PF)與其他大多數多肽無相互作用,這是由于多肽PF-2是由兩個疏水的氨基酸脯氨酸(P)和苯丙氨酸(F)組成.其中脯氨酸是一種亞氨基酸,它的α氨基和側鏈形成五元環的結構,而苯丙氨酸的側鏈上含有一個苯環,這些結構都使得它們不容易與其他的多肽通過氫鍵等作用力發生相互作用.
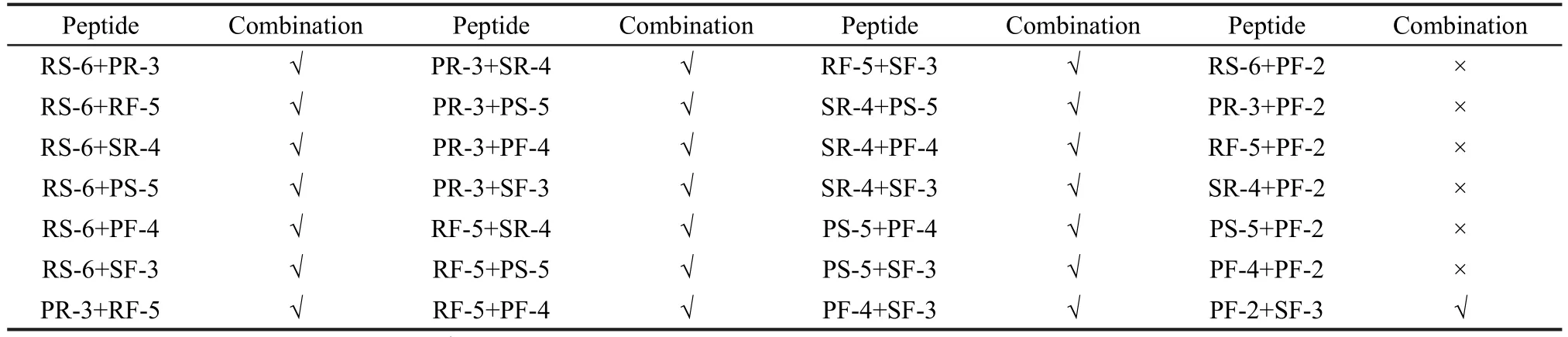
表2 任意兩個多肽混合后的非共價結合情況Table 2 Combination results of the mixture of two peptides
3.2 碰撞誘導解離實驗
對上述28組混合肽中有相互作用組合的結合峰在不同的碰撞能量下進行碰撞誘導解離的實驗.選取結合峰作為母離子,碰撞能量從10 eV開始增加,以氦氣作為碰撞氣體進行反應,如圖5所示.表3顯示的是開始出現對應的多肽碎片離子時的能量,以及母離子峰強度降低到最強碎片峰強度10%時的碰撞能量.由CID的實驗結果可知,多肽組合RS-6+PR-3,RF-5+SR-4(分別對應與緩激肽分子在位置1、2斷裂得到的碎片序列相同的多肽)其結合峰降低到最強峰強度的10%時所需要的能量較大,為50 eV,說明這兩種多肽之間的非共價相互作用較強.而去掉N端精氨酸的多肽組合PS-5+PR-3和PF-4+SR-4中的兩個多肽間的相互作用也較強,同樣為50 eV,進一步說明了N端精氨酸對兩條肽段之間的相互作用影響較小.而同時去掉N端和C端精氨酸的多肽組合PF-4+SF-3,他們之間的相互作用力相對較小,在25 eV的碰撞能量下,其結合峰的強度就降低到最強峰強度的10%以下.可見C端的精氨酸對于兩條多肽鏈之間的相互作用有重要的影響.這也為解釋緩激肽分子空間結構的形成提供了重要、可靠的基礎信息.
3.3 結合常數的測定
Rodriquez等24通過量子化學理論計算,指出在+1價氣相緩激肽中,C端精氨酸殘基的羧基和N端精氨酸側鏈的胍基上的氮原子可以形成氫鍵,+1價緩激肽[BK+H]+在氣相仍然為兩性離.Schnier等27通過黑體輻射實驗也提供證據證明緩激肽在氣相中含有一個鹽橋的結構.為了定量比較N端或C端是否帶有精氨酸對氣相緩激肽分子的影響,我們測定了多肽RS-6和PR-3、多肽RF-5和SR-4以及多肽PF-4和SF-3兩兩之間的結合常數.
實驗中,固定多肽RS-6的濃度為1×10-5mol·L-1,配制摩爾比為1:1、1:2至1:10的多肽RS-6與PR-3的混合液,其余兩組溶液配制方法相同.經過ESI-MS分析,通過公式(1)可知,1/Ir和1/[B]之間存在線性關系,通過作圖,結合常數Kst可由截距與斜率的比求得.實驗中測得的三組多肽間的結合常數如表4所示.
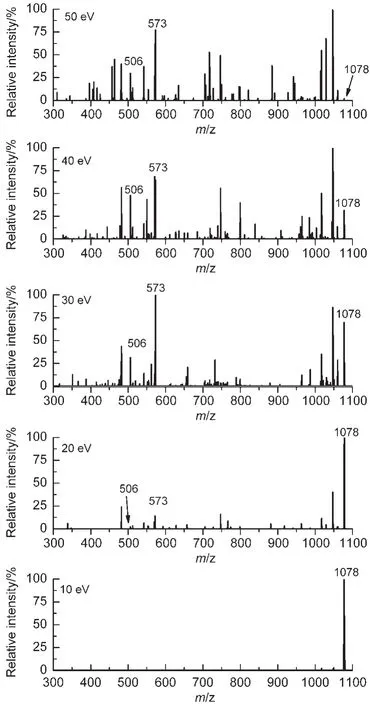
圖5 [RF-5+SR-4+H]+在不同碰撞能量下的CID結果Fig.5 CID results of[RF-5+SR-4+H]+at different collision energies

表3 多肽復合物的CID結果Table 3 CID results of peptide complexes

表4 三組多肽的結合常數及線性擬合方程Table 4 Linear equation and binding constants for three groups of peptides
根據文獻,7反應的產率a1可以由公式(2)計算,其中Icomplex和Ipeptide1分別為復合物和其中一個多肽片段的質譜強度,計算結果也列于表4.

產率計算結果表明,端位不帶精氨酸的多肽片段之間的反應產率(5%)要低于端位帶有精氨酸的多肽RS-6與PR-3(10%)或與RF-5與SR-4(10%)的產率,產率的結果也表明端位帶有精氨酸的多肽間更容易發生反應.
結合常數的數據表明,多肽RS-6與多肽PR-3(3.53×103),以及多肽RF-5與多肽SR-4(3.16×103)之間的非共價結合較強,而同時去掉N端和C端精氨酸的合成得到的多肽PF-4與多肽SF-3的結合(1.25×103)相對較弱.這也與上面碰撞誘導解離的實驗結果一致.進一步說明N端和C端精氨酸的氫鍵結合對于緩激肽分子折疊起著重要的作用.
4 結論
用電噴霧質譜法結合碰撞誘導解離技術研究了基于緩激肽分子的碎片多肽片段之間的非共價相互作用.實驗結果表明,在斷裂方式1下,緩激肽多肽片段RS-6和PR-3之間可以形成1:1的非共價復合物.去掉緩激肽分子N端精氨酸后的多肽PS-5和PR-3也可以形成1:1的非共價復合物.當去掉緩激肽分子C端精氨酸后,RS-6和PF-2的反應液中沒有結合的復合物的質譜峰出現.同時去掉N端和C端精氨酸后的多肽組合PS-5和FP-2其質譜圖中,也沒有結合的復合物質譜峰.斷裂方式2下,合成得到多肽RF-5和SR-4,去掉緩激肽分子N端或者C端精氨酸后合成得到的多肽組合PF-4+SR-4、RF-5+SF-3、PF-4+SF-3,都能得到1:1的結合產物.通過碰撞誘導解離技術,確定了多肽與多肽之間形成的1:1非共價復合物.在不同的碰撞能量下,定性地分析了不同序列多肽之間相互作用強度的大小,結果發現RS-6+PR-3及RF-5+SR-4之間的非共價氫鍵相互作用比其他多肽間的非共價作用要強,自由競爭狀態下形成的質譜峰也證實了這一點.同時去掉N端和C端精氨酸合成得到的多肽組合PF-4+SF-3的非共價結合較弱.質譜滴定法定量測得的RS-6和PR-3的結合常數為3.53×103,與RF-5+SR-4的結合常數(3.16×103)相接近,它們均大于去除精氨酸的PF-4+SF-3的結合常數(1.25×103).
綜合質譜譜圖分析、碰撞誘導解離以及質譜滴定的定量測定結果,可以判定絲氨酸位于氣相緩激肽分子轉角位置,而緩激肽分子兩端的精氨酸之間的氫鍵作用對氣相緩激肽分子構象的穩定起著重要作用.
(1)Aebersold,R.;Goodlett,D.R.Chem.Rev.2001,101,269.doi:10.1021/cr990076h
(2)Aebersold,R.;Mann,M.Nature2003,422,198.doi:10.1038/nature01511
(3) Matysiak,S.;Debenedetti,P.G.;Rossky,P.J.J.Phys.Chem.B2012,116,8095.doi:10.1021/jp3039175
(4)Bolen,D.W.;Rose,G.D.Annu.Rev.Biochem.2008,77,339.doi:10.1146/annurev.biochem.77.061306.131357
(5) Hatahet,F.;Ruddock,L.W.Antioxid.Redox Sign.2009,11,2807.doi:10.1089/ars.2009.2466
(6) Rinner,O.;Muller,L.N.;Hubalek,M.Nat.Biotechnol.2007,25,345.doi:10.1038/nbt1289
(7)Chu,Y.Q.;Pan,T.T.;Dai,Z.Y.;Yu,Z.W.;Zheng,S.B.;Ding,C.F.Acta Phys.-Chim.Sin.2008,24,1981.[儲艷秋,潘婷婷,戴兆云,俞卓偉,鄭松柏,丁傳凡.物理化學學報,2008,24,1981.]doi:10.3866/PKU.WHXB20081108
(8) Murray,J.K.;Gellman,S.H.Biopolymers2007,88,657.
(9)Whitehouse,C.M.;Dreyer,R.N.;Yamashita,M.T.;Fenn,J.B.Anal.Chem.1985,57,675.doi:10.1021/ac00280a023
(10)Qin,Y.J.;Wei,S.G.;Wang,X.L.;Yang,F.;Wang,B.;Guo,X.H.Chem.J.Chin.Univ.2011,32,2748.[秦玉嬌,魏士剛,王曉錄,楊 帆,汪 兵,國新華.高等學校化學學報,2011,32,2748.]
(11) Karas,M.;Hillenkamp,F.Anal.Chem.1988,60,2299.doi:10.1021/ac00171a028
(12) Beavis,R.C.;Chait,B.T.Methods Enzymol.1996,270,519.doi:10.1016/S0076-6879(96)70024-1
(13)Wang,Q.;Chu,Y.Q.;Zhang,K.;Dai,X.H.;Fang,X.;Ding,C.F.Acta Phys.-Chim.Sin.2012,28,971.[王 青,儲艷秋,張 開,戴新華,方 向,丁傳凡.物理化學學報,2012,28,971.]doi:10.3866/PKU.WHXB201112201
(14) Lorenzen,K.;Versluis,C.;van Duijn,E.;van den Heuvel,R.;Heck,A.Int.J.Mass Spectrom.2007,268,198.doi:10.1016/j.ijms.2007.06.012
(15) Syka,J.E.P.;Coon,J.J.;Schroeder,M.J.;Shabanowitz,J.;Hunt,D.F.P.Natl.Acad.Sci.U.S.A.2004,101(26),9528.doi:10.1073/pnas.0402700101
(16) Koomen,J.M.;Ruotolo,B.T.;Gillig,K.J.;Russel,D.H.J.Am.Mass Spectrom.2002,13,166.doi:10.1016/S1044-0305(01)00348-8
(17) Ianzer,D.;Konno,K.;Marques-Porto,R.;Portaro,F.;Stocklin,R.;Pimenta,D.C.Peptides2004,25,1085.doi:10.1016/j.peptides.2004.04.006
(18)Marshall,P.;Heudi,O.;Mckeown,S.;Amour,A.;Abou-Shakra,F.Rapid Commun.Mass Spectrom.2002,16,220.
(19) Pierson,N.A.;Chen,L.;Valentine,S.J.;Russell,D.H.;Clemmer,D.E.J.Am.Soc.Mass Spectrom.2011,133,13810.
(20)Kakoki,M.;McGarrah,R.W.;Kim,H.S.;Smithies,O.P.Natl.Acad.Sci.U.S.A.2007,104,7576.doi:10.1073/pnas.0701617104
(21) Pallante,G.A.;Cassady,C.J.Int.J.Mass Spectrom.2002,219,115.doi:10.1016/S1387-3806(02)00556-0
(22) Lopez,J.J;Shukla,A.K.;Reinhart,C.Angew.Chem.Int.Edit.2008,7,1668.
(23)Wyttenbach,T.;vonHelden,G.;Bowers,M.T.J.Am.Chem.Soc.1996,118(35),8355.doi:10.1021/ja9535928
(24) Rodriquez,C.F.;Orlova,G.;Guo,Y.Z.;Li,X.M.;Siu,C.K.;Hopkinson,A.C.;Siu,K.W.M.J.Phys.Chem.B2006,110(14),7528.doi:10.1021/jp046015r
(25) Russell,D.H.;Barbacci,D.C.;Gimon-Kinsel,M.E.J.Mass Spectrom.1999,34,124.
(26)Yu,Z.;Cui,M.;Yan,C.Y.;Song,F.R.;Liu,Z.Q.;Liu,S.Y.Rapid Commun.Mass Spectrom.2007,21,683.
(27)Schnier,P.D.;Price,W.D.;Jockusch,R.A.;Williams,E.R.J.Am.Chem.Soc.1996,118(30),7178.doi:10.1021/ja9609157

