正癸烷與二甲苯在超臨界壓力下的熱裂解
周 灝 毛 佳 汪必耀 朱 權 王健禮 李象遠,*
(1四川大學化學工程學院,成都 610065;2四川大學化學學院,成都 610064)
1 引言
吸熱型碳氫燃料主要是利用燃料在較高溫度下發生裂解反應,生成一些高熱值的小分子烴類和氫氣以供燃燒,并在此過程中吸收大量無用以致有害的能量來達到冷卻發動機的目的.此類燃料組分非常復雜,主要包括鏈烷烴、環烷烴、芳香烴和烯烴,為了提高裂解反應的轉化率和選擇性,需要更好地了解各種組分裂解的詳細過程,對反應的過程和規律進行深入的研究,從而為改善燃料的性能以及提高燃料吸熱能力提供更好的依據.
正癸烷是具有代表性的直鏈烷烴,常作為替代組分研究航空煤油的特性.1,2目前對其裂解燃燒的研究在理論上已經比較成熟,3-7Zeppieri等8還根據正庚烷機理模型發展了正癸烷的部分簡化的骨架機理,但在實驗上的研究則很少,9-11大部分都集中在催化裂解方面,而對正癸烷本身的熱裂解規律研究的不多.芳香烴具有高能量密度,12,13是航空燃料的重要組分,而且苯等芳香烴一直被視為結焦的前驅體,14但是在實驗和理論上對芳香烴裂解規律的研究均很少.15-17此外,比較芳香烴和直鏈烷烴在相同條件下的熱裂解規律,能從實驗上探究這兩種不同的化學結構的裂解差異.
燃料作為冷卻劑時,需要在高于臨界壓力下實現等密度相變,避免燃料“沸騰”對發動機工作的穩定性造成不利影響.正癸烷和二甲苯的臨界壓力分別為2.11和3.54 MPa,因此本文在4 MPa,650、700、750°C條件下開展這兩種燃料成分的熱裂解對比研究,著重考察這兩種物質在氣相產物產率、轉化率,氣相產物和液相產物成分上的差異,并從理論上對反應規律進行分析和驗證.
2 實驗
2.1 實驗原料和實驗裝置
本實驗選用純度≥99.9%的正癸烷和二甲苯作為實驗原料.實驗裝置如圖1所示,包括進料系統、反應系統、冷凝系統和產物分析系統.反應管為2 mm內徑的304不銹鋼管,反應管加熱段長700 mm.用高壓平流泵將反應原料以1.0 g·s-1的質量流量注入反應器進行熱裂解反應,系統壓力用背壓閥調節,反應產物通過冷凝器后到達氣液分離器,收集液相產物和氣相產物,并用氣相色譜對氣相產物進行在線分析.為了實現在超臨界壓力下的裂解,本文控制系統壓力為4 MPa,產物出口溫度為650、700、750°C,反應前用99.99%的氮氣吹掃反應管.
2.2 分析方法
氣相產物用上海計算技術研究所的GC-2000III型氣相色譜儀進行分析,小分子烴類采用HP-Al/S毛細管柱(50 m×0.530 mm×15.0 μm,Agilent公司)和氫火焰離子化檢測器;氫氣采用自制的2 m填充柱(固定相為TDX-101)和熱導檢測器.載氣為高純氮氣.
液相產物用美國Agilent公司的HP-6890/5973型氣相色譜/質譜聯用儀進行分析,色譜柱為HP-5MS毛細管分離柱(30 m×25 mm×0.25 μm,Agilent公司),載氣為高純氮氣.

圖1 超臨界裂解反應裝置圖Fig.1 Setting drawing of supercritical pyrolysis
3 實驗結果與分析
3.1 氣相產物產率和轉化率
正癸烷和二甲苯裂解氣相產物產率(y)由(1)式計算,裂解轉化率(x)由(2)式計算:

其中,m為單位時間原料總進料質量,mg為單位時間裂解氣相產物質量,ml為單位時間裂解液相產物質量,wl為裂解液相產物中殘存原料的質量分數.圖2顯示了正癸烷和二甲苯裂解氣相產物產率.由圖2可以看出,隨著溫度升高,正癸烷的氣相產物產率明顯增大,遠大于二甲苯的值.說明正癸烷的裂解生成了大量的小分子烴類,并且隨著溫度的升高裂解程度加劇,而二甲苯則不易生成小分子烴類.
表1列出了正癸烷和二甲苯的裂解轉化率.從表1可以看出,二甲苯的轉化率在750°C時達到了約70%,說明二甲苯在實驗條件下會發生裂解反應,但主要途徑是生成其它液態烴類產物.結合其氣相產物產率可以推斷二甲苯裂解過程中可能主要發生側鏈甲基斷裂和脫氫反應,苯環結構保持穩定,18并主要生成一些其它芳香類化合物.正癸烷的轉化率和氣相產物產率的趨勢相一致,并且轉化率和氣相產物產率相差不大,說明正癸烷裂解過程中,C-C鍵和C-H鍵斷裂,生成大量的小分子烴類,斷鍵程度隨溫度升高而加深,同時可能伴有自由基的聚合反應發生.二者裂解反應的差異主要是由正癸烷和二甲苯裂解反應活化能的不同造成的.正癸烷裂解反應的誘發步驟,應該是C-C鍵斷裂,而這些C-C單鍵均由C的sp3雜化軌道形成,鍵能較小.在二甲苯裂解誘發階段,苯環開環時需要破壞共軛π鍵,活化能較大,而二甲苯上取代基的CC鍵由苯環C原子的sp2雜化軌道和甲基C原子sp3雜化軌道組成,鍵能比正癸烷的C-C鍵能高,裂解難度更大.

圖2 正癸烷和二甲苯裂解氣相產物產率(y,質量分數)Fig.2 Cracking gas yields(y,mass fraction)of n-decane and dimethylbenzene
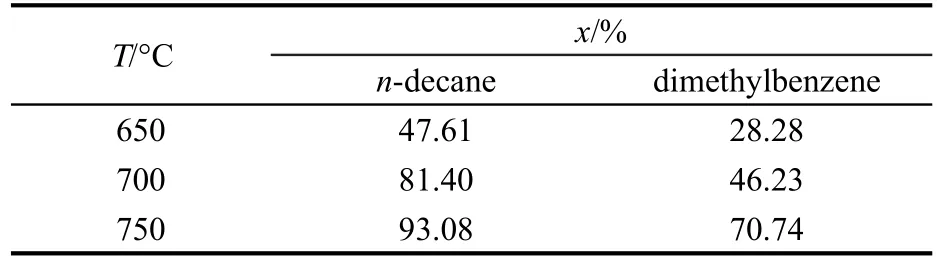
表1 正癸烷和二甲苯的裂解轉化率(x,質量分數)Table 1 Conversion ratio(x,mass fraction)of n-decane and dimethylbenzene
3.2 裂解產物分布
3.2.1 氣相產物
圖3為正癸烷裂解氣相產物含量隨溫度的變化情況.由圖3可以看出,正癸烷裂解氣相產物主要有甲烷、乙烷、乙烯、丙烯和氫氣,隨著溫度的升高甲烷含量不斷上升,乙烷、乙烯和丙烯含量呈現下降趨勢,證實正癸烷裂解主要生成C1-C3的小分子烴類和氫氣,正癸烷裂解反應以鏈上C-C鍵斷裂和脫氫反應為主,并且隨著溫度升高斷鍵程度加深,發生二次裂解,反應向著生成甲烷的方向進行.
圖4為二甲苯裂解氣相產物含量隨溫度的變化情況.由圖4可以看出,二甲苯裂解氣相產物主要是甲烷和氫氣,幾乎沒有其它小分子烴類生成,結合氣相產物產率和轉化率證實二甲苯裂解主要發生側鏈甲基C-C鍵斷裂和脫氫反應,苯環基本保持穩定.隨著溫度升高,甲烷含量降低而氫氣含量升高,結合轉化率可以發現二甲苯裂解生成的甲烷可能與側鏈甲基自由基發生反應生成乙苯等其它芳香類化合物,并且可能有稠環芳烴出現.

圖3 正癸烷裂解氣相產物含量(體積分數)Fig.3 Gas product contents of n-decane cracking(volume fraction)
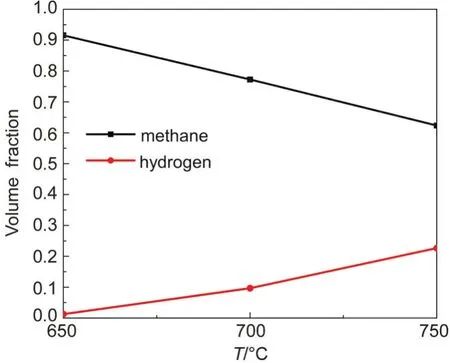
圖4 二甲苯裂解氣相產物含量(體積分數)Fig.4 Gas product contents of dimethylbenzene cracking(volume fraction)
3.2.2 液相產物
正癸烷和二甲苯在4 MPa和出口溫度為650、700、750°C條件下裂解的液相產物通過色質聯用儀進行分析,并用峰面積歸一化法計算各產物成分的相對含量(質量).結果表明正癸烷裂解的液相產物成分復雜.我們將其歸為鏈烷烴、環烷烴、鏈烯烴、環烯烴和芳香烴五類,其中鏈烷烴和鏈烯烴中產物C原子數均不大于正癸烷;而二甲苯裂解液相產物幾乎全為芳香類化合物,主要成分為甲苯、乙苯和未裂解的二甲苯.
由圖5可以看出,在650°C正癸烷裂解液相產物以鏈烷烴和鏈烯烴為主,再次說明正癸烷裂解反應主要為鏈上C-C鍵斷裂和脫氫反應.同時可以看出,隨著溫度升高,鏈烷烴含量降低,鏈烯烴含量先升高后降低,環烷烴、環烯烴和芳香烴含量升高,說明隨著溫度上升,正癸烷裂解深度逐漸加深,鏈烷烴脫氫生成鏈烯烴和環烷烴,部分鏈烯烴和環烷烴再脫氫聚合生成環烯烴和芳香烴,這與氣相產物中氫氣含量不斷升高相符合,并且隨著溫度升高,聚合程度加深,產物越來越復雜,在750°C發現有稠環芳烴生成.
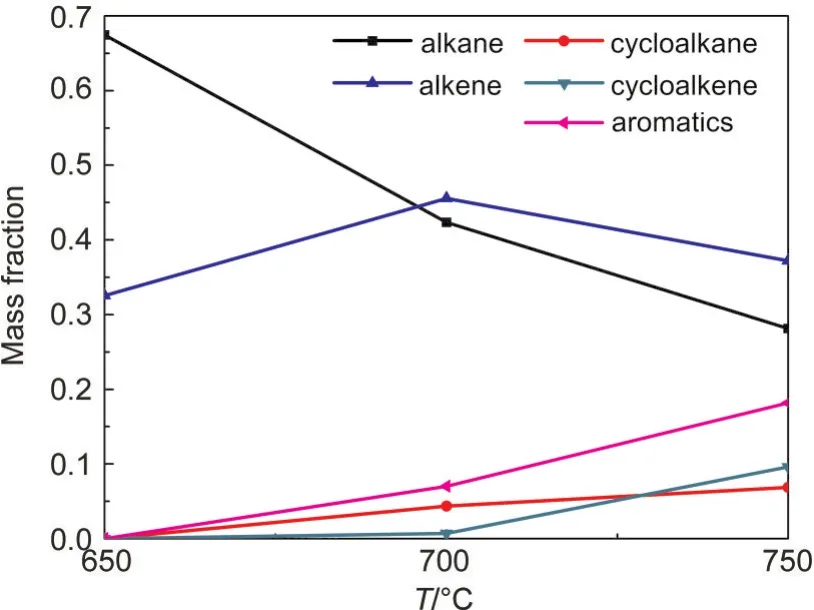
圖5 正癸烷裂解液相產物含量(質量分數)Fig.5 Liquid product contents of n-decane cracking(mass fraction)
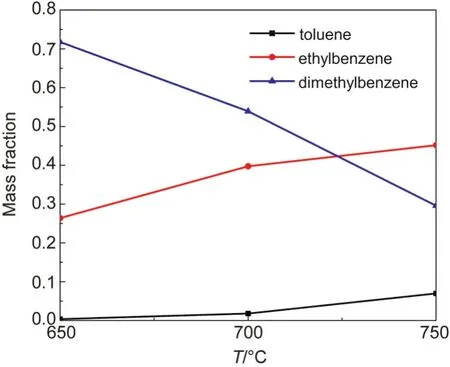
圖6 二甲苯裂解液相產物含量(質量分數)Fig.6 Liquid product contents of dimethylbenzene cracking(mass fraction)
由圖6可以看出,在650°C二甲苯裂解液相產物主要是乙苯和未裂解的二甲苯,說明二甲苯發生裂解反應主要是以斷側鏈甲基和脫氫反應為主,并且生成的甲基與苯環上甲基脫氫的自由基結合生成乙苯,可能的反應步驟如下:
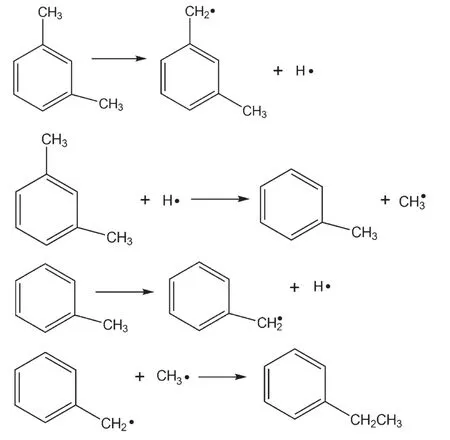
更深入的研究需要構建裂解反應的復雜反應機理.可以看出,隨著溫度升高,液相產物中的二甲苯含量降低,乙苯和甲苯含量上升,三種物質總含量在750°C仍占整個液相產物的70%以上,其余也為芳香類化合物,有稠環芳烴出現,說明二甲苯的裂解反應由于受芳環穩定性的影響,與正癸烷裂解反應相比較,反應程度并不深,裂解產物也比較單一,主要是發生側鏈甲基斷裂和轉移反應,同時也有一定程度的聚合反應發生.
為了進一步驗證二甲苯裂解過程中苯環的穩定性,本文計算了單位時間二甲苯裂解液相產物中苯環的摩爾含量與原料中苯環的摩爾含量之比,以此來說明二甲苯裂解過程苯環的裂解程度.計算結果顯示,在650、700、750°C,二甲苯裂解液相產物與原料中含有的苯環摩爾含量之比始終在90%以上,分別為98.08%、96.83%、92.16%,說明二甲苯裂解開環比率很低.
4 理論計算
本文采用密度泛函(DFT)方法在BHandHLYP/6-31+G(d,p)基組19,20水平上對所有反應中涉及到的物種的幾何結構進行優化和頻率計算,并在此基礎上計算了相應鍵能.通過計算發現零點能校正對鍵能的計算影響較小,因此本文未考慮零點能校正.對穩定分子斷裂為兩個自由基片段情形,鍵能Eb表示為:

其中,Exy為反應物分子的能量,Ex·和Ey·為斷鍵后的兩個自由基片段的能量.對于苯環開環情形,鍵能Eb表示為:

其中,Exy為芳烴分子的能量,E·xy·為苯環C-C鍵斷裂后的雙自由基的能量.考慮到化學鍵較強的相互作用,本文未考慮基組重疊誤差.本文所有計算均在Gaussian 03程序包21上完成.由于二甲苯與甲苯的結構非常相似,僅相差一個甲基,因此它們相應的化合鍵鍵能也非常接近,所以本文用甲苯代替二甲苯計算相應的鍵能,鍵能計算的原子編號見圖7,計算結果列于表2.
由表2可見,正癸烷碳鏈骨架的C-C鍵能比C-H鍵能小,因而裂解的誘發步驟應該是C-C鍵的斷裂反應.而甲苯情形則大不相同,除苯環上CC鍵能由于共軛效應而加強外,苯環上的C-H鍵由于C原子采用sp2雜化而比烷烴C-H鍵能更大,相較于側鏈甲基不容易發生拆環和脫氫反應.在取代基上,C-H鍵和苯環上C-H鍵相比,由于C原子采用sp3雜化,鍵能降低,因而取代基上的脫氫反應難度較小,而C-C鍵鍵能由于苯環和取代基之間的pπ共軛效應,因此鍵能比普通的C-C單鍵鍵能大.可以判斷,甲苯裂解的誘發步驟應該是取代基上的C-H鍵斷裂,但這個步驟比正癸烷的C-C鍵斷裂仍然要困難得多.通過表中數據分析,從理論上可以預測正癸烷比二甲苯更容易發生裂解反應,并且正癸烷裂解反應主要為鏈上C-C鍵的斷裂及后續的脫氫反應,而二甲苯裂解反應主要為甲基脫氫和進一步的取代基分離,苯環基本保持相對穩定.鍵能的計算結果很好地解釋了兩種單組分燃料的裂解實驗現象.
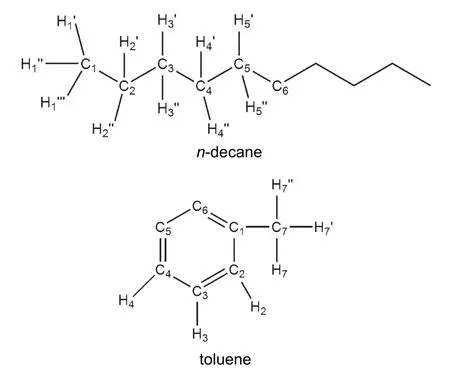
圖7 鍵能計算原子編號Fig.7 Atomic numbering in the calculation of binding energy

表2 正癸烷和甲苯中C-C和C-H鍵能(Eb)Table 2 C-C and C-H binding energies(Eb)in n-decane and toluene
5 結論
本文通過兩種單組分燃料的熱裂解比較,發現了正癸烷和二甲苯裂解性能的明顯差異.實驗結果表明,和二甲苯相比,正癸烷裂解容易得多,正癸烷裂解反應過程中C-C鍵的斷裂和脫氫反應可以在任何位置發生,而二甲苯裂解反應則以取代基上的C-C鍵的斷裂和脫氫反應為主,在本文的實驗溫度下,難以發生開環反應.
作為代表性的鏈烷烴,正癸烷的裂解產物主要為C1-C3小分子的烴類和氫氣,并且隨著溫度升高反應向著生成甲烷和氫氣的方向進行,同時,其液相產物成分復雜,隨著溫度升高環烴和芳香烴含量上升,脫氫聚合程度加深.
二甲苯是一種重要的芳香烴,其裂解產物以乙苯、甲苯和其它芳香類化合物為主,并且隨著溫度升高乙苯和甲苯含量上升,也有一定程度的聚合反應發生,有稠環芳烴生成,同時,其氣相產物含量很低,主要為甲烷和氫氣.
通過兩種體系鍵能的對比計算表明,正癸烷各個化學鍵鍵能均較小,裂解反應的誘發步驟應該是C-C鍵斷裂,與此不同,二甲苯苯環上C-C和CH鍵能均較大,不易發生開環和環上脫氫反應,裂解誘發步驟應該是側鏈甲基脫氫反應,以及更高溫度下取代基的分離和苯環縮合,進而形成稠環芳烴.理論計算很好地解釋了實驗現象.
(1) Dagaut,P.;Bakali,E.A.;Ristori,A.Fuel2006,85,944.doi:10.1016/j.fuel.2005.10.008
(2) Humer,S.;Frassoldati,A.;Granata,S.;Faravelli,T.;Ranzi,E.;Seiser,R.;Seshadri,K.Proc.Combust.Inst.2007,31,393.doi:10.1016/j.proci.2006.08.008
(3) Westbrook,C.K.;Pitz,W.J.;Herbinet,O.;Curran,H.J.;Silke,E.J.Combust.Flame2009,156,181.doi:10.1016/j.combustflame.2008.07.014
(4) Olchanski,E.;Burcat,A.Int.J.Chem.Kinet.2006,38,703.
(5) Bikas,G.;Peters,N.Combust.Flame2001,126,1456.doi:10.1016/S0010-2180(01)00254-1
(6) Nehse,M.;Warnatz,J.;Chevalier,C.Symposium(International)on Combustion1996,26,773.doi:10.1016/S0082-0784(96)80286-4
(7) Battin-Leclerc,F.;Fournet,R.;Glaude,P.A.;Judenherc,B.;Warth,V.;Come,G.M.;Scacchi,G.Proc.Combust.Inst.2000,28,1597.doi:10.1016/S0082-0784(00)80557-3
(8) Zeppieri,S.P.;Klotz,S.D.;Dryer,F.L.Proc.Combust.Inst.2000,28,1587.doi:10.1016/S0082-0784(00)80556-1
(9) Yin,K.L.;Wu,G.Y.;Chen,Z.L.Acta Petr.Sin.2006,17,77.[殷開梁,鄔國英,陳正隆.石油學報,2006,17,77.]
(10)Wang,Z.W.;Zhang,X.W.;Mi,Z.T.;Hao,W.H.Petrochem.Technol.2005,34,518.[王占衛,張香文,米鎮濤,郝偉華.石油化工,2005,34,518.]
(11) Jiao,Y.;Li,J.;Wang,J.B.;Wang,J.L.;Zhu,Q.;Chen,Y.Q.;Li,X.Y.Acta Phys.-Chim.Sin.2011,27,1061.[焦 毅,李 軍,王靜波,王健禮,朱 權,陳耀強,李象遠.物理化學學報,2011,27,1061.]doi:10.3866/PKU.WHXB20110437
(12) Pitz,W.J.;Cernansky,N.P.;Dryer,F.L.;Egolfopoulos,F.N.;Farrell,J.T.;Friend,D.G.;Pitsch,H.InSAE 2007 Transactions Journal of Passenger Cars-Mechanical Systems,SEAPaper 2007-01-0175,2007.
(13) Farrell,J.T.;Cernansky,N.P.;Dryer,F.L.;Friend,D.G.;Hergart,C.A.;Law,C.K.;McDavid,R.M.;Mueller,C.J.;Patel,A.K.;Pitsch,H.In2007 SAE International Congress,SEAPaper 2007-01-0201,Detroit,MI,2007.
(14) Sivaramakrishnan,R.;Tranter,R.S.;Brezinsky,K.J.Phys.Chem.A2006,110,9388.doi:10.1021/jp060820j
(15)Zhang,L.D.;Cai,J.H.;Zhang,T.C.;Qi,F.Combust.Flame2010,157,1686.doi:10.1016/j.combustflame.2010.04.002
(16) Lannuzel,F.;Bounaceur,R.;Michels,R.;Scacchi,G.;Marquaire,P.J.Anal.Appl.Pyrolysis2010,87,236.doi:10.1016/j.jaap.2010.01.001
(17) Richter,H.;Howard,J.B.Prog.Energy Combust.Sci.2000,26,565.doi:10.1016/S0360-1285(00)00009-5
(18) Guo,L.Z.Study on Stability and Endothermic Capability of Hydrocarbon Fuels.MS Dissertation,Tianjin University,Tianjin,2005.[郭蘭珍.碳氫化合物安定性和吸熱性能的研究[D].天津:天津大學,2005.]
(19) Perdew,J.P.;Burke,K.;Ernzerhof,M.Phys.Rev.Lett.1996,77,3865.doi:10.1103/PhysRevLett.77.3865
(20) Becke,A.D.J.Chem.Phys.1993,98,5648.doi:10.1063/1.464913
(21) Frisch,M.J.;Trucks,G.W.;Schlegel,H.B.;et al.Gaussian 03[CP];Gaussian Inc.:Pittsburgh,PA,2003.

