低溫厭氧氨氧化生物濾池細菌群落沿層分布規律
曾濤濤,李冬,劉濤,邱文新,蔡言安,許達,張杰,
(1.哈爾濱工業大學 城市水資源與水環境國家重點實驗室,黑龍江 哈爾濱,150090;2.北京工業大學 水質科學與水環境恢復工程北京市重點實驗室,北京,100124)
厭氧氨氧化工藝(Anaerobic ammonia oxidation,ANAMMOX)是目前最簡捷和最經濟的生物脫氮途徑,是指在厭氧的條件下,以亞硝酸氮為電子受體,氨氮作為電子供體生成氮氣的過程[1]。反應式如下:

與傳統硝化-反硝化工藝相比,厭氧氨氧化具有需氧量低、運行費用低、污泥產量低和無需外加碳源等優點[2],已成為廢水生物脫氮研究中的熱點。厭氧氨氧化菌是一群分支很深的浮霉狀菌,迄今為止,通過分子生物學檢測手段已經在不同地點的人工或天然生態系統中鑒定了 5種不同的“Candidatus”ANAMMOX 菌屬,分別為Brocadia,Kuenenia,Jettenia,Anammoxoglobus和Scalindua[3]。氨氧化細菌(AOB)也是通過氧化氨來獲取能量的自養菌,有研究發現 AOB能夠在厭氧氨氧化反應器內生存[4];Nitrosomonas eutropha菌屬AOB能在氧受限的條件下,發生以亞硝酸氮為電子受體的厭氧氨氧化反應[5]。這些報道表明,關于厭氧氨氧化菌與好氧氨氧化菌之間關系的研究有助于提高生物脫氮反應器的性能。目前,關于ANAMMOX工藝的研究主要是針對污泥消化回流液和垃圾滲濾液等高氨氮廢水方面,最適溫度通常在30~40 ℃之間[6],對較低溫度下的厭氧氨氧化報道較少。關于ANAMMOX微生物方面的研究,主要是厭氧氨氧化菌在反應器的富集以及對該菌的分子生物學鑒定,對ANAMMOX反應器不同部位微生物群落分布進行系統研究比較少。本研究中厭氧氨氧化反應溫度在 14.9~16.2 ℃之間,用低溫厭氧氨氧化表示[7-8]。本文作者通過對低溫穩定運行的上流式厭氧氨氧化生物濾池沿層取樣,利用掃描電鏡(SEM)、變性梯度凝膠電泳技術(DGGE)和克隆測序等方法對細菌、ANAMMOX和AOB群落結構進行系統分析,探索生物濾池微生物群落沿層分布特征,以便為提高反應器效能研究提供便利。
1 材料與方法
1.1 反應器
試驗裝置為有效容積 45 L的圓柱形密閉有機玻璃生物濾柱,內徑185 mm。柱內裝填粒徑為4~6 mm的火山巖填料,填料高度為190 cm。反應器通過接種厭氧氨氧化污泥啟動成功,通過添加硫酸銨與亞硝酸鈉配置實驗用水,使得-N與的摩爾比(n(-N)∶n(-N))約為 1∶1.31,以符合厭氧氨氧化反應基質比例要求,氨氮質量濃度約為200 mg/L。另外添加1.5%的生活污水A/O(厭氧/好氧)除磷工藝的二級處理出水[9]。采用上向流進水方式,進水pH為7.2,溫度為冬季室溫(14.9~16.2 ℃),水力停留時間(HRT)為1.2 h,進水總氮負荷為4.8 kg/(m3·d),水力負荷為3.0 m3/(m2·d)。
1.2 生物膜形態觀察
在反應器上、中、下3部位分別收集厭氧氨氧化生物膜,按Wang等[10]介紹的方法處理樣品,通過掃描電鏡 (HITACHI S-4300) 觀察生物膜微觀結構。
1.3 變性凝膠梯度電泳
1.3.1 總DNA提取
在反應器上、中、下3部位各取200 mL含紅色污泥的生物膜水樣,于轉速為12 000 r/min、溫度為4℃的條件下離心10 min,收集沉淀。沉淀加入10 mL,濃度為0.1 mol/L的PBS (pH8.0)重懸2次。參考Zhou等[11]給出的細菌總DNA提取方法提取細菌總DNA。
1.3.2 PCR擴增
采用通用引物 BSF338-GC和 BSR518擴增細菌16S rDNA V3區片斷[12]。采用特異性引物amx368-GC和amx820擴增厭氧氨氧化16S rRNA基因[13]。對于AOB細菌,采用引物amoA-1F-GC與amoA-2R擴增AOB功能基因amoA[14]。3種引物信息如表1所示。PCR產物按 DNA純化回收試劑盒(天根)操作說明進行純化回收。
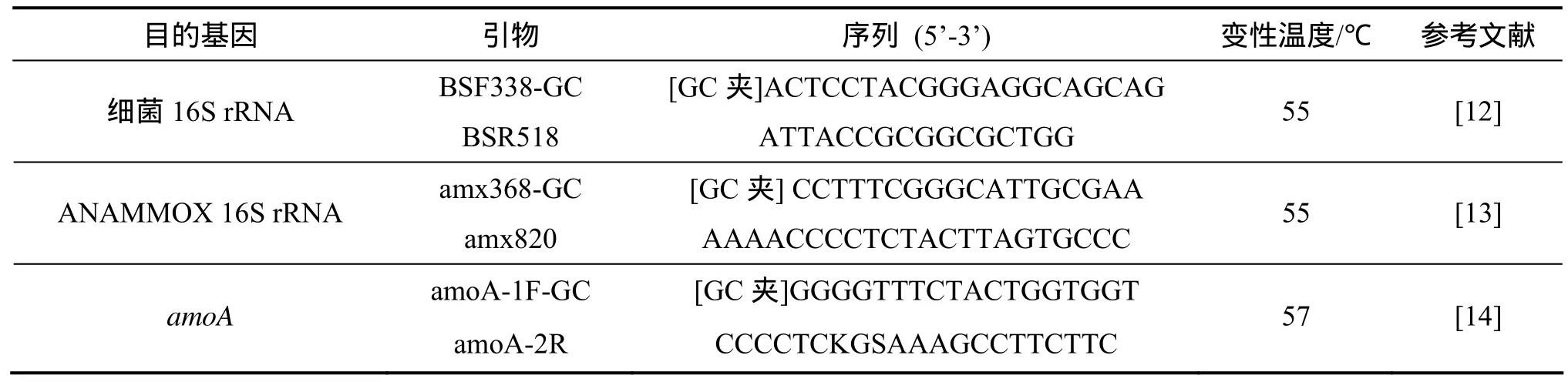
表1 PCR-DGGE所用引物信息Table 1 Summary of primer information for PCR-DGGE
1.3.3 DGGE及其結果分析
采用美國Bio-Rad公司DcodeTM的基因突變檢測系統對PCR反應產物進行電泳分離,電泳條件如下: 凝膠變性梯度為30%~60%,聚丙烯酰胺質量分數分別為8% (BSF338-GC/BSR518)和 6%(amx368-GC/amx820,amoA-1F-GC/amoA-2R),電壓為 120 V,緩沖液為1×TAE,溫度為 60 ℃,電泳時間分別為 5 h(BSF338-GC/BSR518),8 h(amx368-GC/amx820)和 10 h(amoA-1F-GC/amoA-2R)。電泳結束后對凝膠進行銀染[15],染色圖譜通過數碼相機獲取。
對 DGGE圖譜通過軟件 Quantity One 4.6.0(Bio-Rad,USA)進行分析,其中微生物群落多樣性用Shannon-Weaver指數(H)表示[16],其計算公式為:H=-∑PilnPi(其中Pi表示每個峰面積占總面積的比值)。而相關性分析主要分析反應器不同部位微生物種群相似性。
1.4 ANAMMOX菌與AOB系統發育分析
對于ANAMMOX菌與AOB DGGE凝膠上條帶進行切膠溶于100 μL 1×TE中,在4 ℃ 冰箱中放置24 h。以此為模板,相應不帶 GC夾的 amx368/amx820與amoA-1F/amoA-2R為引物,擴增厭氧氨氧化菌16S rRNA基因與 AOB 功能基因amoA。將回收的 PCR產物連接到載體 pMD19-T (TaKaRa)上,并轉化到感受態細胞Escherichia coliDH5α(天根)中去。通過藍白斑篩選陽性克隆并送交生工生物公司進行測序。獲得的序列通過NCBI網站的 BLAST工具在GenBank中搜索相近序列。將該序列與已發表的相關序列進行比對,通過MEGA 5.0軟件,以bootstrap-NJ法構建系統進化樹[17]。本研究所得的ANAMMOX菌16S rRNA基因序列與 AOB細菌amoA基因序列已提交至GenBank,登錄號分別為JN659913與JN659914。
2 結果與討論
2.1 生物濾池沿層脫氮效果
反應器出水平均pH為8.2,比進水pH (7.2)高,原因是ANAMMOX過程中主要消耗氫離子從而造成pH 升高。目前關于低溫(<20 ℃)厭氧氨氧化報道尚少, Dosta等[18]研究了溫度對厭氧氨氧化的影響,發現溫度<20 ℃條件下,厭氧氨氧化總氮去除負荷<0.5 kg/(m3·d)。Winkler等[19]研究了在溫度(18±3) ℃條件下厭氧氨氧化顆粒污泥反應器脫氮效果,發現總氮去除負荷為 0.9 kg/(m3·d)。在本研究中,反應器在較低溫度下(14.9~16.2 ℃)總氮去除負荷達 2.4 kg/(m3·d),表明火山巖生物濾池反應器即使在低溫下也具有極高的厭氧氨氧化脫氮效果。
為了更清楚地了解反應器沿層氮素變化情況,對生物濾柱沿進水方向每隔 10 cm取樣,對反應器上(140~190 cm)、中(60~140 cm)、下(10~60 cm) 3 部分氮素變化進行分析,結果如圖1所示。從圖1可見:沿濾層進水方向,氨氮和亞氮成比例消耗,總氮去除負荷也不斷提高。經計算,發現在反應器下部即進水端,消耗的n(-N)∶n(-N)=1∶1.02,大于厭氧氨氧化反應理論消耗n(-N)∶n(-N)(1∶1.31)。推測其原因是生物濾柱下部存在 AOB,能夠氧化一部分N。進水中的-N和-N 去除集中在生物濾柱中部(60~140 cm),且中部n(-N)∶n(-N)為 1∶1.31,符合厭氧氨氧化反應基質消耗的摩爾比,表明生物濾柱中部微生物以ANAMMOX菌為主。而在反應器上部,消耗的n(-N)∶n(-N)=1∶1.33,小于厭氧氨氧化反應理論消耗n(N)∶nN)(1∶1.31);同時,反應器上部積累了一定量的硝氮(20 mg/L),硝氮產生量與氨氮消耗量之摩爾比n(Δ3N)∶n(Δ-N)=0.23,小于理論n(Δ-N)∶n(Δ-N)(0.26),表明在反應器上部有一部分亞氮和硝氮以非厭氧氨氧化方式損失,推測反應器上部存在反硝化微生物,負責小部分亞氮和硝氮的去除。
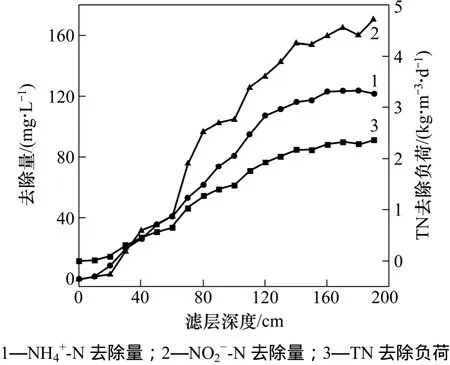
圖1 生物濾柱沿層脫氮情況Fig.1 Nitrogen removal along biofilter layer
2.2 微生物形態分析
在反應器運行過程中,觀察到生物膜上ANAMMOX菌所特有的紅色沿水流方向存在明顯的深淺變化,下部分生物膜呈暗褐色,中部分生物膜呈桃紅色,上部分生物膜逐漸轉為暗紅色,這反映ANAMMOX 生物量并不是均勻分布的。為了更詳細了解生物濾柱沿層生物膜微觀結構,對上、中、下 3部分生物膜通過掃描電鏡進行觀察,結果如圖2所示。上部分微生物形態不一,種類比較多,存在球形、桿形、弧形細菌及較多的絲狀菌;中部分微生物幾乎全是直徑1 μm的球形細菌,分布密集;下部分微生物存在球狀、橢球狀和桿狀細菌。
已報道的厭氧氨氧化細菌形態主要為球形,直徑在0.8~1.1 μm之間[20]。通過掃描電鏡對中部球形細菌放大10 000倍(圖2(d)),能更清楚地觀察這種球形細菌的特征:球形細胞表面并不十分光滑,存在一些細點狀凸起;細胞之間存在細絲狀連接,可能是細菌的分泌物,有助于細菌在填料表面附著生長。這些特征與已報道的厭氧氨氧化菌特征非常吻合[21]。這從微觀上證實了 ANAMMOX 生物主要分布在反應器中部的推測,這也是氮素大部分在反應器中部被去除的原因。
2.3 細菌群落結構沿層分析
細菌DGGE 上、中、下3條泳道上共觀察到12條不同的條帶,見圖3(a);對DGGE圖譜經過Quantity One 4.6.0分析繪制示意圖,見圖3(b),其中12條橫線位置及橫線顏色深淺,可以反映各條帶的分布與相對強度,也得到反應器內中,下部與上部細菌種群的相似性分別為 80.2%和 62.6%。另外,計算出微生物群落Shannon-Weaver指數H上,H中與H下分別為1.30,0.83和0.67。
DGGE凝膠上的條帶與細菌群落結構密切相關,不同位置的條帶代表著不同的細菌種類,條帶的數量反映了群落的多樣性。由圖 3(a)可知:反應器內共只有12條不同位置的條帶,表明細菌多樣性不是很高,這可能與反應器進水采用無機配水有關。條帶5,8,9和10在反應器上、中、下部分都出現,這些條帶代表的4類細菌在反應器上、中、下3部分都存在,分布比較均勻;上、中、下3部分DGGE條帶數目分別為10,7和6, Shannon-Weaver指數也是H上>H中>H下,這表明生物濾柱上部分細菌多樣性最高,中部其次,下層細菌多樣性最低。推測其原因是在生物濾柱進水端(下部),氨氮、亞氮濃度及水力負荷都很高,能夠適應這種條件的細菌比較少。同時,這些細菌會消耗進水中的微量溶解氧,為反應器創造厭氧環境。在生物濾柱中部,氨氮、亞氮質量濃度降低,厭氧環境適宜,因而會形成以ANAMMOX菌為主的微生物群落結構。在生物濾柱上部存在反硝化現象,因而反應器上部可能存在反硝化微生物;同時,下、中部的一些微生物也會隨水流到達上部,使得上部微生物種類較多。微生物群落結構沿層變化是適應生物濾柱沿層氮素變化的結果。

圖2 厭氧氨氧化生物濾池沿層微觀結構觀察Fig.2 Microstructure of different parts in ANAMMOX biofilter
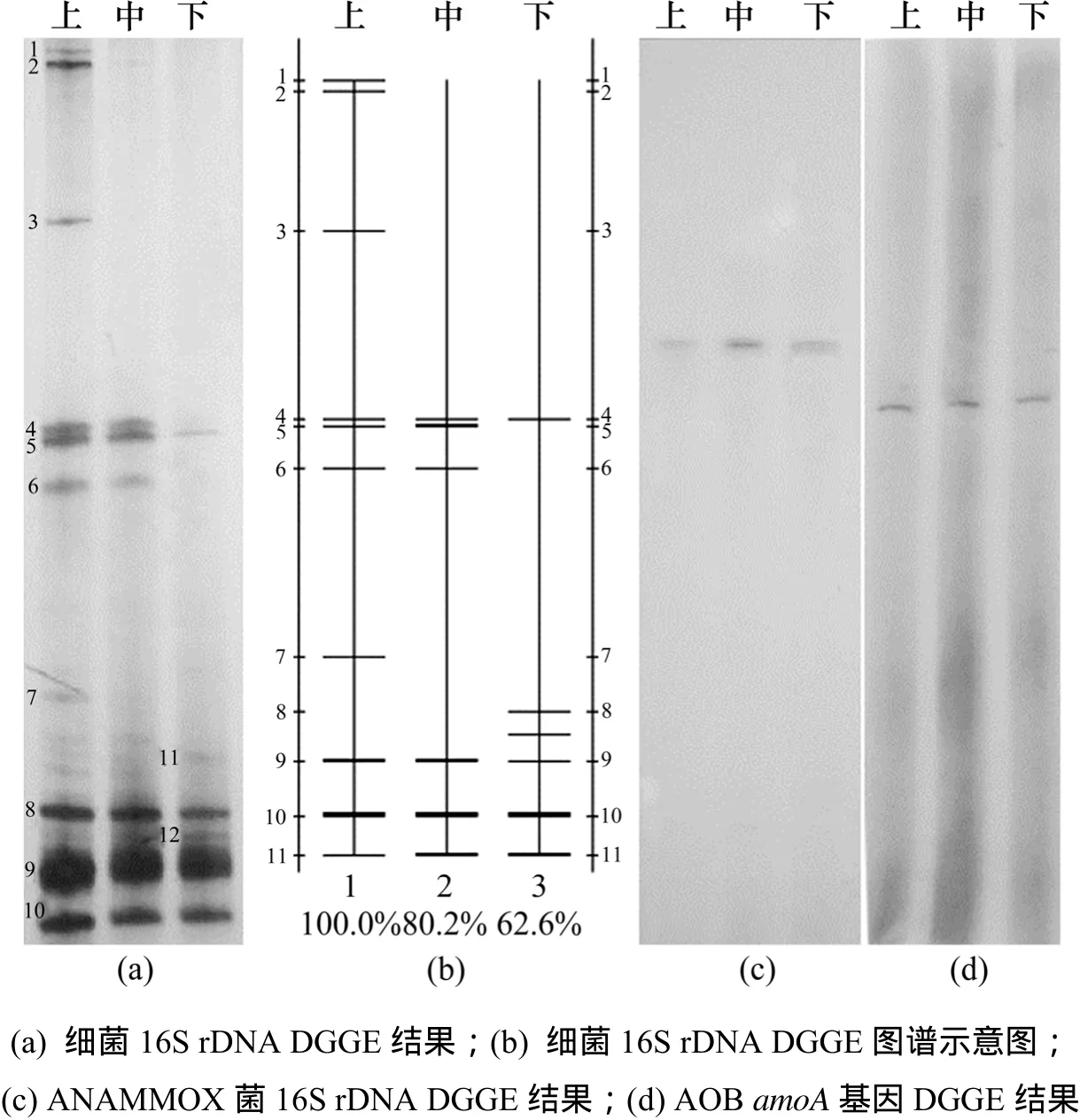
圖3 厭氧氨氧化生物濾池上、中、下部位微生物DGGE結果Fig.3 DGGE results of upper, middle, and lower parts in ANAMMOX biofilter
2.4 ANAMMOX與AOB群落結構及系統發育分析
上、中、下3部分ANAMMOX的 DGGE結果(見圖3(c))與AOB的DGGE結果(見圖3(d))都分別只有1個條帶,表明生物濾池沿層中 ANAMMOX與 AOB都分別只有1個種類,這與其他有關ANAMMOX在反應器內種類分布的研究結果一致[22]。在同一生態系統中,很少發現2個厭氧氨氧化種群同時出現,表明每一種厭氧氨氧化菌都有自己獨特的特性與特定的生態系統[23]。
對ANAMMOX菌進行菌屬鑒定,并構建系統發育樹(見圖 4),發現反應器內存在的 ANAMMOX 菌(JN659913 anammox bacteria)為Candidatus Kuenenia stuttgartiensis。這種 ANAMMOX 菌最早發現于生物濾池中[24],菌體呈球狀,直徑為1 μm左右,化能自養型,本研究中ANAMMOX菌與這些特征相吻合。一般文獻報道厭氧氨氧化工藝都是在較高的溫度(30~40 ℃)下運行,本實驗中厭氧氨氧化生物濾池在低溫下(14.9~16.2 ℃)也有很高的總氮去除負荷,顯示Candidatus Kuenenia stuttgartiensis能夠在低溫下穩定生長并保持較高的生物活性,因而,可以通過富集Candidatus Kuenenia stuttgartiensis來維持厭氧氨氧化工藝在較低溫度下(16 ℃左右)穩定運行。
在生物濾柱運行過程中,并沒有把進水中的溶解氧去除,進水中存在較低的溶解氧,因而,反應器出現能夠利用氨氮來獲取能量的自養需氧菌AOB。但反應器處于低溫、低溶解氧的環境,不具備 AOB適宜的生長繁殖條件,因而,反應器內 AOB種類單一,只有1種。通過克隆測序鑒定AOB菌屬,并構建系統發育樹,結果見圖5。圖5中JN659914 AOB amoA代表生物濾池中 AOB和已知氨氧化細菌的系統發育關系。發現生物濾池中 AOB與Nitrosomonas sp.ENI-11(AB079055.1)同源性最高,相似度達 98%。Nitrosomonas sp.ENI-11屬于亞硝化單胞菌屬(Nitrosomonas),Nitrosomonas為污水生物脫氮系統中比較常見 AOB菌屬,其能夠在低溶解氧環境下生存[5]。此類 AOB的存在能夠消耗進水中的微量溶解氧,為反應器創造厭氧環境,有利于生物濾柱中部富集較多的ANAMMOX菌,發揮厭氧氨氧化脫氮效果。

圖4 基于16S rDNA序列構建的厭氧氨氧化細菌系統發育樹Fig.4 Phylogenetic tree of ANAMMOX bacteria based on 16S rDNA sequences

圖5 基于amoA基因氨氧化細菌的系統發育樹分析Fig.5 Phylogenetic tree of AOB based on amoA gene sequences
3 結論
(1) 大部分氨氮與亞氮在反應器中部以厭氧氨氧化脫氮方式去除,反應器即使在低溫(14.9~16.2 ℃)條件下也具有很好的脫氮效果,總氮去除負荷達 2.4 kg/(m3·d)。
(2) 反應器中部微生物以類似 ANAMMOX菌的球形細菌為主。生物濾柱上部分細菌多樣性最高,中部其次,下層細菌多樣性最低。細菌群落結構沿層變化是適應生物濾柱沿層氮素變化的結果。
(3) 在反應器上、中、下部位存在同一種厭氧氨氧化菌(ANAMMOX)與好氧氨氧化菌(AOB)。反應器內存在的 ANAMMOX菌為Candidatus Kuenenia stuttgartiensis,AOB為Nitrosomonas sp.ENI-11。
[1]Jetten M S M, Strous M, van de Pas-Schoonen K T, et al.The anaerobic oxidation of ammonium[J].Fems Microbiology Reviews, 1998, 22(5)∶ 421-437.
[2]Jetten M S M, Horn S J, Vanloosdrecht M C M.Towards a more sustainable municipal wastewater treatment system[J].Water Science and Technology, 1997, 35(9)∶ 171-180.
[3]Jetten M S M, van Niftrik L, Strous M, et al.Biochemistry and molecular biology of anammox bacteria[J].Crit Rev Biochem Mol, 2009, 44(2/3)∶ 65-84.
[4]Li X R, Du B, Fu H X, et al.The bacterial diversity in an anaerobic ammonium-oxidizing (anammox) reactor community[J].Systematic and Applied Microbiology, 2009,32(4)∶ 278-289.
[5]Schmidt I, Sliekers O, Schmid M, et al.Aerobic and anaerobic ammonia oxidizing bacteria-competitors or natural partners?[J].FEMS Microbiol Ecol, 2002, 39(3)∶ 175-181.
[6]Zhang L, Zheng P, Tang C J, et al.Anaerobic ammonium oxidation for treatment of ammonium-rich wastewaters[J].Journal of Zhejiang University∶ Science B, 2008, 9(5)∶ 416-426.
[7]Isaka K, Date Y, Kimura Y, et al.Nitrogen removal performance using anaerobic ammonium oxidation at low temperatures[J].Fems Microbiology Letters, 2008, 282(1)∶ 32-38.
[8]楊朝暉, 徐崢勇, 曾光明, 等.不同低溫馴化策略下的厭氧氨氧化活性[J].中國環境科學, 2007(3)∶ 300-305.YANG Zhaohui, XU Zhengyong, ZENG Guangming, et al.Anaerobic ammonia oxidation activity under different low temperature domestication strategy[J].China Environmental Science, 2007(3)∶ 300-305.
[9]田智勇, 李冬, 楊宏, 等.上向流厭氧氨氧化生物濾池的啟動與脫氮性能[J].北京工業大學學報, 2009(4)∶ 509-515.TIAN Zhiyong, LI Dong, YANG Hong, et al.Start-up and nitrogen removal performance of anaerobic ammonium oxidation bio-filter[J].Journal of Beijing University of Technology, 2009(4)∶ 509-515.
[10]Wang T, Zhang H M, Gao D W, et al.Enrichment of Anammox bacteria in seed sludges from different wastewater treating processes and start-up of anammox process[J].Desalination,2011, 271(1/2/3)∶ 193-198.
[11]Zhou J, Bruns M A, Tiedje J M.DNA recovery from soils of diverse composition[J].Appl Environ Microbiol, 1996, 62(2)∶316-322.
[12]Ovreas L, Forney L, Daae F L, et al.Distribution of bacterioplankton in meromictic Lake Saelenvannet, as determined by denaturing gradient gel electrophoresis of PCR-amplified gene fragments coding for 16S rRNA[J].Appl Environ Microbiol, 1997, 63(9)∶ 3367-3373.
[13]Schmid M, Walsh K, Webb R, et al.Candidatus “Scalindua brodae”, sp.nov., Candidatus “Scalindua wagneri”, sp.nov., two new species of anaerobic ammonium oxidizing bacteria[J].Syst Appl Microbiol, 2003, 26(4)∶ 529-538.
[14]Nicolaisen M H, Ramsing N B.Denaturing gradient gel electrophoresis (DGGE) approaches to study the diversity of ammonia-oxidizing bacteria[J].J Microbiol Methods, 2002,50(2)∶ 189-203.
[15]Bassam B J, Caetano-Anolles G, Gresshoff P M.Fast and sensitive silver staining of DNA in polyacrylamide gels[J].Anal Biochem, 1991, 196(1)∶ 80-83.
[16]Shannon C E.The mathematical theory of communication.1963[J].MD Comput, 1997, 14(4)∶ 306-317.
[17]Tamura K, Peterson D, Peterson N, et al.MEGA5∶ molecular evolutionary genetics analysis using maximum likelihood,evolutionary distance, and maximum parsimony methods[J].Mol Biol Evol, 2011, 28(10)∶ 2731-2739.
[18]Dosta J, Fernandez I, Vazquez-Padin J R, et al.Short- and long-term effects of temperature on the anammox process[J].Journal of Hazardous Materials, 2008, 154(1/2/3)∶ 688-693.
[19]Winkler M K, Kleerebezem R, van Loosdrecht M C.Integration of anammox into the aerobic granular sludge process for main stream wastewater treatment at ambient temperatures[J].Water Res, 2012, 46(1)∶ 136-144.
[20]van Niftrik L, Geerts W J, van Donselaar E G, et al.Linking ultrastructure and function in four genera of anaerobic ammonium-oxidizing bacteria∶ cell plan, glycogen storage, and localization of cytochrome C proteins[J].J Bacteriol, 2008,190(2)∶ 708-717.
[21]Jetten M S M, Wagner M, Fuerst J, et al.Microbiology and application of the anaerobic ammonium oxidation (‘anammox’)process[J].Current Opinion in Biotechnology, 2001, 12(3)∶283-288.
[22]秦玉潔, 周少奇, 朱明石.厭氧氨氧化反應器微生態的研究[J].環境科學, 2008, 29(6)∶ 1638-1643.QIN Yujie, ZHOU Shaoqi, ZHU Mingshi.Microecology of the anaerobic ammonium oxidation reactor[J].Environmental Science, 2008, 29(6)∶ 1638-1643.
[23]Kartal B, Rattray J, van Niftrik L A, et al.Candidatus“anammoxoglobus propionicus” a new propionate oxidizing species of anaerobic ammonium oxidizing bacteria[J].Syst Appl Microbiol, 2007, 30(1)∶ 39-49.
[24]Schmid M, Twachtmann U, Klein M, et al.Molecular evidence for genus level diversity of bacteria capable of catalyzing anaerobic ammonium oxidation[J].Syst Appl Microbiol, 2000,23(1)∶ 93-106.

