微生物絮凝劑MBFGA1的結構鑒定及絮凝機理研究
張媛媛,楊朝暉*,曾光明,汪理科,黃 兢,魏淑梅,馮 婧 (1.湖南大學環境科學與工程學院,湖南 長沙 410082;2.湖南大學環境生物與控制教育部重點實驗室,湖南 長沙 410082)
絮凝法廣泛應用于水處理領域,絮凝劑的研究開發對于水處理具有重要意義.其中,微生物絮凝劑(MBF)具有易降解、無二次污染、高效安全、適應范圍廣等優點[1-2],越來越受國內外研究者的重視[3-7].對微生物絮凝劑分子結構進行鑒定可以為優化絮凝條件、探討絮凝機理及實現工業化生產提供理論基礎[8-9],是微生物絮凝劑研究的一個重要方面.目前,在微生物絮凝劑分子結構的研究中,多數直接將微生物發酵液提取物默認為微生物絮凝劑的活性成分而作為分子結構研究的對象,而少有對發酵液剩余物質絮凝活性進行分析的報道[10-11].為了更準確地確定微生物絮凝劑分子結構鑒定的對象及分析其絮凝機理,作者對一株產絮凝劑的多粘類芽孢桿菌(菌株編號GA1)的發酵液、發酵液提取粗產品、發酵液提取剩余物以及粗產品純化后的精產品的絮凝活性進行分析,在確定該絮凝劑核心有效成分的基礎上,對其進行分子結構鑒定及絮凝機理分析.
MBFGA1是菌株GA1所產的高效微生物絮凝劑,前期研究已證明該絮凝劑對多種廢水均有較好的絮凝效果[12],具備工業化生產的潛力[13],有較好的實際應用前景.本研究著力于MBFGA1的性質及分子結構鑒定,以期為MBFGA1的推廣應用提供理論基礎.
1 材料與方法
1.1 實驗菌種
所用菌種菌株編號GA1,經16S rDNA序列(GenBank序列登陸號DQ166375)分析鑒定為多粘類芽孢桿菌,命名為 Paenibacillus polymyxa GA1[14].
1.2 絮凝劑提取與純化[15]
將GA1發酵液4000r/min離心30min,加入2倍體積預冷丙酮(-24℃),于 4℃冰箱中靜置待析出物穩定,離心分離后干燥,得到 MBFGA1粗產品,呈淡黃褐色,與發酵液顏色相似;將粗產品溶于水,加入Sevage試劑(氯仿與正丁醇按5:1配制)充分振蕩,離心后取上清液,濃縮后進行冷凍干燥得 MBFGA1精產品,呈淺黃色;粗提后的發酵液經旋轉蒸發除去丙酮,得到粗提剩余物.
1.3 絮凝劑有效成分鑒定
以對高嶺土的絮凝率為指標檢驗發酵液、粗提剩余物、10g/L粗產品溶液以及10g/L精產品溶液的絮凝活性.測定方法:取50mL 3g/L的高嶺土溶液,調節pH至8,加入2mL 10g/L的CaCl2溶液作為助凝劑,搖勻 3s,加入 0.4mL絮凝劑(對照試驗為等量蒸餾水),迅速搖勻持續 15s,靜置30min測定上清液D550.絮凝率計算公式[16]:

式中:FR為絮凝率;a為樣品實驗中上清液的D550;b為對照實驗中上清液的D550.
1.4 MBFGA1性質成分鑒定[17]
使用紫外可見分光光度計和傅里葉變換紅外光譜分析儀(varian,USA)對 MBFGA1精產品基本性質、特征鍵及分子結構進行分析鑒定;采用苯酚-硫酸法對糖含量進行測定;采用考馬斯亮藍法對蛋白質含量進行測定;使用zeta電位儀(malvern,British)對溶液zeta電位進行測定.
1.5 MBFGA1凝膠過濾層析[18]
經兩次凝膠層析對MBFGA1精產品進行分離純化.一次層析:層析柱規格 40cm×2.5cm,層析介質 Sephadex G-50(Pharmacia,USA),洗脫液0.9%的 NaCl溶液,洗脫速度 0.6mL/min;二次層析:層析柱規格100cm×1.6cm,層析介質Sephadex G-100 (Pharmacia,USA),同樣條件對一次層析后的樣品進行分離.洗脫樣品的收集使用部分收集器,接樣時間 10min/管,測定收集樣品的糖含量(以 D485為表征),以管數為 x軸,D485為 y軸繪制層析出峰圖,收集糖峰透析,干燥后做下一步處理.
1.6 表面形態分析
使用環境掃描電鏡(FEI,Netherland)分別對MBFGA1粗產品、精產品以及層析后產品的表面形態進行分析.
1.7 分子量測定
采用高效液相色譜法對MBFGA1精產品各組分進行分子量測定:使用高效液相色譜儀(Agilent,USA)對樣品進行分析,Ultrahydrogel 2000和 500兩根多糖專用凝膠色譜柱串聯(300mm×7.8mm,排阻限分別為 7×106D 和 4×105D),以0.1mol/L的NaNO3溶液為流動相,示差折光檢測器(RID)檢測.分子量標準物質為pullulan多糖.
1.8 單糖組成分析
采用氣相色譜法對MBFGA1精產品各組分進行單糖組成分析:先對多糖樣品進行糖基衍生化,之后使用氣相色譜儀(島津,日本)對衍生化樣品進行分析,5%OV-225/AW-DMCS-Chromo-sorb W玻璃填充柱(3mm×2.5m),柱溫210℃,氫焰離子法(FID)檢測.
2 結果和討論
2.1 絮凝劑活性成分鑒定
從溶液表觀看,發酵液、粗提剩余物、MBFGA1粗產品溶液及MBFGA1精產品溶液透光率依次增大,掛壁現象逐漸減弱,黏度降低[19],其中精產品溶液為澄清溶液.各溶液對高嶺土溶液的絮凝率見表1.

表1 各溶液對高嶺土溶液絮凝率的對比Table 1 Comparison of kaolin flocculating rate
由表1可知,除粗提剩余物外,另外3種溶液對高嶺土均有較高的絮凝率,說明發酵液的丙酮粗提物是MBFGA1的有效成分;在提取物中,精產品溶液為成分更單一的澄清溶液,而與粗產品溶液相比絮凝率降低不大,說明精產品為 MBFGA1的核心有效成分.本研究中以 MBFGA1精產品為微生物絮凝劑的結構鑒定的主要對象.
對比發酵液、粗產品溶液和精產品溶液絮凝率可得,隨著絮凝劑純化的推進絮凝效果呈下降趨勢,其中發酵液絮凝活性最大,精產品溶液絮凝活性最低.推測原因:發酵液是微生物代謝過程形成的混合物膠體,不僅含有培養基中殘留的物質,也有生物代謝中產生的如磷酸鹽[20]等有助于絮凝的物質;而提取物溶液組成相對單一,所以絮凝效果低于發酵液.據此同時可得MBFGA1投入實際應用時,直接使用發酵液即可達到高絮凝效果、低成本的目的.
2.2 性質成分鑒定
MBFGA1精產品的全波長掃描結果為一條平滑曲線,260nm和 280nm附近均沒有吸收峰,說明精產品中不含核酸和蛋白質.同時,實驗測定其中糖含量達 99%以上,可得絮凝劑MBFGA1精產品為多糖類物質.此外,精產品溶液zeta電位為-25.9,說明絮凝劑表面帶負電荷,原因可能是分子表面帶有較多的負電基團,負電基團之間相互作用使得絮凝劑在水中處于一個較穩定的狀態.
2.3 表面形態及元素組成分析
MBFGA1電鏡掃描照片如圖1所示.由圖1可見,MBFGA1呈現疏松、交聯的網狀多孔結構.從a到c隨著純化的推進,樣品表面愈加細膩,脈絡更加清晰,孔與孔連接益加緊密,孔隙密度越來越大,鏈與鏈的交聯愈加明顯,說明 MBFGA1為線性長鏈分子結構,且帶有支鏈,長鏈之間交聯成網絡,最終形成圖中所示構型.同時,干燥的MBFGA1具有極強的韌性,不易研磨為粉末,也證實了其線性長鏈分子結構.

圖1 不同處理階段下的MBFGA1的掃描電鏡照片(×1000)Fig.1 Scan electron microanalysis of MBFGA1(×1000)
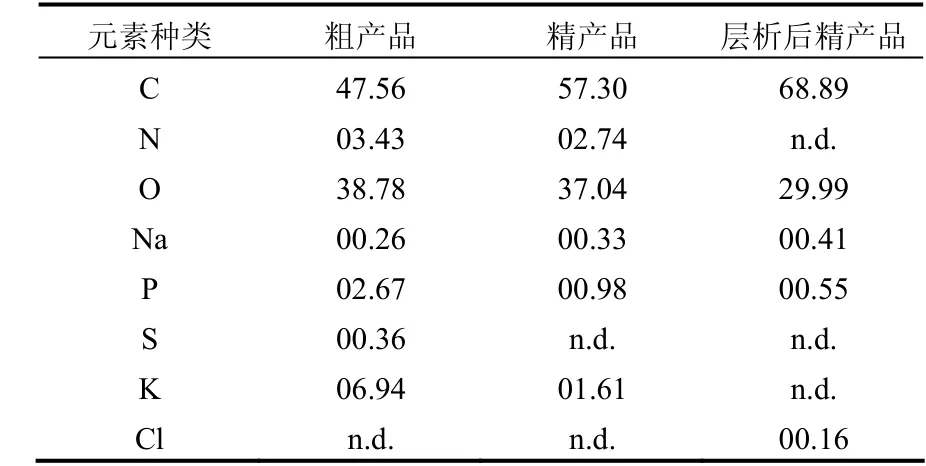
表2 MBFGA1的元素分析 (%)Table 2 Elementary analysis of MBFGA1 (%)
對MBFGA1粗產品、精產品以及層析后的精產品進行能譜掃描以對其元素組成進行分析,分析結果見表 2.隨著純化的推進,樣品中 N、S含量明顯降低,可認為精產品中所含雜質,或者部分支鏈上的小分子物質與主鏈分離而被去除;此外,層析后精產品中所含元素(除H外)主要有C、O、Na、P、Cl,其中 Na、Cl增加是由于洗脫液殘留,故其中主要含有 C、H、O,也可佐證MBFGA1絮凝劑主鏈成分為多糖.
2.4 凝膠過濾層析
MBFGA1的凝膠過濾層析結果見圖 2.從一次層析圖可看出:一次層析樣品洗脫液中的糖含量只形成 1個主峰,即在一次層析的層析條件下絮凝劑顯示為單一組分物質.根據凝膠過濾層析原理,收集此峰做下一步處理即可排除層析中雜峰(即雜質)對主峰的干擾,使樣品得到純化.
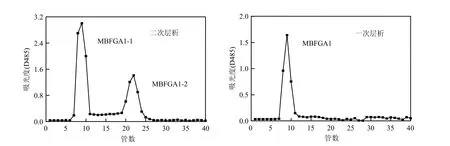
圖2 MBFGA1的凝膠過濾層析Fig.2 Gel chromatography filter graph of MBFGA1
二次層析圖顯示,MBFGA1在二次層析中形成了2個主峰,說明絮凝劑中包含2種分子量不同的組分;分別收集兩組分,經低溫(<40℃)旋轉蒸發濃縮、透析以及冷凍真空干燥,得到絮凝劑中的兩組分,分別記為MBFGA1-1和MBFGA1-2.在MBFGA1精產品中二者含量比約為3:1.
2.5 分子量測定
MBFGA1的高效液相色譜(HPLC)如圖3所示.其中,MBFGA1-1的HPLC圖示差檢測部分有3個峰,保留時間分別為27.136,36.469,46.915min,其中 46.915min為溶劑峰,27.136,36.469min為MBFGA1-1中的兩組分,確定MBFGA1-1為非均一多糖,兩峰面積對比可知后者僅在 MBFGA1-1中占極小一部分.利用GPC軟件計算得兩峰對應分子量分別為 1.18×106D 和 5.01×104D.由于5.01×104組分含量極低,可將MBFGA1-1分子量視為 1.18×106D.
MBFGA1-2的HPLC圖示差檢測部分有2個峰,保留時間分別為 26.724,27.576min,其中27.576min為溶劑峰,故MBFGA1-2為均一多糖.計算得 26.724min所對應組分的分子量為3.08×103D,即 MBFGA1-2 分子量為 3.08×103D.
2.6 單糖組分測定
MBFGA1的氣相色譜(GC)如圖4所示,由于各批實驗條件不同,單糖標準品保留時間略有差別.單糖標準品GC出峰圖中:0.8min是溶劑氯仿峰,從4.542min開始往后的6個峰分別為鼠李糖,阿拉伯 糖,木糖,甘露糖,半乳糖,葡萄糖,其余是雜質峰.
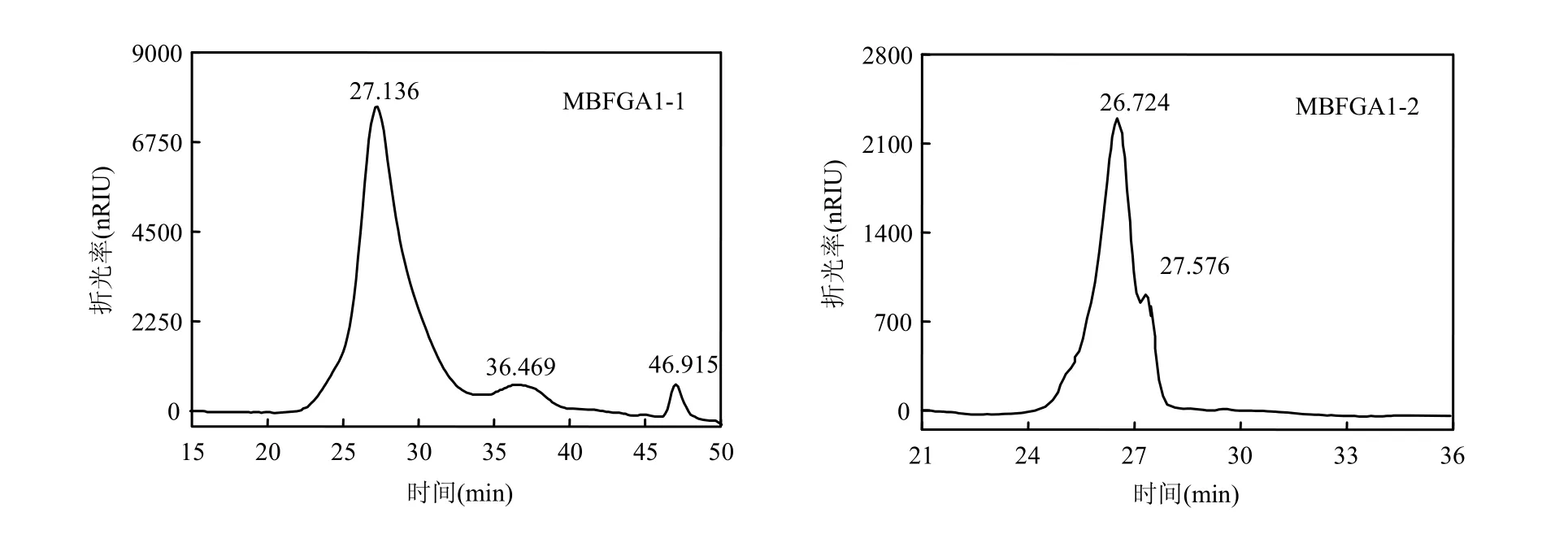
圖3 MBFGA1-1和MBFGA1-2的HPLC圖Fig.3 HPLC graphs of MBFGA1-1 and MBFGA1-2
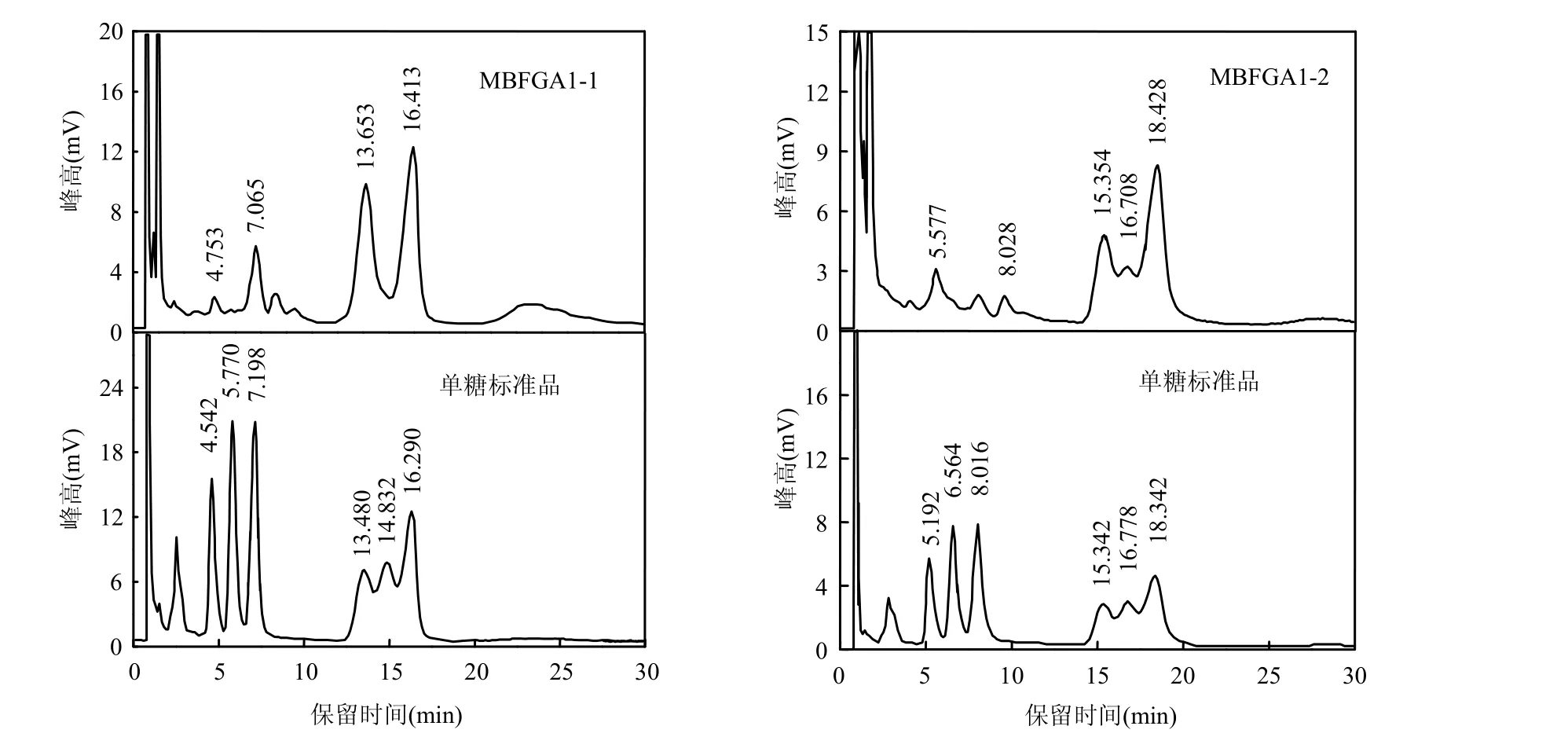
圖4 MBFGA1-1和MBFGA1-2的GC圖Fig.4 GC graphs of MBFGA1-1 and MBFGA1-2
其中,MBFGA1-1的GC圖中共有4個糖基峰,4.753,7.065,13.653,16.413min依次為鼠李糖,木糖,甘露糖,葡萄糖,其余峰為雜質峰,即MBFGA1-1含有4種糖基.根據各單糖峰面積計算主要糖基物質的量比:其中木糖,甘露糖,葡萄糖三者的物質的量比為0.3:1:1.09,而鼠李糖含量太少未算入比例.
MBFGA1-2的 GC圖中共有 5個糖基峰,5.577,8.028,15.354,16.708,18.428min依次為鼠李糖,木糖,甘露糖,半乳糖,葡萄糖,五者的物質的量比為0.68:0.28:1.82:1:3.73.
2.7 紅外光譜分析
為確保絮凝劑在處理過程中不改變自身的基本結構,維持原有性質,對 MBFGA1及其所包含的兩組分MBFGA1-1和MBFGA1-2均做了紅外光譜分析,如圖5所示.
由圖 5可見,三者主要吸收峰的位置和強度均相近,可得三者分子內所含的特征鍵基本一致;此外 MBFGA1中還包含了 MBFGA1-1和MBFGA1-2中的特有峰,如 3911,483,984cm-1.推測MBFGA1-1和MBFGA1-2在生物體內的形成過程一致,或者二者原本就共屬于同一多糖主鏈(即MBFGA1主鏈),由于之間連接的鍵較弱在處理過程中斷開而顯示為2種不同分子量的物質.

圖5 MBFGA1、MBFGA1-1和MBFGA1-2紅外光譜Fig.5 Fourier transform-infrared spectra of MBFGA1、MBFGA1-1 and MBFGA1-2
3440cm-1附近寬而強的吸收峰為形成氫鍵的多締合—OH強吸收峰,為典型的O—H伸縮振動;3212,3117cm-1兩個弱吸收峰(重疊為一寬峰)為殘糖基上—CH3和—CH2的C—H的伸縮振動吸收峰;2050cm-1處亦為 C—H吸收峰;1640,1400cm-1分別為—COO—反對稱和對稱伸縮振動,可能為開鏈式糖基所含;1100cm-1處寬峰為吡喃環中醚鍵—C—O—C—(甲氧基)伸縮振動和彎曲振動疊加引起;850cm-1是 α-吡喃型糖苷鍵;620cm-1為=C—H吸收峰,即烯烴C—H鍵吸收峰.
MBFGA1及MBFGA1-1和MBFGA1-2分子中都含有 α-吡喃型糖苷鍵,說明分子基本骨架結構一致;羥基、羧基、甲氧基等極性基團大量存在,容易和顆粒表面的離子結合而形成吸附;此外,多締合羥基之間形成氫鍵,使絮凝劑溶解度增大,分子鏈充分伸展,便于架橋形成,而發生絮凝.結合絮凝劑的zeta電位值,進一步證實了分子內極性基團的存在.
3 MBFGA1絮凝機理探討
與其他多糖類絮凝劑相似,MBFGA1較大的分子量和分子內所含的羥基、羧基等極性基團是其具有較強絮凝性的主要原因.有研究證明,絮凝劑分子能在顆粒表面產生吸附是絮凝發生的首要條件[21].MBFGA1分子量達1.18×106D,具有足夠的范德華力來克服顆粒間的靜電斥力而形成吸附;此外,MBFGA1分子不同鏈節上的羧基、羥基,可以與顆粒表面帶有的H+、OH-等以氫鍵形式發生吸附,羧基、甲氧基等極性基團易于與顆粒表面的 Ca2+或者其他重金屬離子等以化學鍵結合,使溶液的 zeta電位降低,溶液脫穩,形成吸附;而顆粒與絮體間的靜電力也能使之相互靠近,產生吸附作用[22].
此外,絮凝劑分子在水中的伸展狀態直接影響絮凝劑架橋的發生,一般認為絮凝劑分子鏈充分伸展呈柔性線狀時,有利于絮凝[21].MBFGA1是微生物分泌存在于發酵液中的天然多糖,糖環有多個羥基,溶于水形成氫鍵,保證了其較好的水溶性;同時糖環結構及其他基團的空間相互作用也使分子鏈不易彎曲.隨著多糖分子量增加,糖環數的增多將導致溶解度降低,而分子中存在的羧基等極性基團又增加了水溶性,利于分子鏈在水中伸展,增加了分子鏈的有效長度,為膠體粒子的吸附提供足夠的空間位點;未被吸附的鏈節則成為自由末端或疏松的鏈環而與其他分子相互架橋,形成絮體.MBFGA1絮凝機理如圖6所示.

圖6 MBFGA1絮凝機理示意Fig.6 Proposed flocculating mechanism for MBFGA1
4 結論
4.1 MBFGA1精產品為該微生物絮凝劑的核心有效成分,為多糖類物質,由環狀單糖以α-型糖苷鍵結合成多糖主鏈,其他小分子物質與主鏈結合形成支鏈,共同構建為線性長鏈分子結構;分子內含有羥基,羧基,甲氧基等有利于絮凝的基團.
4.2 MBFGA1精產品中包含 MBFGA1-1和MBFGA1-2兩種分子量不同的組分,三者分子基本結構相似,其中分子量較大的 MBFGA1-1占75%以上,MBFGA1-2僅占25%.
4.3 MBFGA1-1為非均一多糖,分子量分別為1.18×106D 和 5.01×104D(含量極低,忽略不計),主要糖基組成為木糖,甘露糖和葡萄糖(另含少量鼠李糖),物質的量比為 0.3:1:1.09,構成MBFGA1-1的基本骨架.
4.4 MBFGA1-2為均一多糖,分子量3.08×103D,糖基組成為鼠李糖,木糖,甘露糖,半乳糖,葡萄糖,五者的物質的量比為 0.68:0.28:1.82:1:3.73,構成MBFGA1-2的基本骨架.
4.5 MBFGA1絮凝機理主要為吸附架橋,絮凝劑分子主要靠范德華力、氫鍵和化學鍵吸附膠體顆粒;分子內所含的氫鍵和極性基團使MBFGA1分子能夠充分伸展,有效發揮吸附架橋作用.
[1]Vijayaraghavan K, Yun Yeoung-Sang.Bacterial biosorbents and biosorption [J].Biotechnology Advances, 2008,26:266-291.
[2]Prado Héctor J, Matulewicz María C, Bonelli Pablo R, et al.Potential use of a novel modif i ed seaweed polysaccharide as fl occulating agent [J].Desalination, 2011,281:100-104.
[3]Badireddy Appala R, Chellam Shankararaman, Gassman Paul L,et al.Role of extracellular polymeric substances in biof l occulation of activated sludge microorganisms under glucose-controlled conditions [J].Water Research, 2010,44:4505-4516.
[4]Lee Andrew K, Lewis David M, Ashman Peter J.Microbial flocculation, a potentially low-cost harvesting technique for marine microalgae for the production of biodiesel [J].J.Appl.Phycol., 2009,21:559-567.
[5]Zhang Zhi-qiang, Xia Si-qing, Zhang Jiao.Enhanced dewatering of waste sludge with microbial fl occulant TJ-F1 as a novel conditioner [J].Water Research, 2010,44:3087-3092.
[6]郭俊元,楊春平,邱國良.生物絮凝劑與改性沸石復配處理豬場廢水厭氧消化液的響應面優化 [J].中國環境科學, 2012,32(11):1999-2005.
[7]Sena Gautam, Ghosha Sandipta, Jha Usha, et al.Hydrolyzed polyacrylamide grafted carboxymethylstarch (Hyd.CMS-g-PAM):An eff i cient fl occulant for the treatment of textile industry waste water [J].Chemical Engineering Journal, 2011,171:495-501.
[8]Li Qiang, Liu Hong-lei, Qi Qing-sheng.Isolation and characterization of temperature and alkaline stable bioflocculant from Agrobacterium sp.M-503 [J].New Biotechnology, 2010,27:789-794.
[9]Ho Y C, Norli I, Alkarkhi Abbas F M, et al.Characterization of biopolymeric fl occulant(pectin) and organic synthetic fl occulant(PAM): A comparative study on treatment and optimization in kaolin suspension [J].Bioresource Technology, 2010,101:1166-1174.
[10]Wu Jane-Yii, Ye Hsiu-Feng.Characterization and fl occulating properties of an Extracellular biopolymer produced from a Bacillus subtilis DYU1 isolate [J].Process Biochemistry, 2007,42:1114-1123.
[11]黎 忠,張修玉,秦建橋,等.微生物絮凝劑ZS-7的純化及其結構特征研究 [J].環境科學, 2010,31(9):2184-2190.
[12]阮 敏,楊朝暉,曾光明,等.多粘類芽孢桿菌GA1所產絮凝劑的絮凝性能研究及機理探討 [J].環境科學, 2007,28(10):2336-2341.
[13]周長勝,楊朝暉,曾光明,等.絮凝劑產生菌GA1的營養優化及發酵動力學 [J].中國環境科學, 2008,28(4):324-328.
[14]楊朝暉,陶 然,曾光明,等.多粘類芽孢桿菌GA1產絮凝劑的培養基和分段培養工藝 [J].環境科學, 2006,27(7):1444-1449.
[15]郭振楚.糖類化學 [M].北京:化學工業出版社, 2005:40-72.
[16]Lee S H, Lee S O, Jang K L, et al.Microbial flocculant from Arcuadendron sp.TS-49 [J].Biotechnology Letters, 1995,17(1):95-100.
[17]榮國斌(譯).波譜數據表—有機化合物的結構解析 [M].上海:華東理工大學出版社, 2002.
[18]張惟杰.糖復合物生化技術研究 [M].2版.杭州:浙江大學出版社, 1999.
[19]任 鯤,胡秋平,高金森,等.疏水締合聚丙烯酰胺溶液掛壁與粘度的關系 [J].石油煉制與化工, 2005,36(11):59-62.
[20]熊麗娟,楊朝暉,曾光明,等.培養基中磷酸鹽在GA1所產絮凝劑絮凝中的作用研究 [J].環境科學學報, 2007,27(7):1157-1162.
[21]鄭懷禮.生物絮凝劑與絮凝技術 [M].北京:化學工業出版社,2004:34-75.
[22]Sharp Emma L, Jarvis Peter, Parsons Simon A, et al.The impact of zeta potential on the physical properties of ferric-NOM flocs[J].Environmental Science Technology, 2006,40(12):3934-3940.

