EGCG對糖尿病腎病模型大鼠腎小管間質性損害的治療作用及機制
馬祖等
(廣州醫學院附屬沙井醫院,廣東深圳518104)
糖尿病腎病是糖尿病微血管病變的并發癥,也是糖尿病患者最常見的死亡原因之一。30%~45%的2型糖尿病患者可發展為糖尿病腎病[1]。近年來人們認識到糖尿病腎小管病變是糖尿病腎病發生、發展的獨立因素[2],糖尿病狀態下腎小管病變的程度與蛋白尿排泄量和腎功能進行性下降密切相關并直接影響預后。(-)-Epigallocatechin 3-O-Gallate(EGCG)具有強大的抗氧化應激作用,其作用是維生素C的100倍、維生素E的25倍。EGCG對毒物、藥物等誘導的肝損害模型的抗氧化應激、纖維化作用已有多篇報道[3~5],但其對腎臟疾病的作用鮮有報道。2012年6~10月,我們觀察了EGCG對糖尿病腎病模型腎小管間質性病變的干預作用,現報告如下。
1 材料與方法
1.1 材料 健康雄性8~10周Wistar大鼠60只,體質量210~230 g,平均219 g,由南華大學動物實驗室提供[許可證號:SYXK(湘)2010-0006]。EGCG購自江西綠康天然產物有限公司。鏈脲佐菌素(STZ)購自Sigma公司。VEGF抗體(單克隆兔抗鼠抗體)、TGF-β1抗體(多克隆抗體)、RAGE 抗體(多克隆抗體)購自Santa Cruz生物技術公司。
1.2 實驗方法
1.2.1 模型制作及分組 參照郭嘯華等[6]以及李莉等[7]的制模方法,60只大鼠高糖高脂飼料(含豬油10%,蔗糖20%,膽固醇2.5,膽酸鈉1%,基礎飼料66.5%)喂養4周。取16只作為正常對照組(對照組),另44只制作糖尿病腎病模型:大鼠禁食12 h(不禁飲),一次性腹腔注射STZ 30 mg/kg(溶解于0.01 mol/L 枸椽酸緩沖液中,pH 4.5),同時腹腔注射50%葡萄糖5 mL。對照組腹腔內注射等量枸緣酸緩沖液。注射后48 h尾靜脈采血,采用血糖儀測定全血血糖(BG),BG>16.7 mmol/L為糖尿病模型制作成功。本研究制作成功糖尿病腎病模型共39只。
1.2.2 干預方法 參照張孝林等[8]的干預方法將39只模型大鼠隨機分為模型組及治療組,均皮下注射甘精胰島素2 U,每日1次,對照組皮下注射等量生理鹽水。三組均予高蛋白(酪蛋白20%,基礎飼料80%)飼喂。參照鄭子新等[9]方法,治療組每日以EGCE 1 g溶于生理鹽水10 mL中,每天分2次灌胃;對照組、模型組同樣方法予等量生理鹽水灌胃。保證入選大鼠足量飲水。
1.2.3 觀察指標 干預第12周測定各組血糖、糖化血紅蛋白(HbA1c)、Cr、BUN及尿 β2微球蛋白(β2-MG)及尿微量蛋白(ULA);ELISA法測定血清TGF-β1水平;熒光分光光度法測定血清血管收縮素轉換酶(AGEs)水平;取腎組織行病理檢查,免疫組化或免疫熒光法測定腎小管間質組織TGF-β1、晚期糖基化終產物受體(RAGE)、VEGF表達。
1.3 統計學方法 采用SPSS11.5統計軟件。計量資料比較采用One-Way ANOVA檢驗,組間比較采用t檢驗。對觀察組與治療組觀察指標行Post Hoc檢驗。P≤0.05為差異有統計學意義。
2 結果
2.1 觀察指標 各組觀察指標檢測結果見表1。ANOVA分析見表2,由表2可見,三組各項指標之間均存在顯著差異,特別是AGEs、ULA、血糖、TGF-β1差異更明顯。模型組與治療組觀察指標間的Post Hoc檢驗結果見表3,由表3可見,治療組與模型組各指標間均存在顯著差異,以 AGEs、BUN、ULA更為顯著。2.2 腎組織病理檢查 ①HE染色:見圖1。由圖1可見,與治療組比較,模型組腎小球、腎小管結構損害以及腎小管間質細胞數量減少更為明顯,炎癥細胞浸潤更為明顯。②PAS染色:見圖2。由圖2可見,模型組腎小球、腎小管結構損害明顯重于治療組,腎小球基底膜、腎小管基膜損害亦明顯重于治療組。
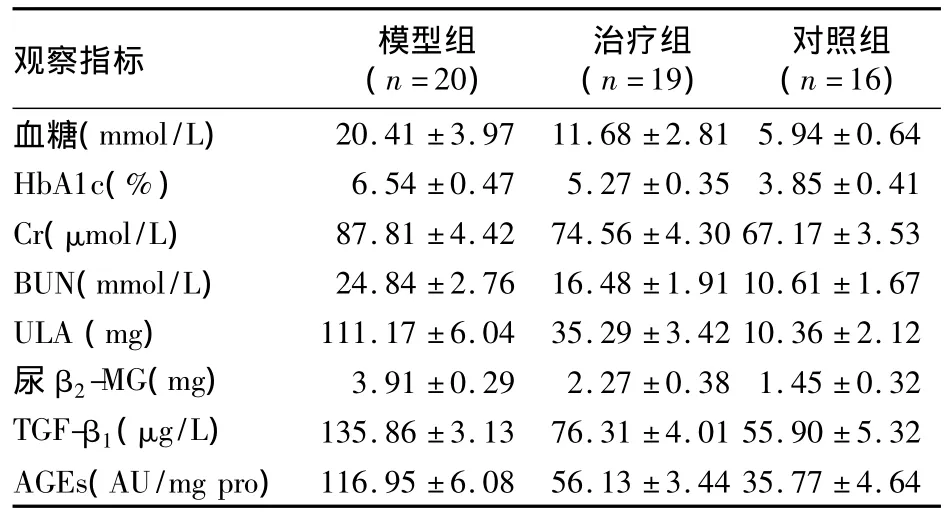
表1 各組觀察指標檢測結果(ˉx±s)

表2 各組觀察指標ANOVA分析

表3 模型組與治療組觀察指標的Post Hoc檢驗結果
2.3 腎組織TGF-β1表達 見圖3。由圖3可見,模型組腎小管間質損害明顯重于治療組。
2.4 腎組織RAGE表達 見圖4。由圖4可見,模型組腎小管間質表達明顯重于治療組。
2.5 腎組織VEGF表達 見圖5。由圖5可見,模型組腎小管間質表達明顯重于治療組。
3 討論
腎臟小管間質包括腎小管上皮細胞、血管和間質成分,占腎臟體積的90%以上。病變初期表現為腎小管基底膜增厚、小管數目增加及小管肥大,后期發生腎小管萎縮及間質纖維化。腎間質纖維化是所有慢性腎臟疾病進行性發展的重要病理基礎,比腎小球硬化更能反映腎臟受損傷的程度。

圖1 腎臟病理變化(HE染色)

圖2 腎臟病理變化(PAS染色)
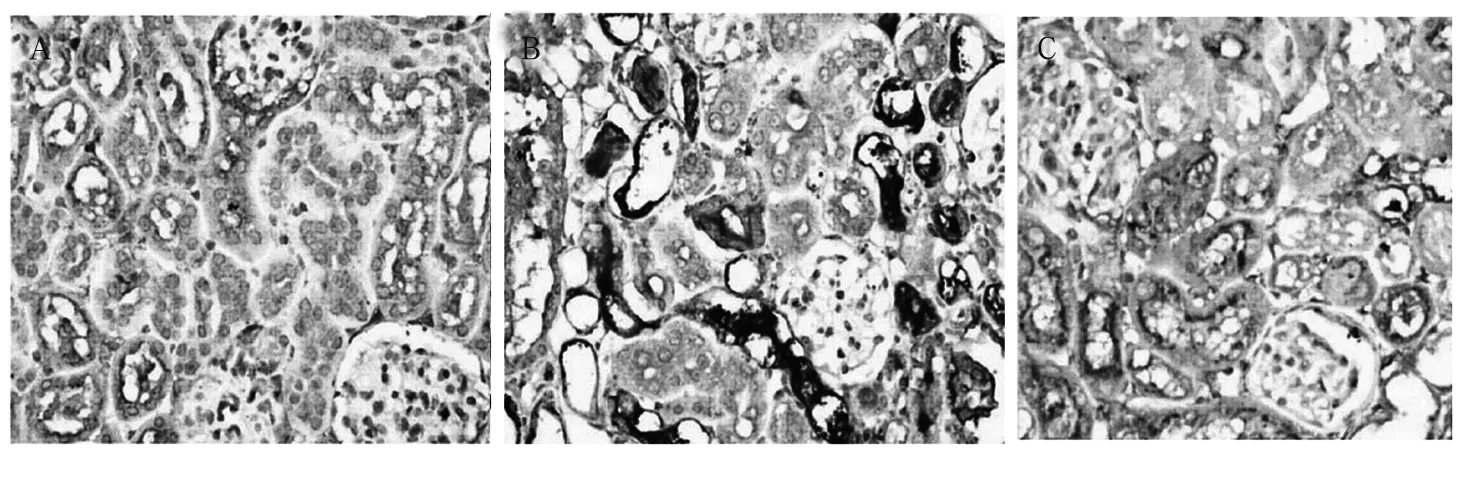
圖3 腎組織TGF-β1表達(免疫組化法)

圖4 腎組織RAGE表達(免疫組化法)

圖5 腎組織VEGF表達(免疫熒光法)
本研究腎臟病理檢查顯示實驗第12周大鼠糖尿病腎病造模成功。腎組織HE染色顯示B、C組大鼠腎小球結構異常改變,特別是B組大鼠不僅腎小球結構異常更為明顯,腎小管上皮細胞減少、炎癥細胞浸潤也更為嚴重。腎組織PAS染色顯示,腎小球、腎小管結構性損害,基底膜破壞。特別是B組,病變明顯較C組加重。實驗數據顯示,B組BG、HbA1c明顯高于C組。反映腎功能和腎臟損害的指標Cr、BUN、ULA、β2-MG B組也明顯高于C組。
AGEs與腎組織中的RAGE結合而激活第二信號系統,產生大量的細胞因子包括 TGF-α、PDGF、IL-1等,激活核轉錄因子NF-κB進而轉錄靶基因(如內皮縮血管肽、血管細胞黏附分子等),參與糖尿病血管并發癥的發生與發展,對腎小球及小管間質造成不可逆轉的損傷[10]。本研究結果顯示,C組血AGEs水平低于B組,腎組織中RAGE表達亦明顯低于B組。
VEGF通過改變腎小管上皮細胞結構與功能、增加上皮細胞通透性、促進細胞外基質(ECM)等作用參與糖尿病腎病進展[11,12]。糖尿病腎病早期時血清VEGF顯著升高,血清VEGF與尿白蛋白排泄率之間呈明顯正相關,在糖尿病腎病的發生、發展,尤其是尿蛋白的形成中起重要作用。本研究腎組織免疫熒光顯示,B組腎小管以及間質VEGF表達明顯高于C組。TGF-β1是一種強力致纖維化因子,其重要的作用是調節細胞外基質的形成,使腎細胞等合成膠原蛋白、纖維連接蛋白、蛋白多糖增加從而促進細胞肥大、細胞外基質增多,結果導致腎小球、小管間質硬化纖維化。氧化應激、VEGF、MCP-1等多種因素能促進TGF-β1合成和表達。本研究結果顯示,C組血TGF-β1明顯低于B組,TGF-β1在腎組織中表達也明顯低于B組。
糖尿病腎病的發生與多種因素有關,氧化應激在糖尿病腎病的發生、發展過程中無疑起重要作用。已經證實,糖基化終產物是糖尿病腎病的主要發生因素之一[13],減少糖基化終產物能延緩糖尿病腎病的發生和發展[14]。EGCG可能是通過抗氧化應激、抗炎等作用減少大鼠氧化應激產物AGEs-RAGE及VEGF、MCP-1等炎性介質的產生并直接或間接影響TGF-β1的表達實現保護腎臟、延緩腎病進展。
[1]賈俊亞、林珊.糖尿病腎病患者血管鈣化的臨床病理特征及防治進展[J].中華內科雜志,2012,51(5):407-409.
[2]賈汝漢,高蘋.糖尿病腎病腎小管間質病變研究進展[J].中國中西醫結合腎病雜志,2005,6(6):311-313.
[3]Yao K,Ye PP,Zhang L,et al.Epigallocatechin gallate protects against oxidative stress-induced mitochondria-dependent apoptosis in human lens epithelial cells[J].Mol Vision,2008,14(1):217-223.
[4]Intra J,Kuo SM.Physiological levels of tea catechins increase cellular lipid antioxidant activity of vitamin C and vitamin E in human intestinal caco-2 cells[J].Chem Biol Interact,2007,169(2):91-99.
[5]Maet K,Nomura W,Takutsme Y,et al.Green Tea Polyphenols Function as Prooxidants To Activate Oxidative-Stress-Responsive Transcription Factors in Yeasts[J].App Envirn Microbiol,2007,73(2):572-580.
[6]郭嘯華,劉志紅,李恒,等.高糖高脂飲食誘導的2型糖尿病大鼠模型及其腎病特點[J].中國糖尿病雜志,2002,10(5):290-294.
[7]李莉,陳光亮,韓茹,等.多次低劑量鏈脲佐菌素誘導大鼠糖尿病模型的方法學研究[J].安徽醫藥,2012,16(7):888-890.
[8]張孝林,朱華慶.胰島素對糖尿病模型大鼠腎臟病肌球蛋白輕鏈激酶表達的影響[J].中國藥理學通報,2005,21(11):1407-1408.
[9]鄭子新,宋瑞霞,邱繼紅,等.綠茶提取物的安全性分析評價[J].中國公共衛生,2005,21(5):583-584.
[10]陳永對.糖尿病腎病與糖基化終產物受體基因相關性的研究[J].中國中西醫結合腎病雜志,2005,6(12):742-744.
[11]黃頌敏,陳澤君,楊亦彬,等.血管生成素及其受體血管內皮生長因子與糖尿病腎臟微血管病變的關系[J].中華腎臟病雜志,2006,22(9):521-527.
[12]畢春花,王艷.血管內皮生長因子和內抑素在STZ大鼠腎臟中的表達及意義[J].中國中西醫結合腎病雜志,2008,9(4):335-339.
[13]Katerina K,Stejkalová A,Hertlova M,et al.Haplotype a nalysis of the RAGE gene:identification of a haplotype marker for diabetic nephropathy in type 2 diabetes mellitus[J].Nephrol Dial Transplant,2005,20(3):1093-1102.
[14]Sourris KC,Harcourt BE,Penfdd SA,et al.Modulation of the cellar expression of circulating advanced glycation end-product receptors in type 2 diabetic nephropathy[J].Experimental Diabetes Research,2010,2010(10):1-9.

