馬鹿角蛋白酶解物的抗氧化、抗疲勞和免疫活性
侯 瀟,高 建,李春雨,王 錚,金莉莉,王秋雨*
(遼寧大學生命科學院,遼寧 沈陽 110036)
馬鹿茸、馬鹿骨為可用于保健食品的生物資源。馬鹿角為已骨化的鹿茸或鋸茸后翌年春季脫落的角基,具有溫腎陽、強筋骨、行血消腫的功效[1]。馬鹿角膠為馬鹿角煎熬而成的膠塊,主要成分是蛋白質,含量為83.81%[2],有補腎陽、益精血和抗疲勞及增強機體免疫能力的作用[3-4]。馬鹿角膠的蛋白質分子質量大,難以透過生物膜,生物利用度低,通過化學、物理或酶解方法,降低蛋白質分子質量,可提高蛋白質的吸收率和保健功能[5]。據報道[2]鹿角膠經中性蛋白酶水解后能顯著提高正常雄性大鼠血清中睪酮水平,提高了鹿角蛋白的功能。大豆蛋白、牛乳酪蛋白、雞蛋清等通過酶法水解制備的多肽具有良好的免疫活性[6]。
為提高馬鹿角的生物利用率和生理藥理活性,本實驗組在前期工作中研究了馬鹿角蛋白的提取和最佳酶解工藝[7]。馬鹿角粉碎后,經80~90℃水浸法提取蛋白,3000r/min離心除去不溶物,上清液經濃縮干燥得到馬鹿角蛋白。采用1kD超濾膜截留未酶解的蛋白,經濃縮、冷凍干燥得到白色粉末狀的馬鹿角蛋白酶解物。酶解物易溶于水,多肽含量99%,Tricine-SDS-PAGE鑒定分子質量小于3kD。采用BCA試劑盒測定馬鹿角蛋白和酶解物的蛋白含量。本實驗研究該酶解物的抗氧化、抗疲勞和免疫活性,并與未水解的馬鹿角蛋白進行比較,以期為馬鹿角蛋白的精深加工和高效利用提供參考。
1 材料與方法
1.1 動物、材料與試劑
體質量為28~30g的30日齡、清潔級昆明小鼠100只,雌雄各半,購自遼寧中醫藥大學實驗動物部。
馬鹿角購于鐵嶺西豐鹿產品交易中心;馬鹿角蛋白及酶解物在本實驗室制備得到[7]。
丙二醛(MDA)檢測試劑盒、超氧化物歧化酶(SOD)檢測試劑盒 南京建成生物工程研究所;刀豆蛋白A (ConA) 美國Sigma公司;香菇多糖 浙江普洛康裕天然藥物有限公司;其他試劑均為分析純。
1.2 方法
1.2.1 體外抗氧化活性的測定
將VC配制成質量濃度分別為0.1、0.2、0.4、0.6、0.8mg/mL的溶液,將馬鹿角蛋白和馬鹿角酶解物分別稀釋成10、20、30、40、50mg/mL的溶液。作為待測液備用。
清除O2-·活性的測定采用鄰苯三酚自氧化法;清除·OH活性的測定采用水楊酸法;總還原力的測定采用鐵氰化鉀法[8-10]。
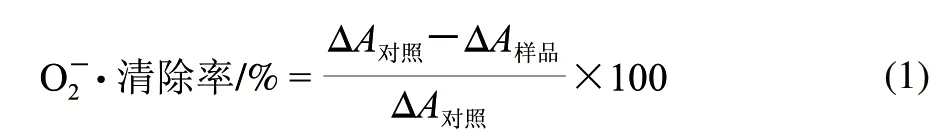
式中:ΔA對照為對照組鄰苯三酚自氧化時吸光度每分鐘變化量;ΔA樣品為樣品組鄰苯三酚自氧化時吸光度每分鐘變化量。
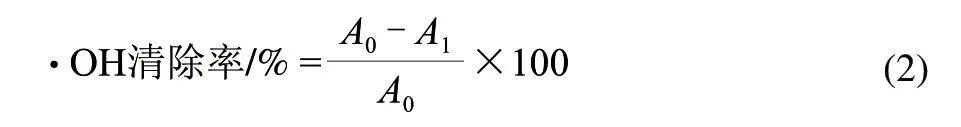
式中:A0為對照組的吸光度;A1為樣品組的吸光度。
1.2.2 體內抗氧化活性的測定
30只昆明小鼠,隨機分為3組:空白對照組(同體積生理鹽水)、馬鹿角蛋白組(500mg/(kg·d))、馬鹿角蛋白酶解物組(500mg/(kg·d))。實驗組蛋白和酶解物灌胃劑量參考海參肽功能研究使用劑量[11]。連續灌胃30d后,摘眼球取血,1500r/min離心取血清,檢測馬鹿角蛋白酶解前后對血清中SOD活性和MDA含量的影響。具體操作按試劑盒說明書進行[12]。
1.2.3 抗疲勞活性研究
30只昆明小鼠隨機分為3組:空白對照組(同體積生理鹽水)、馬鹿角蛋白組(500mg/(kg·d))、馬鹿角蛋白酶解物組(500mg/(kg·d))。連續灌胃給藥30d后進行負重游泳、肝糖原、血乳酸3項指標的測定。負重游泳實驗:在末次灌胃后30min后,將小鼠的尾部負荷5%體質量的鉛皮然后放入水深30cm、水溫(25±1)℃的游泳箱中游泳,記錄小鼠力竭游泳時間,即從入水至沉入水下10s不能浮出水面的時間[13]。血乳酸測定:小鼠于末次給予受試物30min后,在水深30cm、水溫30℃的游泳箱中不負重游泳10min后,眼球采血測定血清血乳酸含量[14]。肝糖原測定:小鼠于末次給予受試物30min后,30℃水箱中游泳10min,頸椎脫臼處死,取肝臟100mg,用蒽酮法測定肝糖原含量[15]。
1.2.4 免疫活性研究
40只昆明小鼠隨機分為4組:空白對照組(同體積生理鹽水)、陽性香菇多糖組(145mg/(kg·d))、馬鹿角蛋白組(500mg/(kg·d))、馬鹿角蛋白酶解物組(500mg/(kg·d))。連續灌胃給藥30d后進行小鼠碳廓清率和淋巴細胞轉化指標的測定[11,16]。
1.2.4.1 小鼠碳廓清率測定
小鼠連續給藥30d,按10mL/kg尾靜脈注射稀釋4倍的印度墨汁,注射后開始計時,分別于2、10min時眼眶取血20μL,立即置于盛有2mL 0.1% Na2CO3溶液的試管中。在波長600nm處測其光密度OD1和OD2,測其吞噬指數α,以表示碳廓清率。
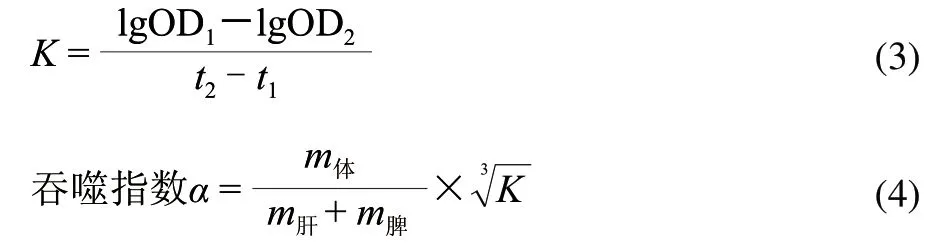
式中:t1、OD1為給墨汁后第一次取血的時間及所測OD值;t2、OD2為給墨汁后第二次取血的時間及所測OD值。
1.2.4.2 ConA誘導小鼠脾淋巴細胞轉化實驗
小鼠連續給藥30d后, 脫頸處死,75%酒精浸泡消毒3min后無菌取脾,將脾磨碎,200目篩網過濾,Hanks液清洗2次,每次洗后1000r/min離心10min,制備單細胞懸液,用RPMI1640培養液調整細胞濃度為3×106個/mL,臺酚蘭染色應使活細胞數量在95%以上。將一份脾細胞懸液分兩孔加入24孔板,每孔1mL,一孔加75μL ConA,另一孔對照,培養68h時每孔吸去0.7mL上清液,加入0.7mL不含血清培養液,同時每孔加入5mg/mL MTT 50μL,繼續培養4h。結束后加入1mL酸性異丙醇吹打混勻。測每一份脾細胞懸液在570nm波長處的OD值,脾淋巴細胞增殖能力用OD實驗組與OD對照組的差值表示。
1.2.5 數據統計
采用SPSS17.0軟件進行單因素方差分析。
2 結果與分析
2.1 馬鹿角蛋白酶解物的體外抗氧化能力

圖 1 馬鹿角蛋白和馬鹿角蛋白酶解物的O2-·清除能力(n=3)Fig.1 Comparison of superoxide anion radical scavenging activity between red deer antler protein and hydrolysate(n=3)
由圖1可知,馬鹿角蛋白酶解物對O2-·的清除能力明顯高于同等質量濃度的馬鹿角蛋白,隨著測試質量濃度的增加而增大。馬鹿角蛋白的半清除質量濃度(IC50)為45.57mg/mL,而馬鹿角酶解物IC50為10.59mg/mL。陽性照組VC的IC50為0.42mg/mL。
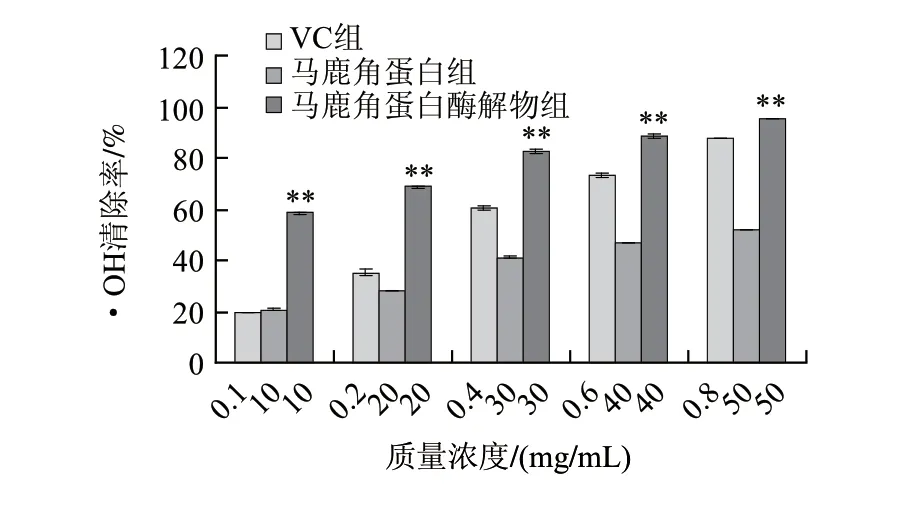
圖 2 馬鹿角蛋白和馬鹿角蛋白酶解物的·OH清除能力(n=3)Fig.2 Comparison of hydroxyl radical scavenging activity between red deer antler protein and hydrolysate (n=3)
由圖2可知,馬鹿角蛋白酶解物對·OH的清除能力與同等質量濃度的馬鹿角蛋白相比,差異極顯著,隨著質量濃度的增加,其清除能力呈增大的趨勢。馬鹿角蛋白的半清除質量濃度(IC50)為45.20mg/mL,而酶解物的IC50為7.63mg/mL。陽性對照組VC的IC50為0.28mg/mL。
由圖3可知,馬鹿角蛋白和酶解物均具有還原能力,且隨著質量濃度增加而增大。同等質量濃度的馬鹿角蛋白酶解物的還原力高于馬鹿角蛋白,統計結果顯示兩者差異極顯著。
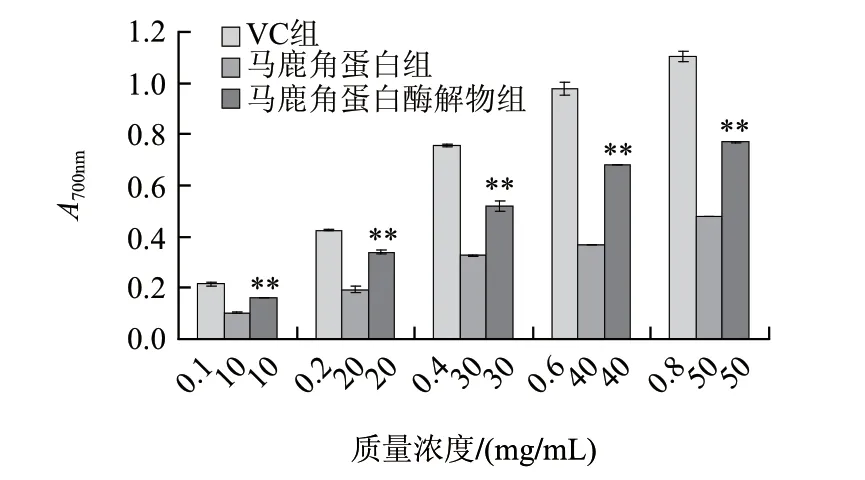
圖 3 馬鹿角蛋白和馬鹿角蛋白酶解物的總還原能力(n=3)Fig.3 Comparison of total reducing power between red deer antler protein and hydrolysate (n=3)
2.2 馬鹿角蛋白酶解物的體內抗氧化能力
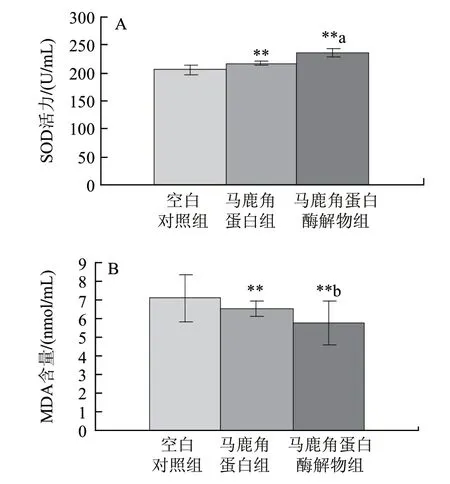
圖 4 馬鹿角蛋白和馬鹿角蛋白酶解物對小鼠血清中SOD(A)、MDA(B)的影響(n=10)Fig.4 Comparative effects of red deer antler protein and hydrolysate on serum SOD activity (A) and MDA content (B) in mice (n=10)
由圖4可知,飼喂馬鹿角蛋白組、馬鹿角蛋白酶解物組的小鼠SOD活性和MDA含量與空白對照組相比均有極顯著差異性,顯示抗氧化功能顯著,且酶解物組SOD的活性和MDA的減少量均好于馬鹿角蛋白組,并具有顯著性差異。
2.3 馬鹿角蛋白酶解物的抗疲勞活性
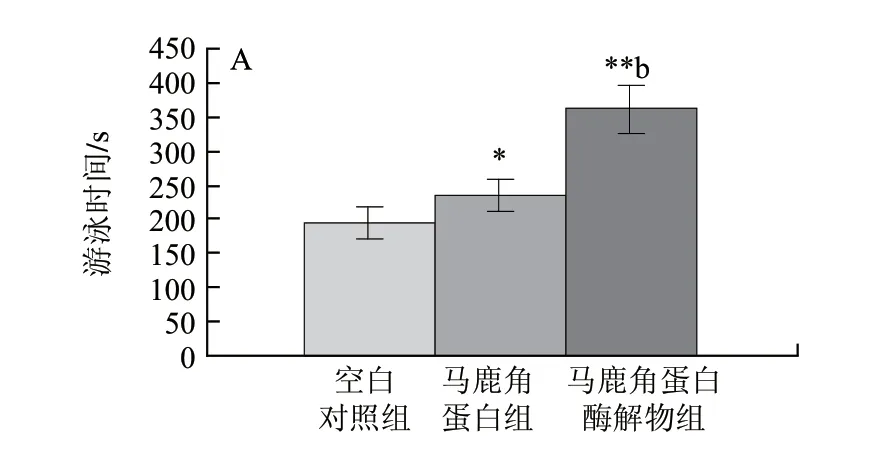
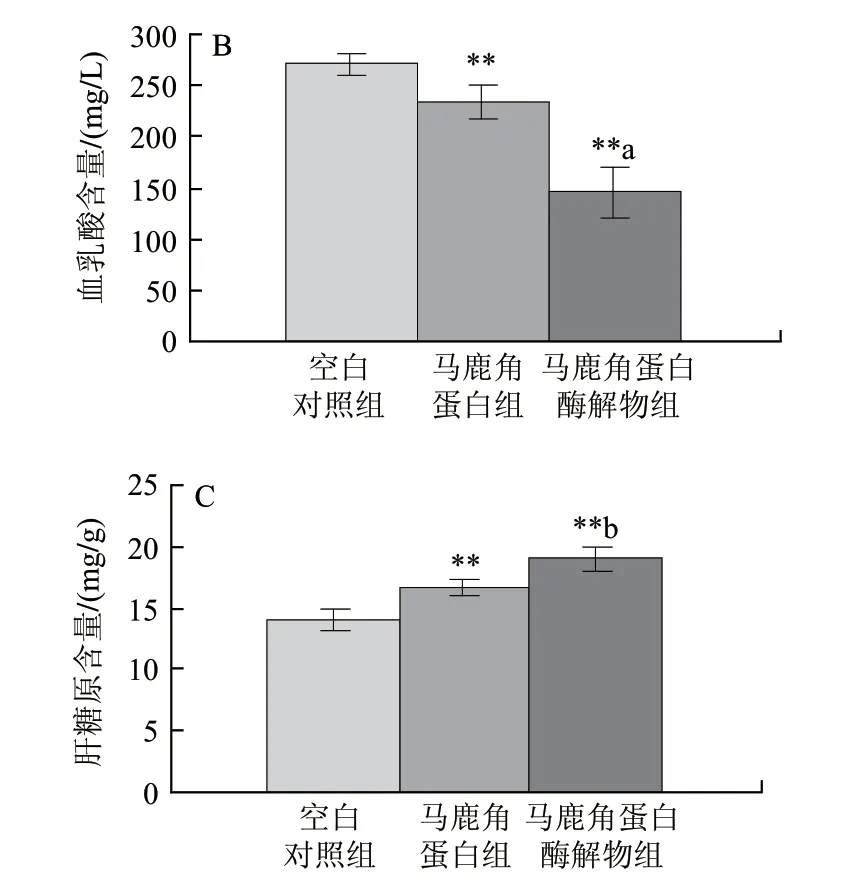
圖 5 馬鹿角蛋白及馬鹿角蛋白酶解物對小鼠負重游泳時間(A)、血乳酸含量(B)和肝糖原含量(C)的影響(n=10)Fig.5 Comparative effects of red deer antler protein and hydrolysate on weight-loaded swimming time (A) and blood lactic acid (B) and liver glycogen contents (C) in mice(n=10)
由圖5可知,與空白對照組相比,馬鹿角蛋白組和酶解物組的小鼠游泳時間延長,乳酸含量降低,肝糖原含量增加,均有顯著性或極顯著性差異,酶解物的抗疲勞活性更強。
2.4 馬鹿角蛋白酶解物的免疫活性

圖 6 馬鹿角蛋白和馬鹿角蛋白酶解物對小鼠碳廓清吞噬指數α(A)和脾淋巴細胞增殖能力(B)的影響(n=10)Fig.6 Comparative effects of red deer antler protein and hydrolysate on carbon clearance index (A) and lymphocyte proliferation (B) in mice (n=10)
由圖6可知,馬鹿角蛋白和馬鹿角蛋白酶解物能提高小鼠碳廓清吞噬指數α和脾淋巴細胞增殖能力,與空白對照組比較差異極顯著,且馬鹿角蛋白酶解物組活性高于馬鹿角蛋白組,具有顯著性差異。
3 討 論
O2-·和·OH是生物體內主要的活性氧自由基,它們可以引起體內脂質過氧化。而使用生物抗氧化劑切斷過氧化鏈式反應,可以抑制機體的自由基損傷,從而保持最佳健康狀態和防治相關疾病,延緩衰老[17-18]。SOD對機體的氧化與抗氧化平衡起著至關重要的作用,可專一性清除O2-·,保護細胞免受損傷,MDA含量可以間接反映出機體脂質過氧化的程度[19]。本研究通過對以上指標的檢測,顯示馬鹿角蛋白及其酶解物具有清除O2-·、·OH的能力和總還原力,可提高受試小鼠血清SOD活力并降低MDA含量,與空白對照組相比差異顯著,且酶解物組活性高于未酶解的馬鹿角蛋白。研究結果表明馬鹿角蛋白酶解物具有顯著的抗氧化活性。
在抗疲勞實驗中,本實驗選擇測定了受試小鼠負重游泳時間、能量物質肝糖原和代謝產物血乳酸三項指標。各指標在運動時的變化程度與運動負荷強度一致的條件下,可作為動物疲勞的評價指標[20]。力竭游泳時間的長短可以反應受試動物運動抗疲勞的能力[21],疲勞發生的早晚與糖原的儲備直接相關,乳酸作為肌肉活動的主要代謝產物,可以通過肌肉乳酸的含量來評價疲勞的程度[22]。持續運動后血乳酸的數值越低,表明疲勞消除越快。通過對以上指標進行實驗測定,表明馬鹿角蛋白及其酶解物具有抗疲勞功效,與空白對照組比較差異顯著,馬鹿角蛋白酶解物的抗疲勞作用更強。
巨噬細胞是機體內生物學作用最為活躍的細胞,具有吞噬、殺傷及消化病原體、殺傷腫瘤細胞,并在特異性免疫應答中參與抗原的提呈及免疫調節作用[23]。淋巴細胞是體內免疫活性細胞,淋巴細胞增殖能力的強弱,反應機體免疫功能的高低[24]。本實驗通過對碳廓清吞噬指數研究表明:馬鹿角蛋白及其酶解物對單核巨噬細胞吞噬功能具有明顯的促進作用,能提高小鼠對血中碳粒膠體廓清速度,酶解物組的作用更為明顯;用ConA誘導小鼠脾淋巴細胞轉化,馬鹿角蛋白及其酶解物的促淋巴細胞增殖能力與空白對照組相比較具有顯著差異性,后者的作用更明顯。
[1] 邱芳萍, 馬波, 王志兵, 等. 鹿角盤蛋白的分離純化與活性研究[J]. 長春工業大學學報, 2007, 28(3): 144-147.
[2] 劉姍娟. 鹿角膠酶解工藝及其產物性能研究[D]. 武漢: 武漢理工大學, 2008.
[3] 蘇鳳艷, 李慧萍, 王艷梅, 等. 鹿花盤蛋白質的提取與生物活性測定[J]. 動物科學與動物醫學, 2001, 18(2): 18-20.
[4] 范玉琳, 邢增濤, 衛功慶, 等. 鹿茸蛋白的提取分離及其抗腫瘤活性[J]. 經濟動物學報, 1998, 2(1): 27-31.
[5] HETTIARACHCHY N S, ZIEGLER G R. Protein functionality in food systems[M]. New York: CRC Press, 1994: 261-310.
[6] 柴華, 趙謀明, 王金水. 食品蛋白質酶解改性提高功能特性的研究進展[J]. 食品工業科技, 2008(1): 286-288.
[7] 高健, 李強, 呂磊, 等. 馬鹿角蛋白酶解工藝研究[J]. 特產研究, 2012, 34(2): 12-16.
[8] 田京偉, 楊建. 白藜醇苷體外抗氧化活性[J]. 中草藥, 2001, 32(10): 978-980.
[9] 朱字旌, 張勇, 王純剛, 等. 紅三葉黃酮抗氧化性研究[J]. 食品科技, 2006(4): 78-81.
[10] 莫開菊, 柳圣, 程超. 生姜黃酮的抗氧化活性研究[J]. 食品科學, 2006, 27(9): 110-115.
[11] 盧連華, 周景洋, 顏燕, 等. 海參肽對小鼠免疫調節及抗疲勞能力的影響[J]. 山東醫藥, 2009, 49(25): 35-37.
[12] 牛嗣云, 龐曉靜, 陳龍, 等. 松花粉對亞急性衰老模型大鼠抗衰老作用的實驗研究[J]. 中國老年學雜志, 2007, 25(12): 1506-1508.
[13] 張永娟, 呂學軍, 張大勇. 泥蚶總蛋白抗疲勞作用研究[J]. 食品研究與開發, 2010, 31(8): 183-185.
[14] 彭維兵, 何秋霞, 劉可春, 等. 花生肽對小鼠抗運動性疲勞的實驗研究[J]. 山東科學, 2011, 24(5): 35-38.
[15] 楊帆, 王瑩, 蔡東聯, 等. 人參螞蟻藥酒對小鼠的抗疲勞作用[J]. 氨基酸和生物資源, 2011, 38(1): 1-3.
[16] 李永進, 楊睿悅, 扈學俸, 等. 火麻仁蛋白對小鼠抗疲勞和免疫調節功能的初步研究[J]. 衛生研究, 2008, 37(2): 175-178.
[l7] WILLCOX J K, ASH S L, CATIGNANI G L. Antioxidants and prevention of chronic disease[J]. Crit Rev Food Sci Nutr, 2004, 44(4): 275-295.
[18] 武瑞, 劉文, 王爽, 等. 中西復方乳劑對子宮內膜炎奶牛血清NO、SA、MDA 含量及SOD、NOS活性影響[J]. 中獸醫醫藥雜志, 2008, 27(2): 7-9.
[19] 王亞東, 王海玉, 李立, 等. 五加皮酒抗疲勞作用的實驗研究[J]. 中國衛生檢驗雜志, 2009, 19(6): 1404-1405.
[20] 田振軍, 石磊, 劉小杰, 等. 過度訓練對大鼠血清CK、LDH、SOD、SDH活性及UMb含量影響的研究[J]. 中國運動醫學雜志, 2000, 19(1): 49-50.
[21] 伊佳, 嵇揚, 劉俊, 等. 枳椇子水提物抗疲勞作用及機制的實驗研究[J]. 中藥材, 2009, 32(6): 962-965.
[22] ZHANG Xiaorui, ZHOU Wenxia, ZHANG Yongxiang, et al. Macrophages, rather than T and B cells are principal immunostimulatory target cells of Lycium barbarum L. polysaccharide LBPF4-OL[J]. Journal of Ethnopharmacology, 2011, 136(3): 465-472.
[23] 陳棟梁, 劉莉, 于蘭, 等. 白蛋白多肽對核苷的促吸收及增強小鼠細胞免疫功能的作用[J]. 食品科學, 2004, 25(1): 163-166.
[24] 帥學宏, 胡庭俊, 陳炅然, 等. 鬼臼多糖對小鼠免疫功能和抗氧化能力的影響[J]. 畜牧獸醫學報, 2008, 39(7): 1000-1004.

