益生菌對發酵酸乳蛋白的影響
藥 璐,閔偉紅,姜鐵民,陳歷俊,*
(1.吉林農業大學食品科學與工程學院,吉林 長春 130118;2.北京三元食品股份有限公 司,北京 100076)
隨著人們生活水平和健康消費意識的提高,發酵酸乳以其獨特的風味和營養價值日益受到人們的重視。尤其是添加益生菌的發酵乳制品,其無論是在產品特性還是在保健功能上都受到廣泛關注。因此許多產品都利用益生菌與傳統的乳酸菌嗜熱鏈球菌(Streptococcus thermophilus )和保加利亞乳桿菌(Lactobacillus bulgaricus)共同發酵生產酸乳制品[1-3]。
益生菌具有提高免疫力、降低膽固醇、治療風濕病、抗 癌、提高乳糖耐受性、阻止或降低特異性皮炎和局限性回腸炎、治療鏈球菌病、泌尿系統感染等功能[4-6]。這也是消費者喜愛益生菌發酵酸乳的原因,另一方面由于益生菌的發酵分解作用,使酸乳中游離氨基酸、維生素、糖類和礦物質含量高于鮮牛乳[7]。因此益生菌發酵酸乳作為營養性保健食品在世界范圍內迅速發展,其營養功效也非常明顯。由于受蛋白質降解產物如多肽、氨基酸以及氨基酸的代謝產物等的影響,不同菌種發酵酸乳的品質和功能特性也有很大差異[8]。目前國內關于益生菌對發酵酸乳蛋白的影響還未有深入的報道。
本實驗選用目前常用的兩株益生菌:干酪乳桿菌(Lactobacillus casei)和植物乳桿菌(Lactobacillus plantarum)與傳統的乳酸菌共同發酵,以響應面優化后的最優生產工藝條件制備發酵酸乳。通過對比分析探討了益生菌對發酵酸乳蛋白的影響,為研究益生菌在酸乳中的發酵機理提供參考。
1 材料與方法
1.1 菌種與試劑
嗜熱鏈球菌(Streptococcus thermophilus,St)、保加利亞乳桿菌(Lactobacillus bulgaricus,Lb)、干酪乳桿菌(Lactobacillus casei,Lc) 丹尼斯克(中國)有限公司;植物乳桿菌(Lactobacillus plantarum,Lp) 中國工業微生物菌種保藏管理中心;脫脂乳粉 新西蘭進口脫脂乳粉;蛋白Marker 北京全式金生物技術有限公司;十二烷基磺酸鈉(SDS)、巰基乙醇、過硫酸銨、TEMED、Tris堿、游離氨基酸標準品 美國Sigma-Aldrich公司;丙烯酰胺、甲叉雙丙烯酰胺 美國Amresco公司;乙腈、三氟乙酸 美國Thermo Fisher Scientif ic公司;AccQ·TagTMUltra緩沖鹽溶液 美國Waters公司。
1.2 儀器與設備
Mini Protean Ⅱ蛋白電泳儀 美國Bio-Rad公司;UVP GDS-8000凝膠成像儀 上海天能公司;Cintra20紫外-可見光分光光度計 澳大利亞GBC公司;高效液相色譜儀 日本島津公司;超高效液相色譜儀 美國Waters公司;冷凍干燥離心機 德國Sigma公司;PB-10型pH計 賽多利斯科學儀器有限公司。
1.3 方法
1.3.1 酸乳生產工藝
脫脂乳粉120g/L復原→滅菌(110℃,10min)→冷卻→接菌→分裝→發酵→冷藏后熟(4.0℃,24h)→成品。不同菌種的實驗條件如表1所示。

表 1 不同菌種組合發酵酸乳的實驗條件Table 1 Fermentation conditions for yogurt with different strains
1.3.2 樣品的處理
取1mL發酵酸乳樣品,加入所需稀釋倍數的雙蒸水,將發酵樣品配成蛋白質量濃度約2~5mg/mL的溶液,吸取20μL液體,加入等體積的樣品緩沖溶液,沸水浴10min,然后12000r/min離心10min,用于聚丙烯酰胺凝膠電泳的測定。
取適量的發酵酸乳樣品,用手持均質機均質2min,將pH值調至4.6,室溫靜置30min,4500r/min離心30min,上清液(pH4.6可溶性部分)用Whatman硬化 無灰級定量濾紙(NO.42,2.50μm)過濾,濾液保存于-20℃待用,用于氨基氮含量的測定。上清液(pH4.6可溶性部分)用0.22μm的膜過濾,濾液保存于-20℃備用,用于pH4.6可溶性氮的測定。濾液用1.00mol/L NaOH溶液調pH值至8.20~10.00之間,最后用0.22μm的膜過濾后保存于-20℃待用,用于游離氨基酸的分析測定。
1.3.3 SDS-PAGE電泳
SDS-PAGE電泳測定方法參照文獻[9],12%分離膠和4%濃縮膠。采用恒壓電泳,80V預電泳,待樣品進入分離膠后調整電壓為120V。待指示劑溴酚藍前沿到達電泳槽底部時,停止電泳。
1.3.4 氨基氮含量的測定
氨基氮包括游離氨基酸和小肽,采用鄰苯二甲醛(o-phthaldialdehyde,OPA)分光光度法測定12%TCA可溶性組分中氨基氮的含量[10],伯氨基(α-氨基和ε-氨基)與鄰苯二甲醛和β-巰基乙醇反應形成的加合物在340nm有強烈的光吸收。取50μL已過濾的上清液,加入1mL鄰苯二甲醛試劑中,室溫下計時反應 2min,340nm波長處測定吸光度。
鄰苯二甲醛試劑的配制:準確稱取40mg OPA溶解于1.0mL甲醇中,加入100μL β-巰基乙醇、0.95g四硼酸鈉(Na2B4O7·H2O)、0.50gSDS,溶解后定容50mL,現配現用。
氨基酸標準曲線的制作:配制1.0mg/mL亮氨酸溶液,稀釋為質量濃度分別為50、100、200、300、400、500μg/mL的標準溶液系列,按照上述方法測定吸光度,制作標準曲線,計算樣品中氨基氮的含量。
1.3.5 反相高效液相色譜法(RP-HPLC)檢測pH4.6可溶性氮的變化
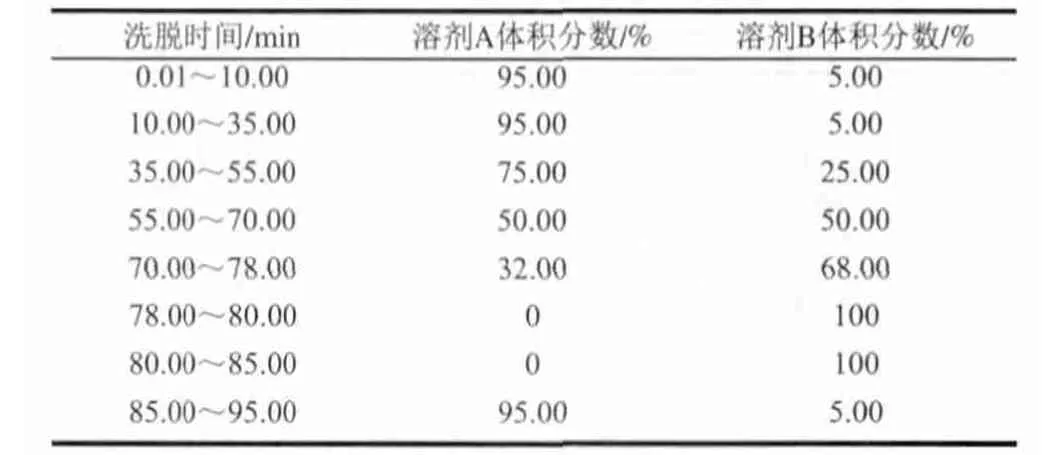
表 2 RP-HPLC梯度洗脫程序Table 2 RP-HPLC Gradient elution procedure
采用Waters公司的RP-HPLC對其進行測定,色譜柱選用Agela Venusil XBP C18(250mm×4.6mm, 孔徑150?,5.0μm粒徑)色譜柱,柱溫35℃;流動相包括溶劑A:0.10%三氟乙酸(TFA)水溶液,溶劑B:0.10%三氟乙酸(TFA)乙腈溶液;流速:0.80mL/min;檢測波長:214nm;進樣量:10μL;梯度洗脫程序如表2所示。
1.3.6 游離氨基酸含量的測定
采用Waters公司的UPLC進行游離氨基酸分析,色譜柱選用ACCQ·TagTMUltra氨基酸色譜柱(2.1mm×100mm)。AccQ·TagTMUltra緩沖鹽溶液配制:取12.50mL的AccQ·TagTMUltra緩沖鹽溶液定容到250mL即可。
用AccQ·TagTMUltra方法進行氨基酸的柱前衍生,具體方法如下。1)將10μL樣品和70μL AccQ-TagTMUltra硼酸鹽緩沖劑添加到完全回收樣品瓶中振蕩數秒,對照組為80μL AccQ-TagTMUltra硼酸鹽緩沖劑。2)加入20μL AccQTagTMUltra試劑,立即渦旋混合幾秒鐘,靜置1min。3)將樣品置于55℃培養箱中保持10min,取出,排氣泡后用于游離氨基酸含量的測定。流動相A:AccQ·TagTMUltra緩沖鹽溶液,流動相B:乙腈。進樣量1μL。梯度洗脫程序及其他儀器參數設置如表3、4。游離氨基酸標準曲線的制作:將2.50μmol/mL的17種氨基酸混標,稀釋到濃度分別為0.02、0.05、0.10、0.20、0.40、0.80μmol/mL的標準溶液系列,按照上述梯度洗脫程序進行測定,制作標準曲線。
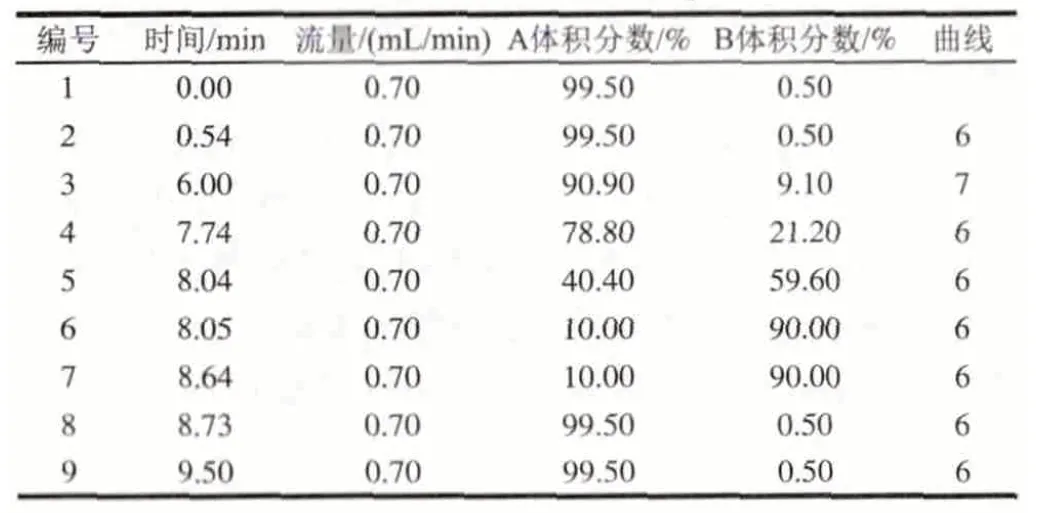
表 3 UPLC梯度洗脫程序Table 3 UPLC Gradient elution procedure
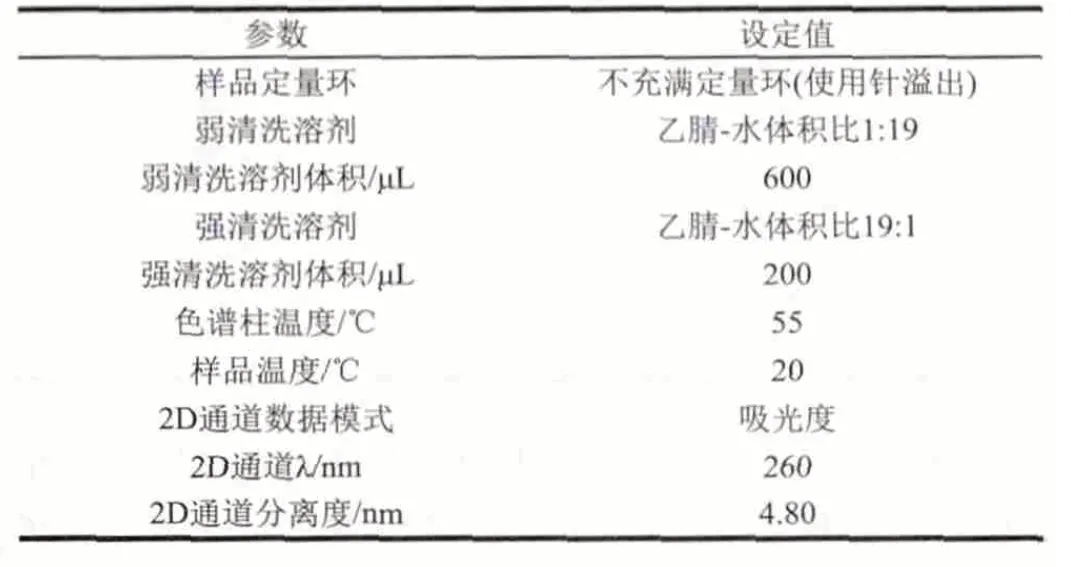
表 4 樣品管理器、溶劑管理器及PDA檢測器參數Table 4 Parameters of sample manager, solvent manager and PDA detector
2 結果與分析
2.1 酸乳樣品蛋白的變化
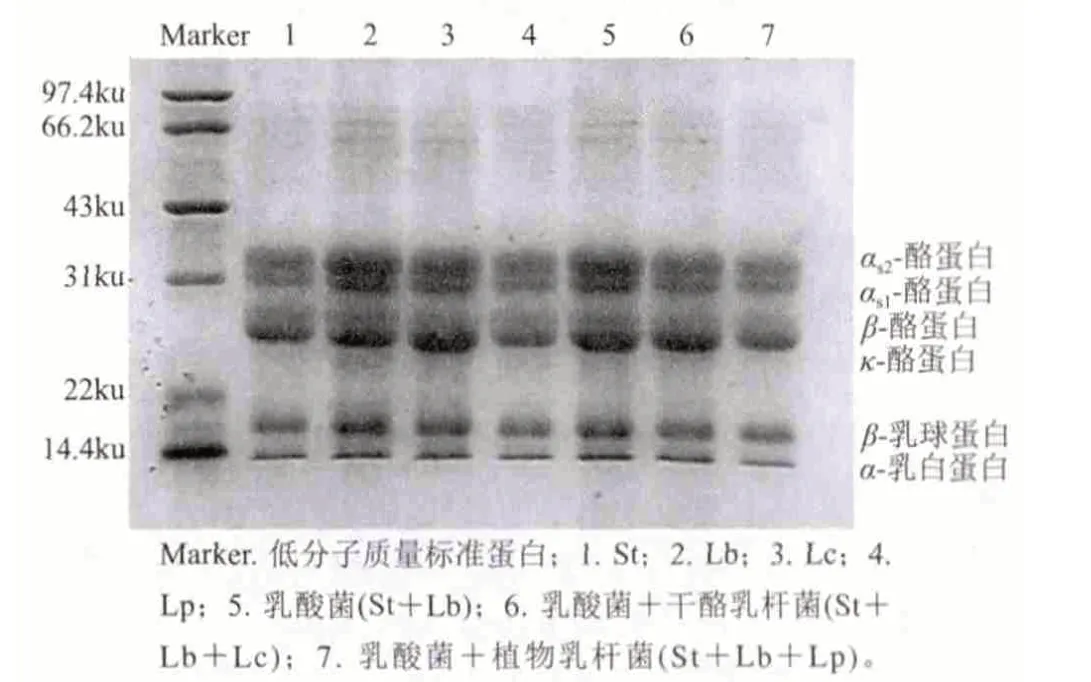
圖 1 酸乳樣品稀釋6倍電泳圖Fig.1 SDS-PAGE of 6-fold diluted yogurt samples
SDS-PAGE電泳方法具有重復性高、線性關系良好等優點,普遍用于分離分子質量為20~100ku之間的蛋白質。由圖1可知,當酸乳樣品稀釋6倍時,大分子蛋白分離效果較好,而且從電泳圖可以明顯的看出無論是單菌種St、Lb、Lc、Lp發酵酸乳,還是混合菌種發酵酸乳St+Lb、St+Lb+Lc、St+Lb+Lp,其大分子蛋白種類都沒有變化,但同時也可以看到與普通乳酸菌發酵酸乳的條帶相比,添加益生菌的發酵酸乳中的αs2酪蛋白、αs1酪蛋白和β-乳球蛋白條帶比較淺,其中St+Lb+Lp發酵酸乳所形成的條帶最淺。其蛋白質含量的降低主要是由于發酵劑中蛋白酶將蛋白質逐步降解成多肽、小肽及氨基酸導致,且由于兩株益生菌在酸乳發酵過程中代謝活性不同而導致對蛋白質的降解程度有所不同。
2.2 氨基氮含量的變化
12%TCA中的主要成分是中肽、小肽(具有2~20個氨基酸殘基)以及少量的氨基酸[11]。它主要是由發酵劑含有的凝乳酶和肽酶共同作用而產生的。在酸乳發酵后期,乳酸菌釋放出的蛋白酶進一步降解蛋白質生產小肽和氨基酸,其中氨基酸對酸乳風味的形成起著很重要的作用[12]。
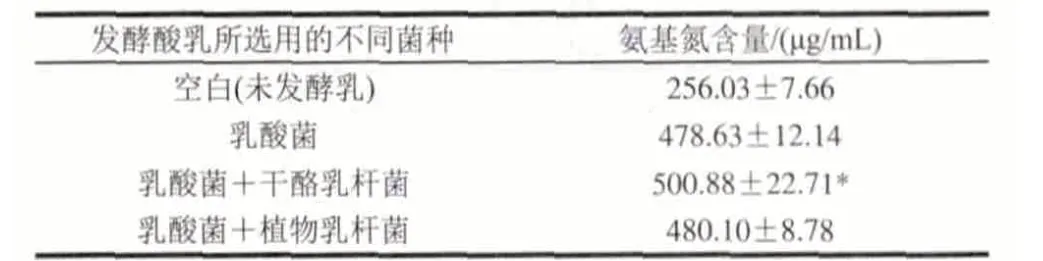
表 5 不同菌種發酵酸乳的氨基氮含量Table 5 Contents of amino nitrogen in yogurt samples fermented by different strains
由表5可知,添加益生菌的發酵酸乳與普通乳酸菌發酵酸乳相比,氨基氮含量有了一定程度的升高,其中添加干酪乳桿菌的酸乳其氨基氮含量有顯著增加(P<0.05),達到500.88μg/mL,比乳酸菌酸乳高出4.65%;添加植物乳桿菌的酸乳其氨基氮含量比乳酸菌酸乳高出0.31%。這主要是由于益生菌含有的蛋白酶對多肽產生作用,使其進一步降解為小肽和氨基酸所造成的[13]。
2.3 pH4.6可溶性氮的變化
pH4.6可溶性氮是指多肽類,陳歷俊等[7]研究發現,當pH4.6時酪蛋白沉淀,乳清蛋白和蛋白胨對可溶性氮的貢獻很小,因此認為pH4.6可溶性氮主要是由于乳酶的作用產生的。但隨著發酵、成熟時間的延長,它們便主要由發酵劑中蛋白酶降解蛋白質所產生[14]。
RP-HPLC主要用于分子質量低于5000u,尤其是1000u以下的非極性小分子多肽的分離和純化[15-16],因其具有分離效果好、分辨率高、重復性好、分析速度快等優點,在多肽的分離純化和制備中得到廣泛應用[17]。目前國外就有報道稱發酵乳品中存在由乳酸菌的發酵作用而產生的多肽類物質[18]。
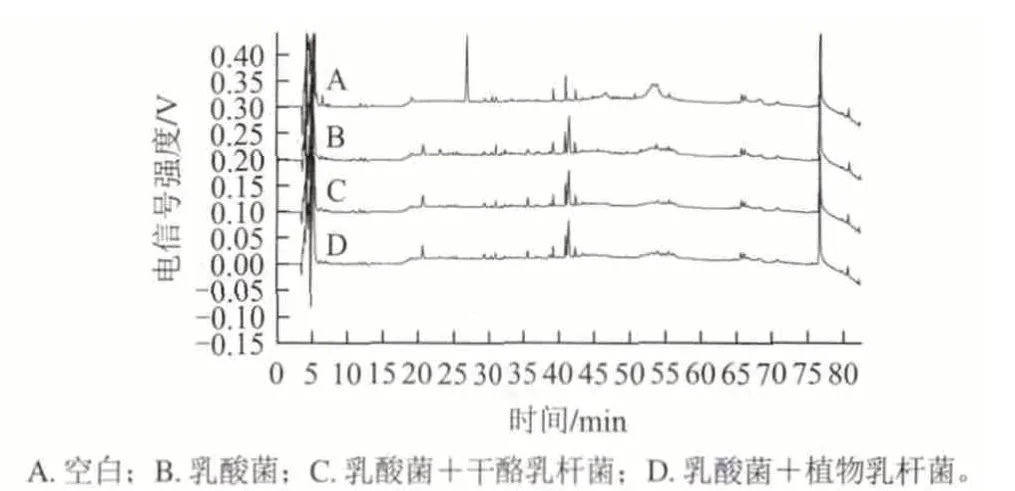
圖 2 pH4.6-SN高效液相色譜分析圖Fig.2 HPLC analysis of pH4.6-SN in yogurt samples fermented by different strains
由圖2可以看出,與乳酸菌發酵酸乳相比,無論是添加干酪乳桿菌還是植物乳桿菌發酵的酸乳,多肽的種類并沒有增加,只是部分多肽含量發生了一些變化。當出峰時間為26.943min時,可以明顯看到空白樣品中有一個比較大的峰,而添加菌種之后的發酵酸乳,此峰不明顯甚至消失,說明發酵菌種對酸乳中的此段多肽進行了降解。當出峰時間在20~32min時,可以明顯看到添加益生菌的酸乳中多肽含量明顯比乳酸菌發酵酸乳的少很多,這可能是由于益生菌將多肽降解為更小的肽段所造成的。總之,添加益生菌的酸乳色譜圖與乳酸菌發酵酸乳的色譜圖趨勢基本一致,說明在酸乳發酵過程中,乳酸菌仍然起主要作用,益生菌只是改變了部分多肽的含量。
2.4 游離氨基酸含量的變化
采用17種游離氨基酸標準樣品的峰面積與濃度作標準曲線如表6所示。在酸乳發酵過程中,發酵劑中含有的蛋白酶能降解酸乳中的蛋白質,形成胨、肽、氨基酸等,所產生的一些小肽和氨基酸是酸乳主要風味物質的前體,而氨基酸代謝產生的揮發性物質有助于酸乳形成最終優良的感官品質[19]。Beshkova等[20]對酸奶發酵過程的研究表明,牛奶凝結(發酵4.50h)后,牛奶總氨基酸的70%將以游離氨基酸的形式釋放到酸奶中,這是影響酸奶制品風味和質地的重要組成成分。另外研究表明,在混合菌株發酵中,菌株間的共生作用也必須有適量的氨基酸以促進菌株的生長。乳桿菌可產生大量的游離氨基酸,作為氮源,促進乳球菌的生長,其余的則游離于酸乳中[21]。其中Shankar等[22]報道了嗜熱鏈球菌生長需要的氨基酸主要是谷氨酸、組氨酸和甲硫氨酸。
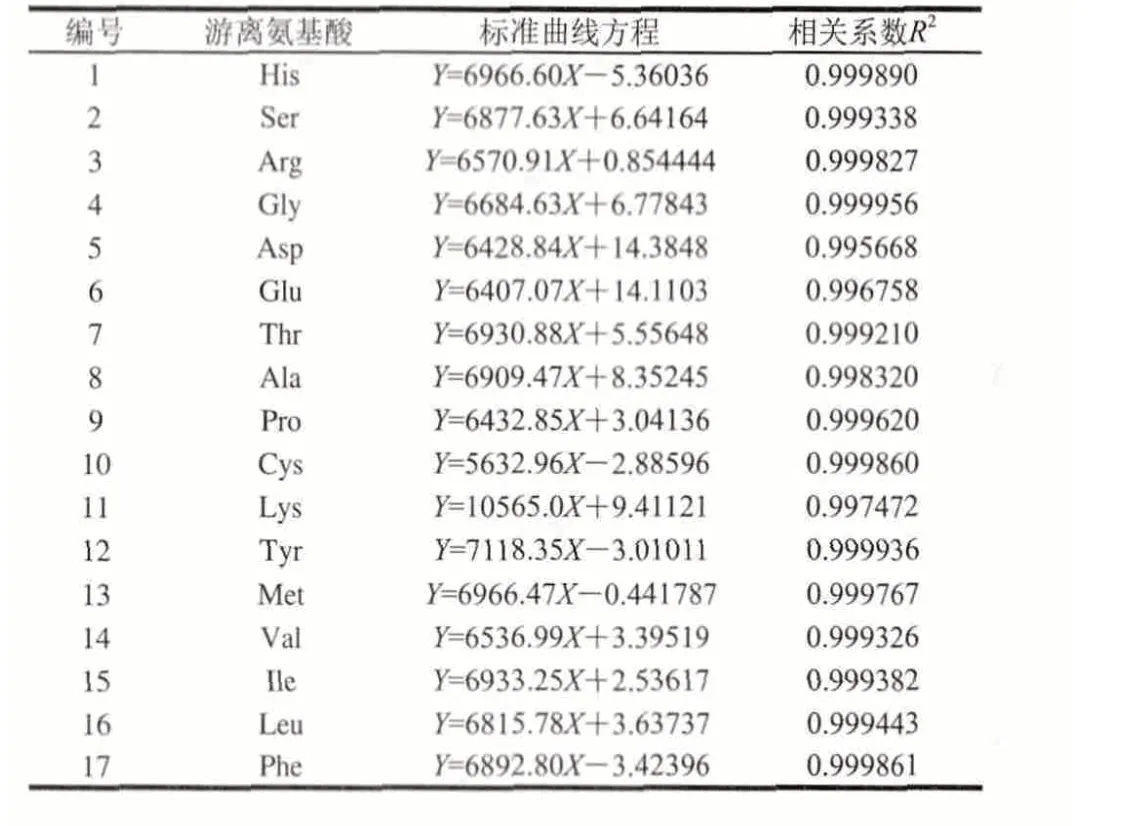
表 6 17種游離氨基酸標準品的標準曲線方程及相關系數Table 6 Standard curve equations and correlation coefficients of 17 free amino acid standards
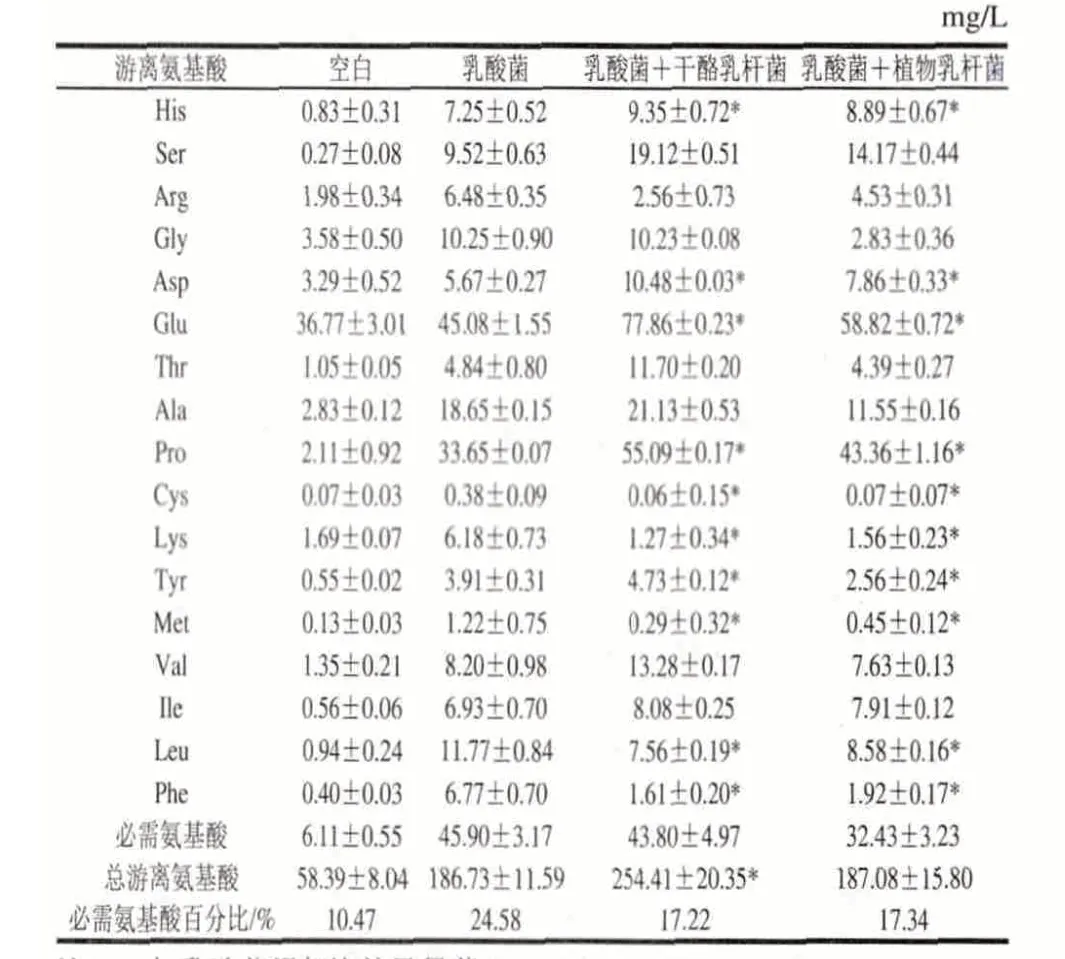
表 7 不同菌種發酵酸乳中的游離氨基酸含量Table 7 Contents of free amino acid in fermented yogurt from different strains
由表7可知,在實驗酸奶樣品中, 游離氨基酸的總量在58.39~254.41mg/L之間,人體必需氨基酸的含量占游離氨基酸總量的10.47%~24.58%。4種酸乳樣品中谷氨酸含量明顯高于其他游離氨基酸。與普通酸乳相比,添加益生菌的發酵酸乳其總游離氨基酸含量均有所增加,其中添加干酪乳桿菌的發酵酸乳增加較顯著(P<0.05)。游離氨基酸的增加主要是由于發酵劑形成的肽酶作用的結果,肽酶積累導致游離氨基酸數量的增加[23]。
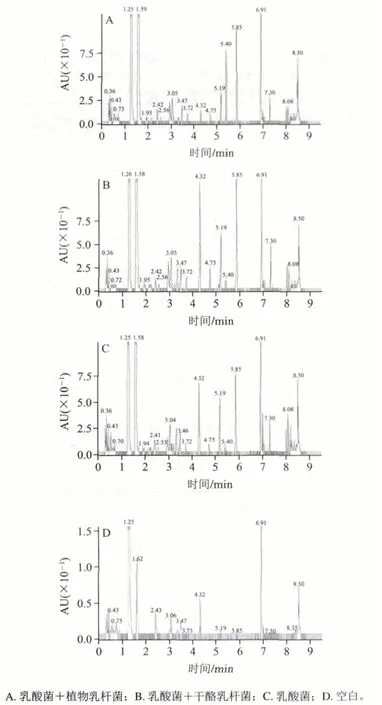
圖 3 不同菌種發酵酸乳中的游離氨基酸含量色譜圖Fig. 3 Chromatograms of free amino acids in fermented yogurt from different strains
由表7、圖3可知,與乳酸菌發酵酸乳相比,添加益生菌的發酵酸乳中,大部分氨基酸含量呈上升趨勢,但變化的顯著性不同。Ser、Asp、Glu、Pro、Cys、Lys、Tyr、Met、Leu及Phe含量有顯著差異(P<0.05)。這可能要歸因于益生菌與乳酸菌之間的相互作用,球菌在生長過程中產生的甲酸和二氧化碳對桿菌的生長有促進作用,桿菌在生長過程中產生的一些肽和自由氨基酸是球菌和自身的促生長因子[24-25]。
3 結 論
馬嵬等[26]采用SDS-PAGE電泳法和反相高效液相色譜法測定了5種原味發酵型酸奶中乳清蛋白的組成和游離氨基酸含量,為全面了解酸乳的組成特性提供了依據。本實驗以響應面優化后的最優生產工藝條件為基礎制備益生菌發酵酸乳,并將其與傳統乳酸菌發酵酸乳相比,發現益生菌發酵酸乳中αs2-酪蛋白、αs1-酪蛋白和β-乳球蛋白條帶比較淺,其中添加植物乳桿菌的發酵酸乳所形成的條帶最淺;而pH4.6可溶性氮、氨基氮和游離氨基酸的含量均有所增加,其中添加干酪乳桿菌的發酵酸乳增加顯著。與乳酸菌發酵酸乳相比,其多肽的種類并沒有增加,只是部分多肽含量發生了一些變化;且益生菌發酵酸乳中大部分氨基酸含量呈上升趨勢,但變化的顯著性不同。產生這些變化的原因是由于益生菌本身所含有的酶類降解蛋白造成的,且由于益生菌與乳酸菌之間的相互作用造成不同益生菌在酸乳發酵過程中代謝活性的不同,而導致對蛋白的降解程度不同。
[1] DAVIDON R H, DUMCAN S E, HACKNEY C R. Probiotic culture survival and implications in fermented frozen yogurt[J]. Journal of Dairy Science, 2000, 83(4): 666-673.
[2] SHAH N P. Probiotic bactacria: selective enumeration and survival in dairy foods[J]. Journal of Dairy Science, 2000, 83(4): 894-907.
[3] REID G. The scientific basis for probiotic strains of Lactobacterium[J].Journal of Applied and Environmental Microbiology, 1999, 65(9):3763-3766.
[4] 郭本恒. 益生菌[M]. 北京: 化學工業出版社, 2004: 382-383.
[5] DIOP L, GUILLOU S, DURAND H. Probiotic food supplement reduces stress-induced gastrointestinal symptoms in volunteers a double-blind, placebo-controlled, randomized trial[J]. Nutrition Research, 2008, 28: 1-5.
[6] 顧瑞霞. 乳與乳制品的生理功能特性[M]. 北京: 中國輕工業出版社,2000: 329-339.
[7] 陳歷俊, 喬為倉. 發酵乳加工與質量控制[M]. 北京: 中國輕工業出版社, 2010: 68-79.
[8] UYENO Y, SEKIGUCHI Y, KAMAGATA Y. Impact of consumption of probiotic lactobacilli-containing yogurt on microbial composition in human feces[J]. International Journal of Food Microbiology, 2008,122: 16-22.
[9] 汪家政, 范明. 蛋白質技術手冊[M]. 北京: 科學出版社, 2002.
[10] CHURCHI F C, SWAISGOOD H E, PORTER D H, et al.Spectrophotometric assay using o-pthaldialdehyde for determination of proteolysis in milk and isolated milk proteins[J]. Journal of Dairy Science, 1983, 66: 1219-1227.
[11] SOUSA M J, ARD Y, MCSWEENEY P L H. Proteolysis in goat cheese made from raw, pasteurized or pressure treated milk[J].Innovative Food Science and Emerging Technologies, 2002, 3:309-319.
[12] AGBOOLA S O. Influence of Australian native herbs on the maturation of vacuum-packed cheese[J]. Dairy Science, 2002, 35:575-583.
[13] 吳非, 劉曉玲. 混合型大豆干酪成熟中蛋白質降解特性的研究[J].食品研究與開發, 2007, 28(7): 1-4.
[14] 任娟, 張富新, 昝林森. 不同發酵劑對羊奶干酪成熟期間蛋白質降解和感官品質的影響[J]. 食品與發酵工業, 2009, 35(12): 144-147.
[15] DAN N, GANESAN R, FLOOD K G, et al. Determination of enantiomers in a synthetic argininal peptide using capillary zone electrophoresis and high-performance liquid chromatography[J].Journal of Chromatography A, 2000, 891(1): 115.
[16] SANZ-NEBOT V, BENAVENTE F, TORO I, et al. Optimization of HPLC conditions for the separation of complex crude mixtures produced in the synthesis of therapeutic peptide hormones[J].Chromatographia, 2001, 53 (Suppl 1): S167.
[17] 張艷華, 李影, 巨芳, 等. 高效液相色譜分離純化多肽的研究進展[J]. 中國食物與營養, 2009(9): 34-36.
[18] SMACCHI E, GOBBETTI M. Bioactive peptides in dairy products:synthesis and interaction with proteolytic enzymes[J]. Food Microbiology, 2000, 17: 129-141.
[19] WILLIAMS A G, BEATTIE S H, BANKS J M. Enzymes involved in flavor formation by bacteria isolated from the smear population of surface ripened cheese[J]. International Journal of Dairy Technology,2004, 57: 7-13.
[20] BESHKOVA D M, SIMOVA E D, FRENGOVA G I, et al. Production of amino acids by yogurt bacteria[J]. Biotechnology Progress, 1998,14(6): 963- 965.
[21] 黃文利, 陳衛, 陸英, 等. 益生菌干酪乳桿菌LC-15生長及發酵特性研究[J]. 乳業科學與技術, 2007(6): 282-286.
[22] SHANKAR P A, DAVIES F L. Amino acid and peptide utilization by Streptococcus thermophilus in relation to yoghurt manufacture[J].Journal of Applied B acteriology, 1977, 43: vIII.
[23] ASTON J W, DURWARD I G, DULLEY J R. Proteolysis and flavor development in cheddar cheese[J]. Australian Journal of Dairy Technology, 1983, 38: 55-59.
[24] DRIESSEN F M, KINGMA F, STADHOUDERS J. Evidence that Lactobacillus bulgaricus in yogurt is stimulated by carbon dioxide produced by Streptococcus thermopbilus[J]. Netherlands Milk and Dairy Journal, 1982, 36: 135-139.
[25] HEMME D H, SCHMAL V, AUCLAIR J E. Effect of the addition of extracts of Thermophilic lactobacilli on acid production by Streptococeus thermophilus in milk[J]. Journal of Dairy Research,1981, 48: 139-148.
[26] 馬嵬, 金素鈺, 鄭玉才. 酸奶中游離氨基酸含量及乳清蛋白組成分析[J]. 中國乳品工業, 2006, 34(6): 20-23.

