清醒與麻醉狀態經典型熱射病大鼠模型比較
耿焱,付煒,劉亞楠,彭娜,雷玉梅,蘇磊
根據勞力性因素的有無,熱射病(heat stroke,HS)分為勞力型熱射病(exertional HS,EHS)和經典型熱射病(classic HS,CHS)[1-2]。CHS具有高發病率和病死率,由于發病機制尚不清楚,臨床缺乏有效而特異性的治療手段,盡管采取了積極的降溫和相應的臟器支持等處理措施,其病死率仍居高不下[3-6]。動物模型尤其是小動物模型對研究CHS的發病機制非常重要。目前普遍接受的實驗性動物HS診斷標準包括動脈血壓下降[1-4],因為血壓測量困難,研究CHS的小動物模型以大鼠為主,而大鼠動脈血壓觀察的經典方法是麻醉狀態下行股動脈插管監測,但這種方法擾亂了大鼠在高溫環境下體溫調節的行為和生理機制,存在較大的混淆因素,影響了大鼠實驗性CHS的研究。我們利用無創大鼠血壓監測系統,首次構建了清醒狀態下的CHS大鼠模型,并對比了該模型與傳統麻醉狀態下CHS模型的異同,為進一步研究自然狀態下大鼠CHS的發病機制奠定了基礎。
1 材料與方法
1.1 主要設備 模擬熱氣候動物艙(南方醫科大學公共衛生與熱帶衛生學學院提供),BW-NIBP型無創大鼠鼠尾動脈血壓測量儀(上海軟隆科技發展有限公司),Powlalr 8sp生理記錄儀(澳大利亞Adinstruments公司)。
1.2 實驗動物及分組 SPF級雄性SD大鼠32只,體重281~314g,于南方醫院實驗動物中心飼養2周左右,環境溫度23℃,濕度55%±5%,12h晝/夜循環。實驗大鼠隨機分為4組,每組8只,分別為:常溫清醒狀態對照組(C-NC組)﹑常溫麻醉狀態左股動脈插管對照組(N-NC組)﹑高溫清醒狀態組(C-CHS組)﹑高溫麻醉狀態左股動脈插管組(N-CHS組)。C-NC組和C-CHS組大鼠在實驗前接受2周無創血壓測量適應性訓練,頻率為2次/d。1.3 有創血壓測量 參照Hall等[4]和Yang等[7]的方法,于大鼠左股動脈插管接生理記錄儀測量收縮壓(SBP)。N-NC組和N-CHS組大鼠在實驗前2h接受左側股動脈插管處理,具體步驟為:大鼠以10%水合氯醛(3ml/kg)腹腔注射麻醉后,仰臥位固定于操作臺;切開左側腹股溝皮膚,分離約1cm股動脈,結扎遠心端,向心臟方向插管并固定,連接三通管,以肝素鹽水125U/ml封管;穩定10min后進行下一步實驗。
1.4 無創血壓測量及驗證 采用大鼠鼠尾動脈血壓測量儀測量SBP值,應用有創血壓測量系統驗證。方法:在實驗過程中隨機選取6個時間點,將N-NC組和N-CHS組大鼠連接無創大鼠鼠尾動脈血壓測量儀,同時進行有創及無創SBP測量,對比兩種測量系統在測量值上的差異。
1.5 核心體溫測量方法 用生理記錄儀的熱電偶測量各組大鼠直腸溫度(Tr),以Tr代表核心體溫。
1.6 熱打擊方法及監測指標 熱打擊前將高溫艙預熱到30℃,在熱打擊前20min(time –20)和10min(time –10)時點各測量核心體溫和SBP一次。熱打擊的方法:將C-CHS組和N-CHS組大鼠置于預熱至30℃的仿真熱氣候動物艙(time 0),30min內將艙內溫度升至39℃,濕度65%。N-CHS組大鼠連接Powlalr 8sp生理記錄儀,直腸內放置熱電偶,每隔10min記錄SBP和Tr一次,根據大鼠意識狀態不定時少量補充10%水合氯醛,維持麻醉狀態。C-CHS組大鼠每10min連接一次無創血壓測量系統和直腸熱電偶,記錄SBP和Tr,達到CHS診斷標準后將大鼠從氣候艙取出。CHS診斷標準:核心體溫≥42℃,動脈SBP從峰值開始下降[5]。實驗期間,各組大鼠均禁食﹑水,C-NC組和N-NC組大鼠全程置于23℃環境中。
1.7 恢復期處理方法 熱打擊結束后即進入恢復期處理。N-NC組和N-CHS組大鼠結扎左側股動脈,拔除插管,縫閉切口,停止使用水合氯醛。各組大鼠接受20min酒精擦浴全身降溫治療后,恢復進食﹑水,放回原飼養環境中繼續觀察3d。
1.8 熱應激計算方法 參考Leon等[8]的方法,通過量化計算方法對比不同HS組大鼠熱應激反應的異同。以熱暴露前的核心體溫和SBP為基線核心體溫和SBP,成模時(SBP從峰值開始下降)的核心體溫為最大核心體溫,以到達最大核心體溫的時間代表總熱暴露時間。總熱負荷(℃·min)=核心體溫≥39℃的熱暴露時間×(最大核心體溫-39℃)。若核心體溫為39℃,則已經與熱打擊環境溫度相同,在該溫度下大鼠已經無法通過輻射散熱。以核心體溫≥42℃作為重度熱負荷的開始,重度熱負荷(℃·min)=核心體溫≥42℃的熱暴露時間×(最大核心體溫-42℃)。核心體溫上升速率=(最大核心體溫-基線核心體溫)/總熱暴露時間×100%。
1.9 統計學處理 采用SPSS 13.0統計軟件包分析數據。計量資料以±s表示,在方差齊性基礎上應用單因素方差分析(one-way ANOVA)比較最大核心體溫﹑總熱暴露時間﹑總熱負荷﹑重度熱負荷和核心體溫上升速率;應用Kaplan-Meier法進行生存分析,假設檢驗采用log-rank法進行分析。P<0.05表示差異有統計學意義。
2 結 果
2.1 無創血壓測量系統的驗證 利用有創血壓測量系統進行的驗證結果顯示,N-NC組大鼠兩種測量方式獲得的SBP測量值存在123.56mmHg差值,鼠尾動脈測量值低于股動脈測量值,但兩者變化趨勢一致;N-CHS組大鼠兩種測量方式獲得的測量值基本相同,考慮為高溫條件下鼠尾動脈血流量增加,提高了鼠尾動脈SBP測量的準確性。鼠尾動脈的舒張壓(diastolic blood pressure,DBP)測量值不穩定,且與股動脈測量值相比有較大出入。驗證結果提示,無創鼠尾動脈血壓測量系統用于CHS模型大鼠的SBP測量是可行的,但DBP測量值不穩定,不適用于平均動脈壓的計算。因此,本實驗參考Yang等[7]的方法,選用SBP從峰值開始下降作為熱射病的診斷標準。
2.2 熱應激體溫及血壓調節反應特征 如圖1所示,熱暴露期間N-CHS和C-CHS組大鼠表現為不同的熱應激反應。隨熱暴露時間的延長,N-CHS組大鼠的核心體溫呈線性增高,直至達到最大核心體溫;C-CHS組大鼠在熱暴露期間,核心體溫呈三相式增高,表現為初始階段核心體溫快速上升,隨后表現為類似于平臺的緩升期,緩升期持續較長時間,此后再次進入快速增長期,直至達到最大核心體溫(圖1A)。N-CHS和C-CHS組大鼠在到達最大核心體溫前,SBP變化模式與核心體溫變化模式基本相同,在到達最大核心體溫時,SBP從峰值開始下降(圖1B)。熱暴露各個時段,N-CHS和C-CHS組核心體溫﹑SBP均與對應的對照組有顯著差異(P<0.05)。與C-NC組相比,N-NC組大鼠基線核心體溫和SBP水平較低(P<0.05)。
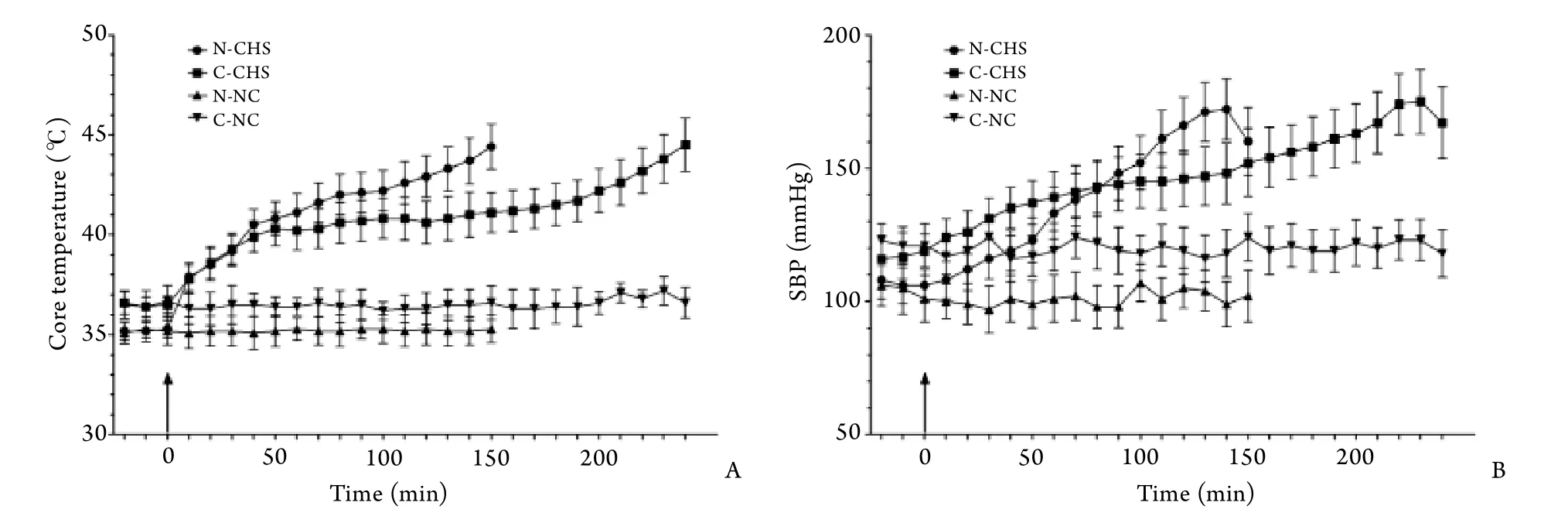
圖1 清醒及麻醉狀態CHS模型大鼠核心體溫和SBP調節特征Fig.1 Core temperature and SBP response profiles in conscious and unconscious classic heat stroke rats
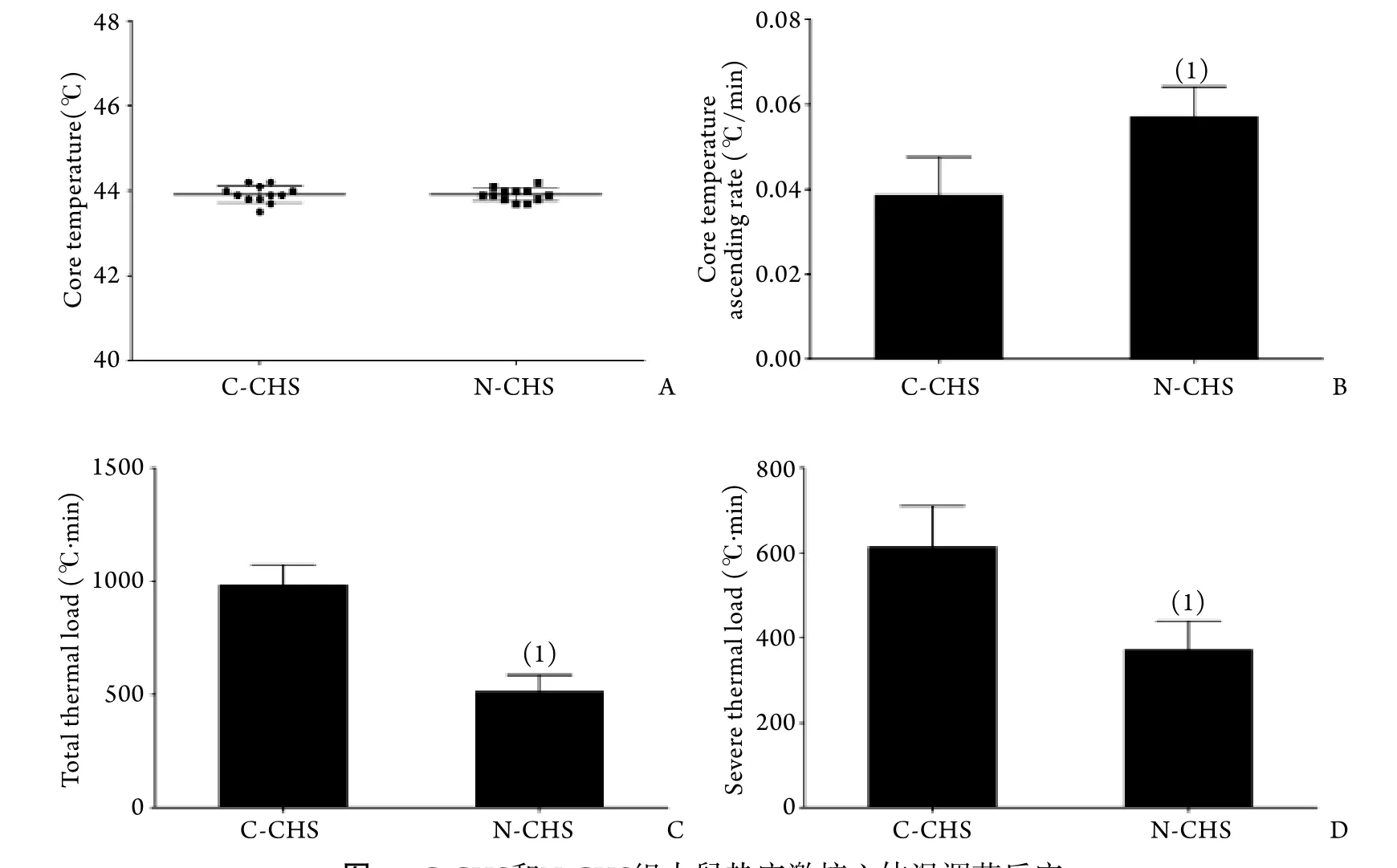
圖2 C-CHS和N-CHS組大鼠熱應激核心體溫調節反應Fig.2 Quantitative analysis of the thermoregulatory responses of C-CHS and N-CHS rats
2.3 熱應激體溫調節反應定量分析 如圖2所示,N-CHS和C-CHS組大鼠最大核心體溫無顯著差異(P>0.05),而N-CHS組大鼠核心體溫上升速率顯著快于C-CHS組大鼠(P<0.05),總熱負荷和重度熱負荷均顯著少于C-CHS組大鼠(P<0.05)。
2.4 生存分析 N-CHS組大鼠在結束熱暴露后12h內全部死亡,C-CHS組大鼠有5只在熱暴露后3d仍存活,生存分析顯示N-CHS組大鼠生存時間顯著短于C-CHS組大鼠(圖3,P<0.05)。
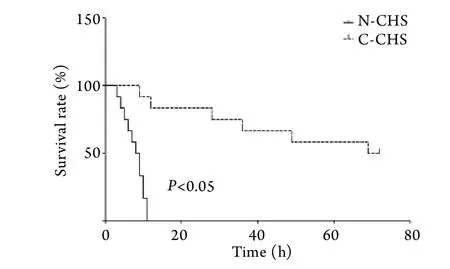
圖3 N-CHS組和C-CHS組大鼠生存時間對比Fig.3 Time-survivor curve of N-CHS and C-CHS rats
3 討 論
臨床上有關CHS的診斷標準包括核心體溫超過41℃,皮膚干熱﹑潮紅,同時伴神經系統功能障礙[9-10]。與臨床工作不同的是實驗中很難通過觀察上述癥狀來診斷大鼠CHS。因此,目前在CHS大鼠模型的研究中,以核心體溫超過41℃和SBP從峰值下降作為診斷實驗性CHS的標準[7]。傳統的大鼠SBP測量方法為麻醉狀態下股動脈插管監測,基于這種有創血壓測量系統建立的CHS大鼠模型存在著不可忽視的方法學上的混淆因素,包括:麻醉可抑制體溫調節機制,影響熱應激體溫調節反應[11-12];在嚙齒動物,向身體的腹側涂抹唾液是蒸發散熱必不可少的機制,然而在麻醉的情況下,這種行為受到抑制;股動脈插管需要結扎一側股動脈,結果導致心臟前負荷增加,以及同側后肢的缺血性損害及壞死,對機體產生致命性影響。上述混淆因素擾亂了動物在高溫環境下調節體溫的正常行為和生理學機制,導致不自然的熱應激反應,影響了對實驗性大鼠CHS的研究[8]。
我們首次使用無創血壓測量系統構建了清醒狀態下的CHS大鼠模型。對比麻醉和清醒狀態下CHS大鼠模型的熱應激血壓和體溫調節反應,我們發現兩者存在較大不同。清醒狀態CHS大鼠體溫調節呈現三相式模式,包括初始快速上升期﹑平臺樣緩升期和終末快速上升期,而麻醉狀態下的CHS大鼠體溫調節呈單相式線性增高。血壓調節也有類似現象,只是到達最大核心體溫時從峰值開始下降。進一步定量分析熱應激下體溫調節顯示,盡管兩種模型在最大核心體溫上無顯著差異,但對比清醒狀態下的CHS大鼠,麻醉狀態下CHS大鼠的核心體溫上升速率顯著加快,成模時間(總熱暴露時間)顯著縮短。三相式核心體溫調節特征更接近大鼠的自然狀態,表現為:熱應激的初始階段,由于環境溫度大于核心體溫,導致無法代償的熱負荷,出現核心體溫陡然上升;上升到大于環境溫度的水平后,清醒狀態下的大鼠可以通過涂抹唾液和尿液等行為加強蒸發散熱,從而將體內的熱量有效散發到外界環境,減緩核心體溫的上升,導致出現可辨識的平臺樣緩升期;緩升期后核心體溫的第二次陡然上升直到最大核心體溫,提示體溫調節的破壞。受核心體溫的影響,SBP的調節水平也呈現類似的三相式調節特征,直至達到最大核心體溫,此時SBP從峰值下降。麻醉狀態大鼠因為體溫調節的生理行為受抑制,因此表現為單相式線性上升。值得注意的是,盡管熱負荷定量分析顯示,麻醉狀態下CHS大鼠的總熱負荷和嚴重熱負荷均顯著低于清醒狀態下的CHS大鼠,但其預后更差,并且沒有大鼠的生存時間超過12h。我們推測可能與股動脈結扎的副作用有關。以上結果表明,清醒狀態CHS模型更接近大鼠的生理狀態。
本研究結果證實,相比傳統的麻醉狀態CHS大鼠模型,基于無創血壓測量系統的清醒狀態CHS大鼠模型更適用于實驗性大鼠CHS的研究。對于清醒狀態CHS大鼠模型的進一步研究,可以促進對CHS發病機制的理解。
[1] Su L. Review on prevention and treatment of severe heat stroke[J].Med J Chin PLA, 2011, 36(9): 883-885. [蘇磊. 重癥中暑防治回顧與啟示[J]. 解放軍醫學雜志, 2011, 36(9): 883-885.]
[2] Liu H, Song Q, Zhou FH, et al. Application of mild hypothermia in the treatment of exertion heat stroke[J]. Med J Chin PLA,2010, 35(9): 1148-1150. [劉輝, 宋青, 周飛虎, 等. 亞低溫在勞力型熱射病治療中的應用[J]. 解放軍醫學雜志, 2010, 35(9):1148-1150.]
[3] Bouchama A, Knochel JP. Heat stroke[J]. N Engl J Med, 2002,346(25): 1978-1988.
[4] Hall DM, Buettner GR, Oberley LW, et al. Mechanisms of circulatory and intestinal barrier dysfunction during whole body hyperthermia[J]. Am J Physiol Heart Circ Physiol, 2001,280(2): 509-521.
[5] Bouchama A, Roberts G, Al Mohanna F, et al. Inflammatory,hemostatic, and clinical changes in a baboon experimental model for heatstroke[J]. J Appl Physiol, 2005, 98(2): 697-705.
[6] Ji J, Song Q, Yue H, et al. The protective role of Xuebijing injection to heat stroke in rats[J]. Med J Chin PLA, 2011, 36(6):578-581. [紀筠, 宋青, 岳慧, 等. 血必凈注射液對熱射病大鼠保護機制的研究[J]. 解放軍醫學雜志, 2011, 36(6): 578-581.]
[7] Yang HH, Chang CP, Cheng RT, et al. Attenuation of acute lung inflammation and injury by whole body cooling in a rat heat stroke model[J]. J Biomed Biotechnol, 2009, 2009: 768086.
[8] Leon LR, DuBose DA, Mason CW. Heat stress induces a biphasic thermoregulatory response in mice[J]. Am J Physiol Regul Integr Comp Physiol, 2005, 288(1): R197-R204.
[9] Bouchama A, Knochel JP. Heat stroke[J]. N Engl J Med, 2002,346(25): 1978-1988.
[10] Leon LR. Heat stroke and cytokines[J]. Prog Brain Res, 2007 162: 481-524.
[11] St?en R, Sessler DI. The thermoregulatory threshold is inversely proportional to isoflurane concentration[J]. Anesthesiology,1990, 72(5): 822-827.
[12] Washington DE, Sessler DI, Moayeri A, et al. Thermoregulatory responses to hyperthermia during isoflurane anesthesia in humans[J]. J Appl Physiol, 1993, 74(1): 82-87.

