EML4-ALK抑制劑在非小細胞肺癌中發生耐藥的機制
吳荻 于鴻 李佳美
非小細胞肺癌(non-small cell lung cancer, NSCLC)約占肺癌總數的80%-85%,是最常見的惡性腫瘤之一。繼表皮生長因子受體(epithelial growth factor receptor,EGFR)基因突變在NSCLC發生過程中的機制逐漸明晰后,NSCLC的靶向治療已經成為臨床實踐的熱點[1]。近年來的研究[2]發現了一種新的癌基因,棘皮動物微管相關蛋白樣4-間變性淋巴瘤激酶(echinoderm microtubuleassociated protein-like 4-anaplastic lymphoma kinase, EML4-ALK)參與了NSCLC的發生過程。以EML4-ALK為靶點的分子靶向藥物的應用成為治療NSCLC的焦點,包括克唑替尼(crizotinib)在內的多種酪氨酸激酶抑制劑(tyrosine kinase inhibitors, TKI)在臨床前期研究以及對ALK易位癌癥患者的治療中取得良好的療效[3,4]。雖然該藥在2011年已被FDA批準,但并不是所有的患者均能從治療中獲益,一部分患者經治后疾病進展,產生獲得性耐藥;還有很少的一部分患者初治即發生耐藥,因此探究TKI耐藥機制具有重要的臨床意義,闡明其耐藥性機制將有利于制定克服臨床耐藥性發生的新策略[5]。本文將詳述目前已知的耐藥機制。
1 ALK激酶區域突變
一個公認的TKI獲得性耐藥的機制是在激酶域ATP結合位點發生集群性突變[6,7]。Crizotinib的耐藥機制研究仍在探索中,從所有經過crizotinib治療的NSCLC以及炎性肌纖維母細胞瘤(inflammatory myofibroblastic tumor,IMT)患者中證實的幾種二次突變都已公開報道[8,9]。2008年,Choi等[10]首次報道在臨床治療中發現一例患者持續應用crizotinib后腫瘤繼續增長。推測可能發生了基因的二次突變,誘發繼發性耐藥。研究組利用Sanger測序在73例EML4-ALK陽性患者胸腔積液標本中檢測到序列4374G→A和4493C→A兩種基因突變,其中,34例(46.6%)呈4374G→A陽性;11例(15.1%)呈4493C→A陽性。相應序列1156和1196表達的氨基酸發生了改變。其余28例(38.4 %)兩個點突變均為陰性。C1156和L1196都位于ALK激酶域,其中C1156位于預測的螺旋αC氨基末端,接近ATP結合區域上部邊緣;L1196則位于ATP結合區域底部“gatekeeper”處,這種帶著大分子側鏈的氨基酸可能會干擾TKI的結合。
2010年,Sasaki等[9]也證實L1196突變可能創建了一個空間位阻阻止crizotinib的結合。而F1174L突變可能促進ALK活化構象的產生,從而不利于crizotinib的結合,使其優先結合無效構象ALK。2011年,發現一種新的ALK TKI耐藥機制,即在ALK和活化的EGFR信號中的一個二次突變(L1152R),導致在1152位置上的亮氨酸被精氨酸取代[6]。值得注意的是這些突變可以發生在同一個腫瘤中,故在制定克服臨床耐藥的策略時應該充分認識到耐藥機制的復雜性[11]。
在已經鑒定的各種不同EML4-ALK亞型中,沒有任何證據表明特定EML4-ALK亞型獲得性耐藥的機制會有所不同。此外,L1152R突變與F1174L突變不同,其對另外一個ALK抑制劑TAE684敏感性不同,故需要結構獨特的ALK抑制劑克服這種突變。有幾種新型抑制劑正在臨床前開發階段。與此同時,Zhang等[12]鑒定了在激酶活性部位周圍的5個區域的殘基突變,除已知的C1156、F1174、L1196和L1152等突變外,還檢測到另外兩種新的二次突變S1206和I1171。相信隨著對ELM4-ALK融合基因研究的深入,可能會發現更多不同突變會導致耐藥性的發生。
2012年,Doebele等[13]通過直接對ALK外顯子21-25(編碼激酶區域)進行測序,分析了14例患者ALK重組的NSCLC組織,其中11例有分子分析的評估價值,4例(36%)在ALK酪氨酸激酶區域產生二次突變,2例在相應區域編碼L1196M替代氨基酸。該基因在經典的“gatekeeper”基因水平上與T315I和T790M同源;有2例在ALK編碼區域發生一種新的二次基因突變(G1269A),位于ALK的ATP結合區末端,原來的甘氨酸被較大的丙氨酸取代,形成一定的空間位阻阻礙crizotinib的結合。體外實驗證明,與野生型相比,G1269A能夠促進ALK永久性磷酸化,激活下游效應器,發生crizotinib耐藥。
同在2012年,Katayama等[14]探討了經crizotinib治療后的耐藥屬于繼發性耐藥還是原發性耐藥的問題。針對18例crizotinib經治耐藥患者的樣本,他們進行了治療基線與耐藥后組織總核酸測序以及ALK激酶域的標準Sanger測序。 在相應crizotinib耐藥樣本中未發現其治療前基線組織存在ALK突變。使用等位基因特異的PCR檢測法進行再確認,所得結果與前次實驗一致。這表明crizotinib的耐藥突變在治療前的腫瘤組織中并不普遍。通過對外顯子20-28對應的ALK酪氨酸激酶域測序。在18例crizotinib耐藥患者中,發現4種耐藥突變:3種錯義突變(L1196M、G1202R和S1206Y)以及1種氨基酸(蘇氨酸)插入突變(1151Tins)。L1196M替代氨基酸突變既往已被公開報道。G1202R突變與伊馬替尼耐藥的BCR-ABL突變(G340W)類似。其它兩個突變(1151T插入和S1206Y)似乎為ALK和crizotinib耐藥所特有。G1202R和S1206Y都位于鄰接crizotinib結合位點激酶結構域的溶劑暴露區域。推測1151Tins殘基位于α螺旋C的N末端環路遠端,此位置與crizotinib結合位點并不相鄰。推測該突變可能會影響ALK對ATP的親和力,導致高水平的crizotinib耐藥。
通過對以上突變編碼的氨基酸被映射到ALK激酶區域晶體結構的研究[15],發現該系列突變出現在或者遠離ATP和crizotinib的結合口袋區域的狹長凹陷處。2012 ASCO報道(Abstract No: 7504)Doebele等收集30例ALK陽性的經crizotinib治療進展后的NSCLC病例,19例取得活檢組織,15例可最終評價分子學指標。結果發現6例(40%)發生ALK激酶域繼發突變,并新發現了F1174C和D1203N突變;2例(其中1例有耐藥突變)出現新的ALK基因拷貝數增益(copy number gain, CNG);4例出現其它基因位點的突變(1例EGFR突變;3例KRAS突變),伴或不伴ALK基因融合;1例腫瘤進展的樣本缺乏ALK融合基因;3例ALK陽性樣本沒有明確的耐藥機制。該研究進一步證明了耐藥機制發生的復雜性和臨床治療克服耐藥面臨的諸多挑戰[16]。
隨著研究的擴展和深入,更多的ALK融合基因的繼發突變被發現。在NSCLC中ALK融合基因的發生率較低,并且還分為多種亞型,這給臨床檢測鑒定帶來了困難。不同亞型與繼發突變之間有何相關性,多個繼發突變位點之間又有什么聯系,很多問題有待深入研究。尤其是對于中國的患者,尚需精確檢測并大規模的分析ALK融合的發生率和不同ALK融合基因亞型的發生頻率及其與EGFR等其它分子靶點之間的關系。
2 信號傳導旁路的激活
ALK是一個高度保守的受體酪氨酸激酶(receptor tyrosine kinase, RTK),作為核磷蛋白(nucleophosmin,NPM)融合物,在1994年首次在間變性大細胞淋巴瘤(Anaplastic Large Cell Lymphoma, ALCL)中發現[17]。ALK有三個結構域:胞外配體結合結構域,跨膜區和胞內酪氨酸激酶域。就同源性來說,ALK與白細胞酪氨酸激酶(leukocyte tyrosine kinase, LTK)是最相似的,都屬于胰島素受體超家族。在生理條件下結合配體誘導的ALK二聚體可導致反式磷酸化和激酶的活化[18]。此外,不同于原來的ALK定位于質膜,ALK融合蛋白的大部分分布到細胞質中,這種在細胞定位上的不同可能導致ALK激活機制的改變。
ALK的關鍵下游效應信號比上游信號的激活更為人們所了解,包括Ras/MEK/ERK、PI3K/AKT和JAK3-STAT3信號轉導通路[19,20]。在一般情況下,Ras/MEK/ERK是重要的細胞增殖信號傳導通路,而PI3K/AKT和JAK3-STAT3通路對于細胞存活和細胞骨架的變化是很重要的。藥理學抑制就是通過使用EML4-ALK TKI使Ras/MEK/ERK和PI3K/AKT通路分子表達下調,從而誘導細胞凋亡[21]。小分子TKI crizotinib(PF02341066)作為一種強效的ALK抑制劑[22],與NPM-ALK陽性的ALCL細胞G1-S期的細胞周期阻滯相關,抑制ALK磷酸化和信號轉導,并誘導細胞凋亡。在細胞和轉基因小鼠模型的體內外研究中,EML4-ALK是一種強效致癌的“驅動突變”[21,23]。含有這種基因重組的癌細胞變得依賴或“沉溺”于ALK,對ALK激酶抑制是高度敏感的[24]。然而,在ALK抑制劑耐藥模型中,即使持續使用酪氨酸激酶抑制劑,Ras/MEK/ERK以及PI3K/AKT傳導通路仍都被再次激活[18]。即ALK下游信號傳導旁路的激活會繞過抑制劑作用的原始靶點,成為ALK抑制劑耐藥性產生的原因之一[25]。
在2012 ASCO的教育專場中,Camidge也指出ALK TKI的耐藥機制可能包括其它旁路途徑的活化,如EGFR、KIT受體的活化。可見,ALK TKI的耐藥機制是多樣化的,需要積累樣本開展大規模的綜合分析,為最終克服耐藥提供方法和數據。
Takezawa等[26]為了研究EML4-ALK致癌的功能,建立了非轉化的小鼠成纖維細胞系(NIH 3T3)。這些細胞可以穩定表達EML4-ALK的亞型1或3(3T3/EAV1和3T3/EAV3細胞)。研究中發現,與3T3-模擬細胞相比,3T3/EAV1和3T3/EAV3細胞表達磷酸化的ERK和STAT3水平都明顯增加,而EML4-ALK的表達并不影響3T3-模擬細胞AKT的磷酸化水平。他們對3T3/EAV1和3T3/EAV3細胞使用ALK的siRNA進行EML4-ALK RNA干擾(RNA interference, RNAi),明顯抑制ERK和STAT3的磷酸化,但對AKT無明顯影響。這些數據表明,EML4-ALK亞型1或3可以激活ERK和STAT3信號通路,而不是PI3K/AKT信號傳導通路。進一步發現,在所有3種細胞系中新型酪氨酸激酶抑制劑TAE684抑制ERK和STAT3的激活,同樣不影響AKT。這表明ALK抑制劑誘導EML4-ALK陽性肺癌細胞的生長抑制和凋亡,伴隨這些影響的不是PI3K/AKT信號通路而是ERK及STAT3信號轉導通路。ALK抑制劑可以明顯抑制ERK及STAT3信號轉導通路,PI3K/AKT信號通路則可能不受影響或者影響較小,可以繼續傳遞信號,成為耐藥性產生的原因之一。
最近的研究[19]表明,sonic hedgehog信號傳導通路(SHH/GLI1)也在ALK陽性ALCL內被激活。SHH/GLI1是由于SHH基因擴增,其實是NPM-ALK基因通過激活PI3K/AKT信號通路進一步介導該通路并產生穩定的GLI1蛋白。這一AKT旁路的激活也可能是導致耐藥性的原因。
Katayama等[27]培育的H3122 CR3細胞對ALK抑制劑和HSP90抑制劑均耐藥。Crizotinib作用于該細胞系后,其抑制磷酸化ALK的水平與敏感性親代細胞程度相同。然而,盡管受ALK抑制,AKT和ERK仍保持活化。這表明AKT和ERK信號傳導途徑的活化是由ALK以外的調節器維持的。磷酸化受體酪氨酸激酶微列陣分析表明,H3122 CR3細胞與親代細胞相比,在crizotinib治療前后都含有更高水平的磷酸化EGFR和磷酸化ERBB3。另外,Real Time RT-PCR分析表明,在耐藥細胞中,EGFR mRNA、EGFR配體雙調蛋白和ERBB3配體NRG1有所上調,推測H3122 CR3細胞內EGFR活化可能是由于上調受體本身以及兩個配體導致持久性ALK非依賴的下游信號轉導通路的活化。
Sasaki等[6]的研究同時表明,EGFR信號通路的激活作為旁路的信號傳導機制,也導致ALK抑制劑耐藥,同時抑制EGFR和ALK的方法對所有耐藥模型的治療有效。
上述研究結果提示我們為了克服crizotinib耐藥,可以將其與其它的信號通路抑制劑聯合使用(如培美曲塞、EGFR抑制劑或HSP90抑制劑),或者與其它的ALK抑制劑聯合使用。
3 ALK融合基因拷貝數目增益
拷貝數目的增益定義為與預處理樣本相比,治療后樣本每個細胞內重組基因數目有2倍以上的增加。最近的研究[27]表明ALK融合基因拷貝數目的增益與crizotinib耐藥性相關。通過熒光原位雜交技術(f l uorescent in situ hybridization, FISH)可以檢測crizotinib治療前后每個細胞基因重組ALK拷貝的含量[28]。在評估的90例樣本中30例接受了crizotinib治療,檢測結果表明ALK陽性細胞有更高的拷貝數(r=0.743, P<0.000,1)。在ALK陽性的腫瘤中,陽性細胞的百分比和拷貝數都是預測ALK抑制劑的治療作用的有效指標。Katayama等[14]報道了18例獲得crizotinib耐藥的肺癌患者中有1/4伴有ALK融合基因的擴增,而且在發生耐藥的患者中多種耐藥機制并存。Doebele等[13]的研究中有2例患者(18 %)出現明顯的ALK重組基因增益。這些結果都表明,ALK融合基因的大量擴增可能導致ALK抑制劑耐藥性的產生。
4 其它機制
在Doebele等[13]的研究中還有2例患者顯示為KRAS基因突變,其中1例并沒有明顯的證據表明其含有永久性的ALK基因重組;1例患者與基線樣本相比變為ALK融合基因陰性,沒有明確的啟動機制;2例患者始終保持ALK陽性,但沒有明確其耐藥機制。因此考慮獨立致癌驅動因子等因素與耐藥性的產生有關。綜上所述,ALK-TKI分子靶向治療不可避免的產生耐藥問題,使得其對患者的治療療效逐漸降低。其耐藥機制復雜,主要包括:①ALK激酶區域的二次突變(不同的突變基因導致的耐藥機制還有所不同,進一步的多元耐藥機制還需要深層的研究);②信號傳導旁路的激活,使得信號傳導繞過抑制劑作用的原始靶點,產生耐藥性;③ALK融合基因增益;④產生非依賴性的致癌因子等機制都與其耐藥性相關。有很多機制還處于未知狀態,有待于進一步的研究。目前已知的ALK抑制劑發生耐藥的幾種機制見圖1。
5 ALK抑制劑在其它腫瘤治療中的應用
ALK基因異常主要發生在間變性大細胞淋巴瘤、神經母細胞瘤、炎性肌纖維母細胞瘤和NSCLC中。在一個由多中心兒童腫瘤組織開展的I期臨床試驗中,參與的兒童通過服用crizotinib獲得了緩解,而且副作用很小。2012 ASCO報道了這項研究發現。8例患有ALCL的兒童中,有7例完全緩解;7例有ALK基因易位的IMT患者,1例微效,1例部分緩解;35例神經母細胞瘤患者,27例可評價療效。8/27例患者有ALK基因突變:1例治療后完全緩解并維持超過6個月,1例微效。2例病變穩定超過8個療程。1例NSCLC患者部分緩解。Butrynski等[8]報道1例ALK易位的IMT患者對crizotinib部分反應。患者接受crizotinib治療8個月后無疾病進展,腫瘤切除術后19個月無復發。Lennerz等[29]報道2例Met擴增胃食管癌患者對crizotinib敏感。治療后腫瘤縮小(-30%和-16%)并持續了3.7個月和3.5個月。Gambacorti-Passerini等[30]報道2例復發的ALK陽性ALCL患者crizotinib治療后1周顯示了臨床改善,完全應答分別持續了6個月和15個月。
ALK抑制劑在其它腫瘤中的耐藥機制報道較少。Sasaki等[9]報道攜帶RANBP2-ALK易位的IMT患者使用crizotinib治療后疾病進展是由ALK的F1174L突變所致。一個神經母細胞瘤細胞系SK-N-SH,在ALK基因中含有F1174L突變,在用TAE684處理后發生耐藥伴隨STAT3磷酸化水平升高[31]。這也提示NSCLC中發生ALK抑制劑耐藥的復雜性和特殊性。
6 發展前景
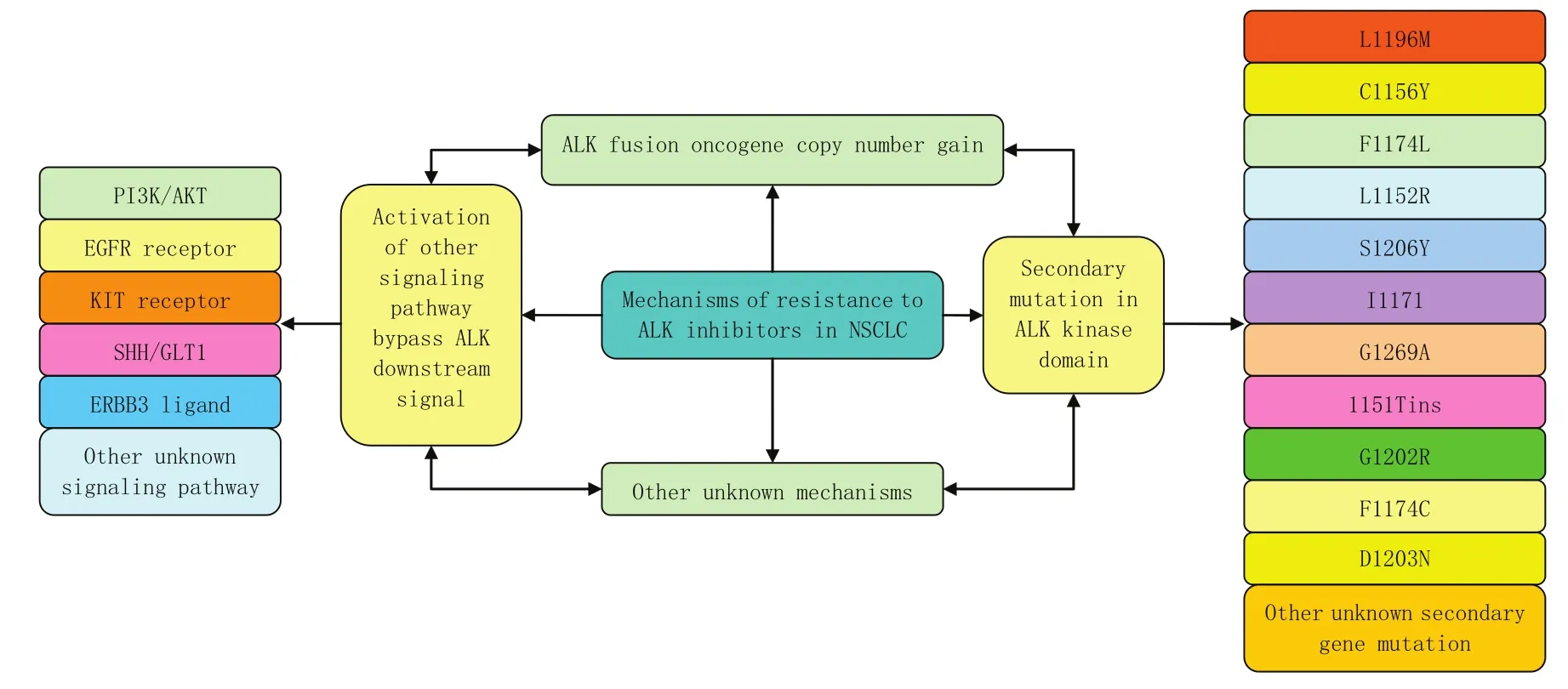
圖1 ALK抑制劑在非小細胞肺癌中發生耐藥的不同機制Fig1 Multiple mechanisms of resistance to ALK inhibitors in non-small cell lung cancer (NSCLC)
在了解有關的耐藥機制后最關注的是如何根據不同的耐藥機制克服耐藥問題。Katayama等[27]證實另一種強效ALK抑制劑AP26113,可以克服crizotinib耐藥。而Li等[32]在研究中也使用了一個強效有力并且有選擇性的ALK小分子抑制劑-NPV-TAE684,以評估EML4-ALK在NSCLC中的致癌作用。他們的實驗結果表明TAE684可以在EML4-ALK融合基因陽性的NSCLC模型中抑制細胞增殖、誘導細胞周期阻滯、凋亡和腫瘤消退。他們用微陣列分析方法,有針對性地開展對TAE684治療后H2228 NSCLC移植瘤模型基因表達途徑變化的研究,并確定了EML4-ALK抑制的基因印記(基因印記表示1210已知的人類基因,以及最佳的生物過程表代表這些基因的細胞周期、DNA合成、細胞增殖和細胞死亡)。他們還比較了TAE684和crizotinib的療效,雖然crizotinib能夠減少H2228和H3122細胞的生存率,但與TAE684相比不太有效:H2228和H3122相對的crizotinib IC50值分別為871 nmol/L和1,551 nmol/L,而TAE684對應的IC50值為16 nmol/L(H2228)和44 nmol/L(H3122)。證明了TAE684是一個更有力的EML4-ALK抑制劑,在crizotinib耐藥性NSCLC的治療中可能取得更好的療效,在克服耐藥的實驗研究進程中起重要的作用。
2012年歐洲腫瘤內科學會報道了一些新的ALK抑制劑的研發,對crizotinib無效的患者也有活性。一項小樣本的研究結果(Abstract No: 440_O)探討了LDK治療56例ALK陽性的腫瘤患者的療效。在接受crizotinb治療后疾病進展的患者中,這個藥物療效明顯;另一個ALK抑制劑CH5424802[33]也對ALK陽性的NSCLC患者顯示出有臨床意義的抗腫瘤活性(Abstract No: 441_O);此外,HSP90抑制劑也代表一種新型的治療策略[34,35]。其中AUY922對crizotinb治療后疾病進展的患者或EGFR抑制劑(吉非替尼或厄洛替尼)治療后進展的EGFR陽性患者均有治療作用(Abstract No: 438_O)。一種HSP90抑制劑17-烯丙基氨基-17-去甲氧基格爾德霉素(17-AAG)能夠抑制四種突變形式的EML4-ALK,類似于其對野生型EML4-ALK的效力。17-AAG降低表達野生型或突變型EML4-ALK的Ba/F3細胞株的磷酸化ALK和所有ALK蛋白的表達,克服crizotinib耐藥介導的二次ALK突變,尤其是像1151Tins這類經檢測對所有ALK抑制劑高水平耐藥的突變[27]。
已經發現ALK的二次突變可同時伴有EGFR突變,說明crizotinib耐藥可能同時由多種耐藥機制共同誘導。因此,融合性的二代新型抗腫瘤藥物的研發也勢在必行。對于EGFR TKI耐藥的研究也給出很多啟示,采取全身治療(原靶向治療藥物、新靶向治療藥物和細胞毒性藥物等)和局部治療(手術、放療和各種介入治療)的聯合以克服耐藥性,從而盡可能有效的治療癌癥。此外,多靶點酪氨酸激酶抑制劑可以多途徑干擾腫瘤細胞的發生和發展,為TKI耐藥患者帶來福音。但目前大部分多靶點酪氨酸激酶抑制劑仍處于臨床試驗階段,其最佳適用人群尚需進一步研究。
已經進行的第一項crizotinib的III期臨床研究(PROFILE 1007)顯示crizotinib帶來的改善是非常明顯的,疾病進展風險降低50%。在歡欣鼓舞的同時更加迫切的需要解決目前存在的諸多問題。ALK抑制劑發生耐藥性的頻率,不同耐藥機制的發生頻率,各種耐藥機制之間的相互作用關系,以及ALK抑制劑耐藥與其他TKI之間的關系尚待研究。Heuckmann等[36]已證明不同的ALK融合基因和EML4-ALK亞型對crizotinib和TAE684的敏感性不同,其機制與蛋白表達的穩定性相關。有趣的是,它們對HSP90抑制的敏感性也不同,而且這種不同與它們對ALK抑制劑的敏感性也是有差異的。二者合用效果更佳。這些結果提示需要精確檢測ALK的基因型并探討研究ALK抑制劑的組合應用策略。此外,多種突變共存的患者是否可以使用融合性新型抗腫瘤藥物治療,單藥應用時通過藥物假期和再次給藥的方式能否有效的克服耐藥,新研制開發的藥物在已經發生耐藥的患者中的治療效果和安全性等問題還有待實踐驗證。

