在物理和化學之間的尼爾斯·玻爾(下)
陳秀剛/編譯
玻爾的周期性系統
1920年初,玻爾不再研究分子,但對于化學方面的探索絲毫沒有松懈。他拋棄了之前以單一量子數并且在平面環繞原子核移動的電子為基礎的“薄餅模型”,以一個明顯不同的原子結構模型取而代之。根據新的圖片,一個電子有兩個量子數,用nk表示,其中n是主量子數,k=1,...,n是角量子數。電子在三維橢圓軌道移動,其離心率取決于n/k的值。此外,電子在外層軌道的移動可能穿會躍遷至原子內層軌道,從而產生一個耦合的旋轉電子。
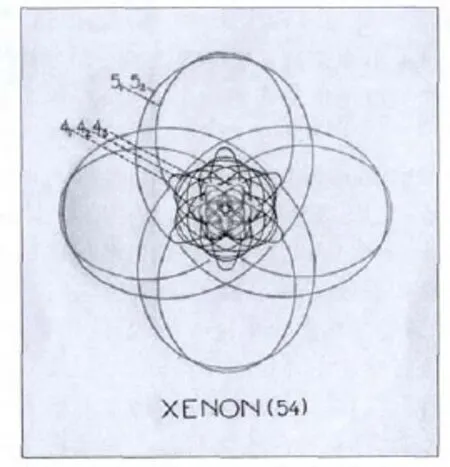
圖4.詳細的原子插圖,如這個關于氙原子(Z=54)的結構圖,是尼爾斯·玻爾在1921年至1923年間講座的一個內容。根據玻爾理論,在原子外部(主量子數n>3),每個軌道 41,42,和43含有六個電子,最外層軌道51和52每個軌道有四個電子。奇主量子數的軌道是紅色的,偶量子數的軌道是黑色的。一些簡單的橢圓軌道沒有在圖上顯示,但他們實際上隨著橢圓慢慢的旋進呈現微開的樣子。雖然本圖顯示的是二維空間結構,但實際情況下原子的電子是在三維空間運動的。
在建立電子結構理論時,玻爾是根據他所謂的構造、施工、原理的順序進行展開的:新增的電子數p和部分完成p-1束縛電子使得p-1電子的量子數不會產生變化,新增電子的n級量子數不同于外層的束縛電子,除非原子的形成過程屬于新的周期性系統。
玻爾在1921年至1923年間在出版著作和會議中提出了更復雜原子模型結構,在1922年12月11日獲得諾貝爾獎時他做的演講中也有提到。在斯德哥爾摩和在其他地區,他通過解釋各類原子的電子軌道平面向人們闡述了他的新的化學元素周期理論。比如,比較簡單的鋰原子,玻爾將它畫成由兩個交叉的11軌道組成的氦結構,外層是單電子的橢圓21軌道。圖4是玻爾畫出的氙原子。鐳原子更復雜一點,也是波爾模型的亮點,所有88個軌道都按比例細致的呈現出對稱美。
軌道結構圖讓人覺得電子是一直在既定軌道上運動的,就像行星和彗星一直繞著太陽轉一樣。雖然波爾慎重闡明原子結構圖只是參考性內容,而不表示具體真正的原子運動情況,但當時他顯然對電子運動軌道的實際狀態沒有任何質疑。盡管這些原子結構圖很吸引玻爾,但年輕的沃爾夫岡·泡利(Wolfgang E.Pauli)卻發現,這是一個基于錯誤的電子軌道概念提出的原子模型。
玻爾自信已完全理解了電子構造的基本法則,如圖5,他提出自己關于元素周期表在橫排和豎排安排的原理解釋。更重要的是,這是他首次嘗試從電子構造方面解釋由氫到鈾的完整系統性元素周期。玻爾還預言了第72號未知元素,其化學性質應該類似于鋯(Z=40),這個預言在1923年得到證實,在玻爾研究所通過x射線光譜分析發現了這一元素。玻爾對他的理論很有信心,他甚至畫出了仍然處于假設中的超鈾元素的電子結構圖。因此他預言了118號元素是惰性氣體,有七個電子層,每層電子數量分別為2,8,18,32,32,18,和8。而且,118號元素是2006年通過重離子碰撞產生,暫時命名為ununoctium,。現代計算結果顯示的電子結構與玻爾的預言完全一致!
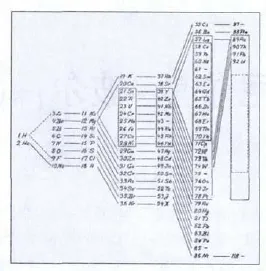
圖5.是1923年尼爾斯·玻爾關于元素周期表的設想。71號元素(Cp、镥)即今日的镥(Lu),86號元素 (Nt,氡)即氡。 缺失的 75號元素(Re,錸)在1925年通過x射線光譜分析被發現,運用同樣方法,也發現了1923年初提出的鉿的存在。
玻爾的顯著成就并不是靠詳細的計算得來。那么,他是怎樣獲得成功的呢?玻爾本人強調,他的理論都是基于物理原理的一般特性,如構造學原理以及他最喜歡的理論工具——對應原理。他認為,理論的建立不能僅僅通過對經驗數據的歸納得來。但事實上,玻爾的元素周期系統理論很大程度上是基于化學和物理的經驗數據和事實;包括元素的原子體積、磁性和電化學性質,電離能、光學數據,和x射線光譜數據。如果他沒有扎實的無機化學基礎,可能也無法建立起原子模型。
當時許多物理學家和化學家認為玻爾通過量子理論已經推導出了元素的原子結構,但畢竟從量子理論。又經過一段時間,玻爾的理論才被認可為藝術精品,盡管其中含糊的存在一般物理學的原理和一些經驗數據,而且后者占比不少于前者。荷蘭物理學家亨德里克·克雷默斯(Hendrik Kramers),他是玻爾在1916年至1926年間的助理,他寫道,“在國外,許多物理學家認為當時玻爾的元素周期性理論是根據單個原子構造一個個計算得來的,而事實上,玻爾已經創建并闡述出了高端的光譜性質和化學性質的一角。”但不管怎么說,玻爾的理論只是短暫存在的,很快就被Edmund Stoner和泡利的優越理論取代了。
在化學上解釋得通,在物理上卻無法解釋
玻爾試圖將他的原子理論延伸到化學反應領域,收到許多化學家的不同回應。在理論建立后的第一年,大多數化學家都忽略它,可能他們覺得這個理論難以理解,而且對解決化學問題幫助不大。這個理論無法解釋碳原子的四面體構型原子中電子的雜化軌道,甚至對于簡單的氫分子也無法適用,這就更讓他們覺得這個理論在化學問題上沒什么作用。盡管如此,大約從1920年開始,許多無機和物理化學教科書上還是會簡要提到這個新原子理論。但是,1919年英國化學家威廉·劉易斯在他的一本叫《物理化學體系》的書中,詳細介紹了玻爾寫于1913年三部曲中的理論內容。
化學家們對玻爾的原子理論沒有任何好感,尤其是在1921年底理查德杜爾曼 (Richard Dolman)多倫多的演講中,稱玻爾的原子理論只是“所謂的量子理論”。作為一位杰出的物理化學家和理論物理學家(后來是相對論宇宙學中的權威),杜爾曼深諳原子的量子理論技術,但從化學家的角度來看,他認為這個理論仍缺乏說服力。“沒有化學家會認為碳原子是由帶正電的原子核和單軌道運動的核外電子組成,”他顯然沒有意識到玻爾的理論又做了新的拓展。在更基礎的層面上,他不贊同玻爾的理論基礎,特別是其對靜止狀態和量子跳躍的光譜發射機理的假設。如果電子不以相應頻率進行振動,原子又是怎樣發出單色光的呢?他代表化學家,表達了他們對玻爾理論的一致觀點“極端敵視物理學家,敵視他們荒謬的認為電子像在煎餅一樣的平面軌道運動的原子理論,鄙視他們按照自己的意愿去修改理論,想方設法讓維生素“h”進入了他們自己的重要器官,完全滿意,立體原子”。
杜爾曼提出的一些反對意見被美國其它物理化學家一再重復和放大,最有力的反對者當屬加州大學伯克利分校的吉爾伯特·劉易斯 (Gilbert Lewis),他認為波爾的理論與基本能量守恒原理相悖。盡管他如此批評玻爾的理論,他對于玻爾的想法還是非常感興趣的。早在1916年——當時玻爾在化學界還沒有什么名氣,化學家路易斯就邀請他來伯克利做講座。遺憾的是,玻爾當時不得不謝絕邀請。
主要是因為當時的化學家們覺得玻爾模型無法解釋分子的化合價和結構,在這方面他們認為還是不如朗繆爾(Langmuir)、劉易斯和其他一些人提出的化學模型。化學家們非常推崇立方原子模型,電子固定在立方體的角落,兩個原子之間有一對共用的電子,形成共價鍵。這樣,化學家可以初步通過化學事實來建立分子化合物的結構模型,但這樣也是有悖于原子和量子物理學的基本原理的。
現在的關鍵問題是,那些在化學上說得通的原理在物理上卻說不通。在立方原子模型中,原子是處于靜態的,但在玻爾原子模型中,原子是動態的。化學家們認為,一個電子在其軌道上高速運動,是不可能保持固定位置的。總之,大多數化學家認為有用的原子模型與玻爾和他同事在量子理論中覺得必要的標準相悖。雖然這樣的理由足夠讓物理學家們拋棄靜態模型,但是化學家們根據自己的研究需要,不愿意接受在物理學界被奉為宗旨的原子結構標準。在某種程度上,二十世紀二十年代早期,玻爾的動態原子論和化學界的靜態原子論的沖突本質上是基于兩種不同的科學文化:物理學家和化學家關于科學理論制定的標準沒有統一。
在這種大環境下,盡管劉易斯和朗繆爾的模型對解釋一些化學方面的問題可能很有幫助,玻爾沒有再花耐心去進行研究。他認為他們的模型只是一些描述性理論,缺乏物理根據。二十世紀二十年代初期見證了人們試圖協調統一靜態和動態模型的努力,特別是希望能把玻爾原子模型能對應運用到靜態原子中去。這期間出現了一些混合模型,共價鍵模型就是其中之一——兩個或多個原子共同使用它們的外層電子。雖然玻爾意識到所謂的 “盧瑟福—玻爾—劉易斯—朗繆爾原子”是比較受化學家認可的,但他依舊不愿意為化學方面而改變量子理論框架的相關內容。
即將來臨的量子化學
然而絕大部分的化學家認為玻爾的模型在原子價和分子領域是沒有價值的,他們更傾向于他有關周期性的理論。據物理化學的開拓者和1920年諾貝爾將得主瓦爾特·奈恩斯特 (Walther Nernst)所述,鉿元素的發現證明了玻爾理論在本質上是正確的。此外,玻爾的量子理論也證明了化學的分支——分子光譜研究的價值所在,這個分支也被認為是化學物理學。這類交叉學科領域后來慢慢變成二十世紀二十年代年早期研究的一個重要的分支,這在很大程度上歸功于玻爾的原子和分子結構理論和量子物理學。
雖然玻爾最開始和最富抱負的工程是想要確立關于原子和分子一般性理論——這對物理和化學都具有同樣重要的意義——最終失敗了,但這不無意義。從某些方面看,量子力學的出現和其后來二十世紀二十年代晚期發展成的量子化學也算實現了他的雄心壯志。
另一方面,物理學家們和化學家們之間的矛盾由于量子力學的出現而被加劇了。這個新理論不僅因為它的抽象性和數學復雜性讓化學家們感到費解,而且似乎也和以前的玻爾理論一樣在化學應用方面毫無建樹。量子化學的第一次突破性進展——由沃爾特·海特勒 (Walter Heitler)和弗里茨·倫敦(Fritz London)發表的關于H2(重氫)鍵的完整的量力力學形式的描述——是物理學家研究先進的理論物理的文化的產物,當時他們對結構化學的問題一無所知或者說毫不關心。倫敦對化學中的原子價模型嗤之以鼻。正如他給海特勒的那份帶著傲慢的信上所寫“化學家都是榆木腦袋,即使讓他感到很費解,他也需要循規蹈矩。”
直到二十世紀三十年代,鮑林(Linus Pauling)的重要研究工作才清楚的表明了化學事實和推理模式對量子化學的成功有著至關重要的作用。新一代的量子化學家們必須把他們自己從物理模式化的思考中解放出來并且為他們的學科創造出一個跨學科的框架。二十世紀二十年代,許多量子化學的先驅者都拜訪過玻爾協會,但是當量子化學興起時,玻爾和他的同仁們都沒有關注它的發展。
然而玻爾還是對這門學科非常熟悉,并且他也意識到它的重要意義。在1929年,當年輕的埃里希·休克爾(Erich Hückel)來到哥本哈根做量子力學研究時,是玻爾給他指導海特勒-倫敦理論并且建議他看下雙鍵。

