PATHFAST檢測系統(tǒng)檢測高敏感心肌肌鈣蛋白I的分析性能評價(jià)
唐紅霞,賈克剛,韓雪晶,何 聰,尚子軼,甄 利
(天津醫(yī)科大學(xué)泰達(dá)國際心血管病醫(yī)院檢驗(yàn)科,天津 300457)
急性心肌梗死(AMI)目前已成為最常見的心臟疾病。高敏心肌肌鈣蛋白是目前反映心肌損傷最敏感和最特異的生物學(xué)標(biāo)志物,廣泛用于AMI的早期診治[1]。即時(shí)檢驗(yàn)(POCT)平臺PATHFAST全自動(dòng)化學(xué)發(fā)光酶免疫分析儀(簡稱PATHFAST)檢測高敏心肌肌鈣蛋白I(hs-cTnI)因其快速和簡便易用而成為常用方法。該儀器使用了高靈敏度的化學(xué)發(fā)光酶免疫方法,以CDP-Star/Sapphire-Ⅱ?yàn)榛瘜W(xué)發(fā)光底物,采用磁珠分離純化技術(shù)。這樣未結(jié)合到磁珠上的非被檢物可以在一次性吸液管內(nèi)通過少量的緩沖液沖洗而被分離剔除來實(shí)現(xiàn)快速檢測。我們依據(jù)ISO15189《醫(yī)學(xué)實(shí)驗(yàn)室質(zhì)量和能力認(rèn)可》的要求[2],參考美國臨床和實(shí)驗(yàn)室標(biāo)準(zhǔn)化協(xié)會(huì)(CLSI)發(fā)布的 EP17-A、EP5-A2、EP6-A文件[3-5]、美國臨床實(shí)驗(yàn)室標(biāo)準(zhǔn)化委員會(huì)(NCCLS)C28-A2 文 件[6]和 傳 統(tǒng) 方 法[7-8],對PATHFAST進(jìn)行了分析性能驗(yàn)證。
材料和方法
一、對象
1.hs-cTnI低值樣品組 收集無心血管、肺、腎、肝、膽、胰等器質(zhì)性疾病;心電圖檢查均正常;均無急性炎癥;半年內(nèi)均無輸血和大手術(shù)史;血清肌酐和血脂正常;隨訪半年內(nèi)均無心血管事件發(fā)生的健康人群100名的血漿,年齡18~85歲,其中男65名,女35名,檢測10次取均值定值。
2.hs-cTnI高值樣品組 收集泰達(dá)國際心血管病醫(yī)院2011年9月至2012年3月急診和心血管疾病重癥監(jiān)護(hù)病房(CCU)住院AMI患者共100例的血漿,檢測10次取均值定值。AMI患者確診依據(jù)歐洲心臟病學(xué)會(huì)(ESC)、美國心臟病學(xué)會(huì)(ACC)、美國心臟協(xié)會(huì)(AHA)和世界心臟聯(lián)盟(WHF)2007年心肌梗死的診斷標(biāo)準(zhǔn)[9]。
二、方法
1.樣品采集 所有樣品采集后1 h內(nèi)分離血漿,-80℃保存,僅凍融1次。
2.儀器和試劑 PATHFAST及原裝配套hs-cTnI試劑盒(批號 E032)、cTnI校準(zhǔn)品(批號E032)由日本三菱化學(xué)(Mitsubishi Kagaku Iatron)公司生產(chǎn)。
3.功能靈敏度(FS)評估 收集AMI患者的hs-cTnI高值血漿樣品(cTnI濃度約1.0 ng/mL)3 mL,健康人hs-cTnI低值新鮮混合血漿40 mL。以1∶9的比例將高值樣品稀釋至0.10 ng/mL,共30 mL原液。檢測原液3次取均值,用原液配制出最終理論濃度(由高到低)分別為 0.10、0.09、0.08、0.07、0.06、0.05、0.04、0.03、0.02、0.01 ng/mL。將上述系列濃度血漿各分裝10套,-80℃冷凍保存至分析。每天檢測1套系列濃度血漿,由同一名操作熟練的工作人員連續(xù)檢測10 d,計(jì)算天間變異系數(shù)(CV),以hs-cTnI系列濃度為橫坐標(biāo)、CV為縱坐標(biāo)作圖,求取CV=10%時(shí)的 hs-cTnI濃度值,設(shè)為該方法的 FS[8]。
4.精密度評估 參照CLSI EP5-A2文件評估精密度。用健康人hs-cTnI低值新鮮混合血漿稀釋hs-cTnI高值樣品,配制濃度分別為0.025 ng/mL(L)、0.65 ng/mL(M)和2.65 ng/mL(H)的樣品,各分裝10套,-80℃冷凍保存至分析。1 d內(nèi)由1名操作熟練的工作人員連續(xù)檢測20次,評估批內(nèi)不精密度(CV)。每天取出L、M、H各1套,早晚各檢測1次,由同一名操作熟練的工作人員連續(xù)檢測10 d,評估批間不精密度。分別計(jì)算批內(nèi)、批間檢測值的均值()、標(biāo)準(zhǔn)差(s)及CV。
5.空白限(LoB)評估 參照CLSI EP17-A文件確定LoB。每天上、下午各測定一批空白樣品(S0或樣品稀釋液),每批重復(fù)測定3次,由同一名操作熟練的工作人員連續(xù)10 d,共獲得60個(gè)測量結(jié)果。因儀器直接報(bào)告的是濃度值,hs-cTnI在低濃度時(shí)往往不呈正態(tài)分布,故采用非參數(shù)方法估計(jì)第95百分位數(shù),即將數(shù)據(jù)由小到大排列,第95百分位數(shù)所在位置為空白樣品總數(shù)×(95/100)+0.5。
6.檢出限(LoD)評估 參照CLSI EP17-A文件確定 LoD。用樣品稀釋液對 cTnI濃度為0.1 ng/mL的新鮮血漿做系列稀釋,配制成一系列低濃度樣品,其理論濃度分別為0.002、0.004、0.006、0.008、0.010、0.020、0.030、0.040 ng/mL,介于預(yù)期檢測限濃度的1~4倍。系列低濃度樣品每天上、下午各檢測1次,由同一名操作熟練的工作人員連續(xù)檢測5 d,共獲得80個(gè)測量結(jié)果。因低濃度檢測數(shù)值常呈非正態(tài)分布,故采用非參數(shù)方法確定 LoD。LoD=LoB+DS·β,式中 DS·β是低濃度樣品測定中位數(shù)和第5個(gè)百分位數(shù)的間距,中位數(shù)=檢測樣品總數(shù)×0.5+0.5,第5百分位數(shù)的值=檢測樣品總數(shù)×0.05+0.5。
7.定量檢測限(LoQ)評估 參照CLSI EP17-A文件,依據(jù)臨床要求和室間質(zhì)量評價(jià)的允許誤差,設(shè)定本實(shí)驗(yàn)室hs-cTnI的總誤差目標(biāo),在不考慮分析偏差的條件下,總誤差=2CV,如果低濃度樣品的CV≤1/2總誤差,則LoQ=LoD。
8.傳統(tǒng)方法評估檢測低限(LLD)LLD為樣品單次檢測可以達(dá)到的檢測相應(yīng)量對應(yīng)的分析物量。按照國際純粹和應(yīng)用化學(xué)聯(lián)合會(huì)的規(guī)定,在測量置信水平為99.7%時(shí),方法的LLD由公式LLD=S0+3s空白計(jì)算,式中s空白為10次空白測定的s。
9.傳統(tǒng)方法評估生物檢測限(BLD) 在測量置信水平為99.7%且低濃度樣品的檢測相應(yīng)量都比空白檢測相應(yīng)量大時(shí),樣品中所具有的分析物濃度即為BLD。在系列低濃度實(shí)驗(yàn)樣品中,某濃度的測定值均值減去3倍該樣品濃度值的s,剛大于LLD值時(shí)對應(yīng)的濃度即為BLD。
10.線性范圍評估 參照CLSI EP6-A文件中對線性評價(jià)實(shí)驗(yàn)的要求,取高濃度值cTnI樣品和正常人血漿樣品各1 份,按照1∶3、2∶2、3∶1 的比例混合,分別編號,隨機(jī)排列重復(fù)測定2次,計(jì)算平均值作為最終的測定值,與設(shè)定值做線性對比。
11.生物參考區(qū)間驗(yàn)證 按NCCLS C28-A2推薦方法,選擇健康參考個(gè)體20名,采集符合要求的樣品,按儀器標(biāo)準(zhǔn)操作程序(SOP)要求進(jìn)行規(guī)范檢測并對檢測結(jié)果進(jìn)行逐一驗(yàn)證是否落在現(xiàn)用參考區(qū)間內(nèi)。
三、統(tǒng)計(jì)學(xué)方法
結(jié) 果
一、FS評估
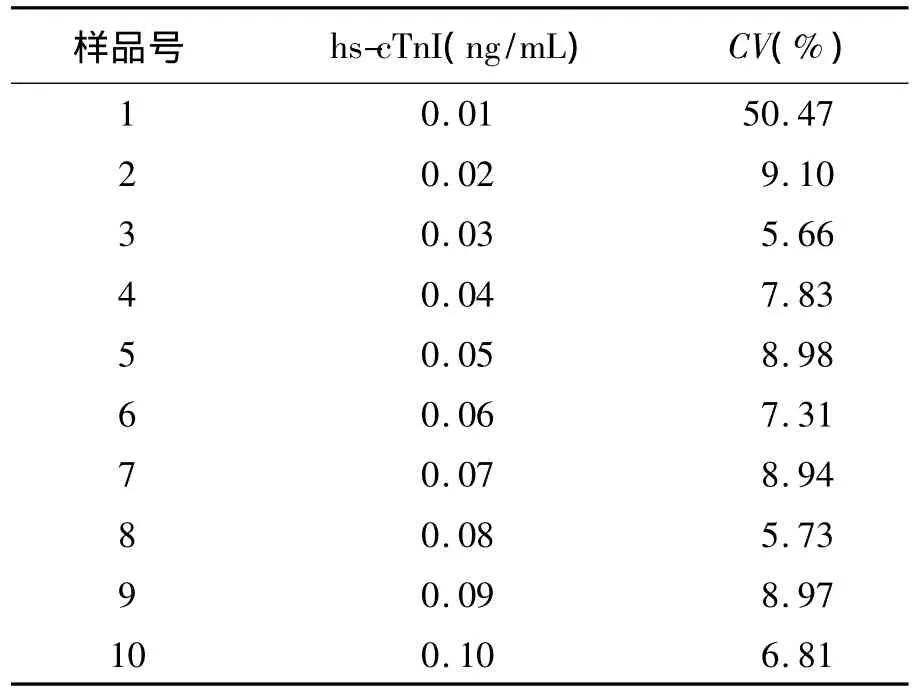
表1 hs-cTnI低濃度樣品測定結(jié)果及CV
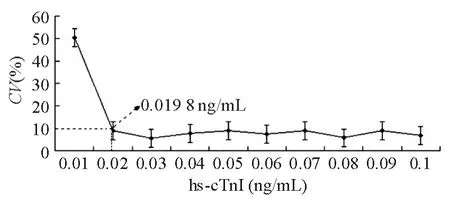
圖1 hs-cTnI檢測濃度與CV的關(guān)系
二、精密度評估
高、中、低3個(gè)濃度混合血漿批內(nèi)、批間檢測不精密度結(jié)果見表2。高值樣品(2.65 ng/mL)批內(nèi)CV和批間CV分別為4.70%、5.05%,中值樣品(0.65 ng/mL)批內(nèi) CV和批間 CV分別為5.16%、5.23%。將低值樣品濃度配制到接近廠商聲明的第99百分位值(0.02 ng/mL),其批內(nèi)和批間 CV 分別為5.30%、6.07%。
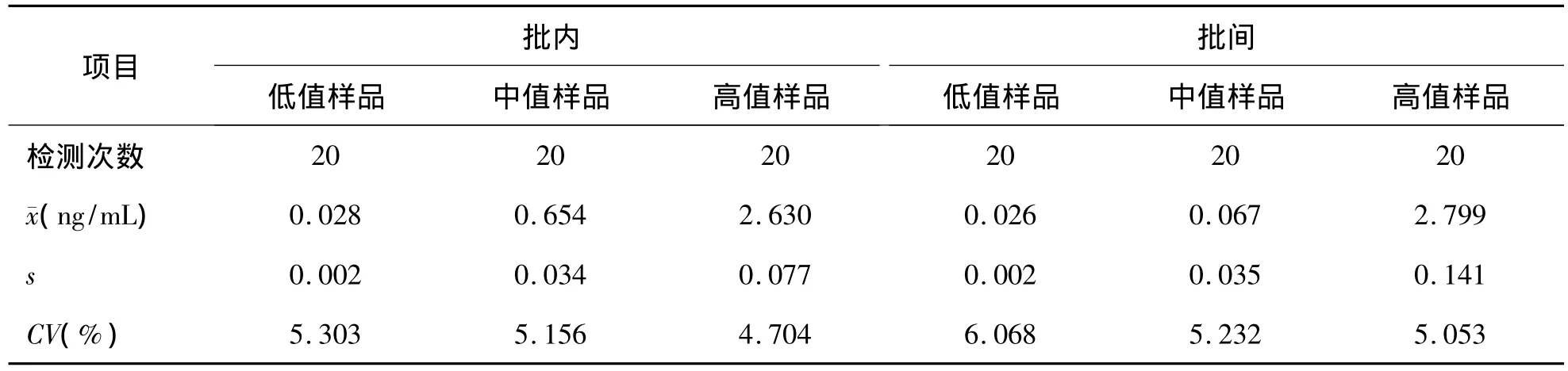
表2 hs-cTnI方法批內(nèi)、批間檢測不精密度
三、LoB、LoD、LoQ、LLD、BLD 結(jié)果
1.LoB 空白樣品的檢測結(jié)果呈非正態(tài)分布,故用非參數(shù)程序估計(jì)LoB,即估計(jì)第95分位數(shù)的值,LoB=[Nβ(ρ/100)+0.5]=[60 ×(95/100)+0.5]=57.5位置的結(jié)果,即第57和第58個(gè)觀察值的均數(shù)。將60個(gè)空白檢測值由小到大排序,第57和第58位置均為0.001 ng/mL,故LoB=0.001 ng/mL。見表 3。
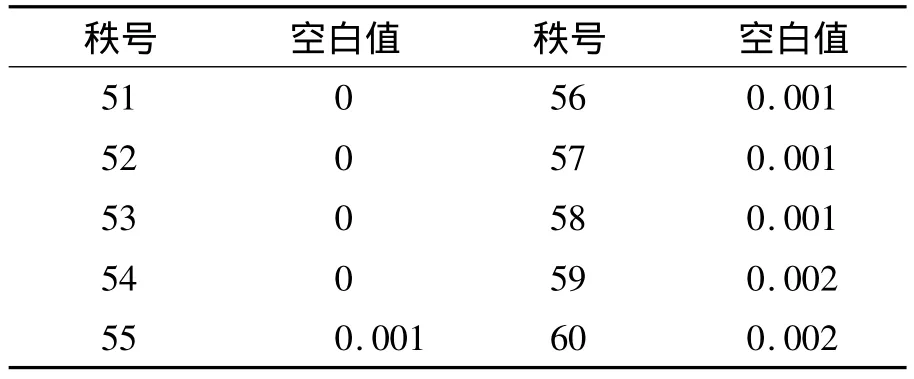
表3 60個(gè)空白值中最高的10個(gè)值 (ng/mL)
2.LoD 系列低濃度樣品測定結(jié)果見表4。80個(gè)低濃度樣品檢測結(jié)果呈非正態(tài)分布,使用非參數(shù)程序估計(jì) LoD,即:LoD=LoB+DS·β,式中DS·β是低濃度樣品測定中位數(shù)和第5個(gè)百分位數(shù)的間距,低濃度樣品中位數(shù)=(80×0.5+0.5)=40.5,中位數(shù)值為0.009,第5個(gè)百分位數(shù)的值 =(80× 0.05+0.5)=4.5,第 4.5 秩號的值為0.002,DS·β=0.009 - 0.002=0.007,故 LoD=LoB+DS·β=0.007+0.001=0.008 ng/mL。
3.LoQ 本實(shí)驗(yàn)室依據(jù)臨床需求及權(quán)威機(jī)構(gòu)規(guī)定的分析質(zhì)量要求,設(shè)定化學(xué)發(fā)光免疫法檢測cTnI的總誤差目標(biāo)為10%,在不考慮分析偏差的情況下,允許總誤差(TEa)=2CV,即 CV=1/2TEa。hs-cTnI在0.008 ng/mL時(shí)檢測的日間CV為9.34%,<10%,符合質(zhì)量目標(biāo)要求。因此LoQ=LoD=0.008 ng/mL。見表5。
5.BLD 0.004 ng/mL實(shí)驗(yàn)樣品的濃度減3s后為0.0029 ng/mL,剛高于 LLD對應(yīng)的濃度0.001 ng/mL,故 PATHFAST 檢測 hs-cTnI的生物檢測限為 0.002 ~0.004 ng/mL。見表 6。
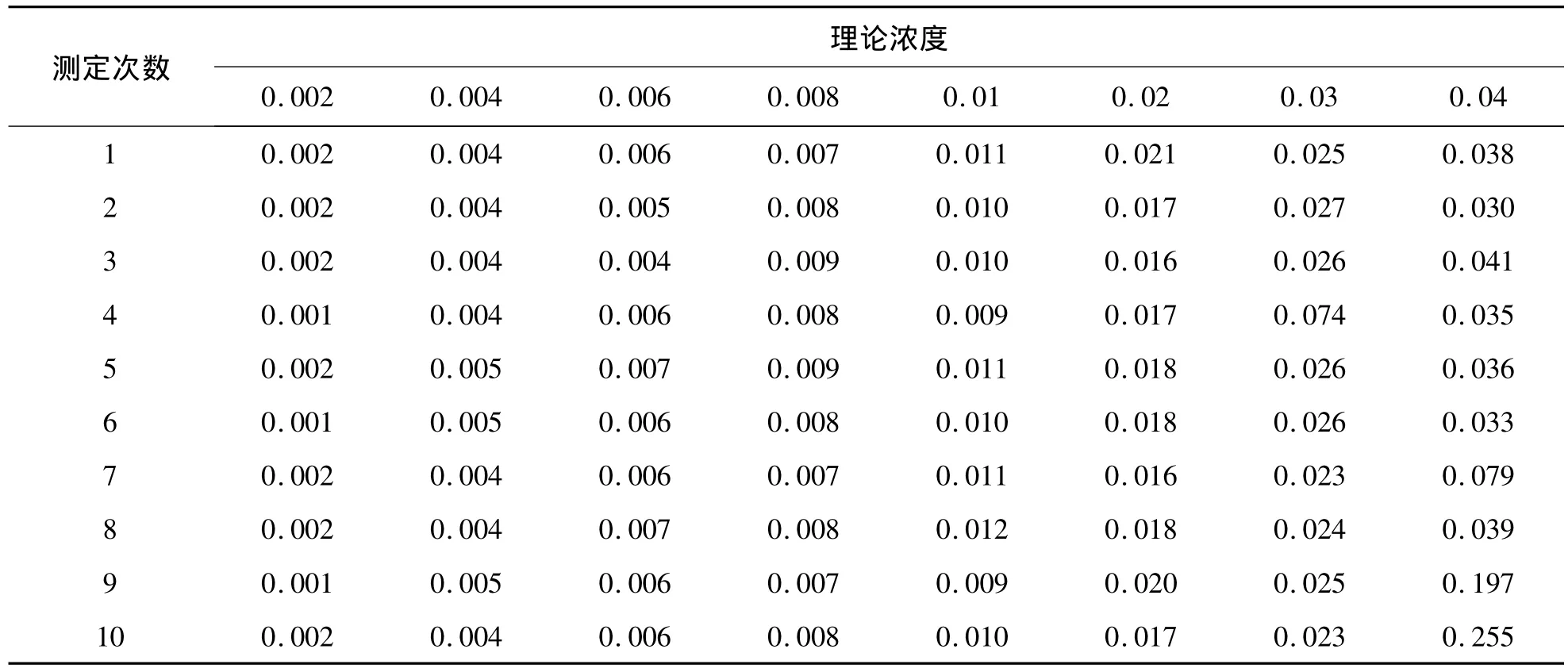
表4 系列低濃度cTnI樣品測定結(jié)果 (ng/mL)
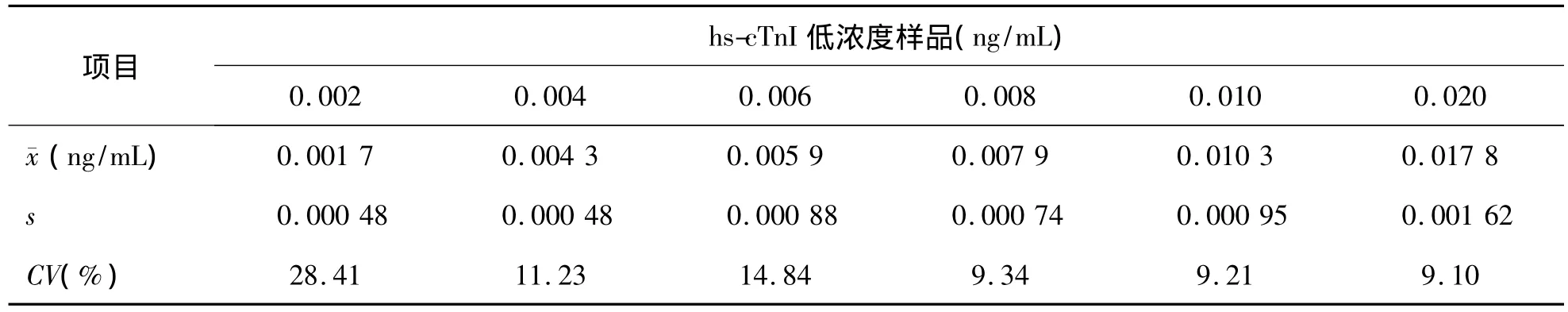
表5 hs-cTnI低濃度樣品的日間CV
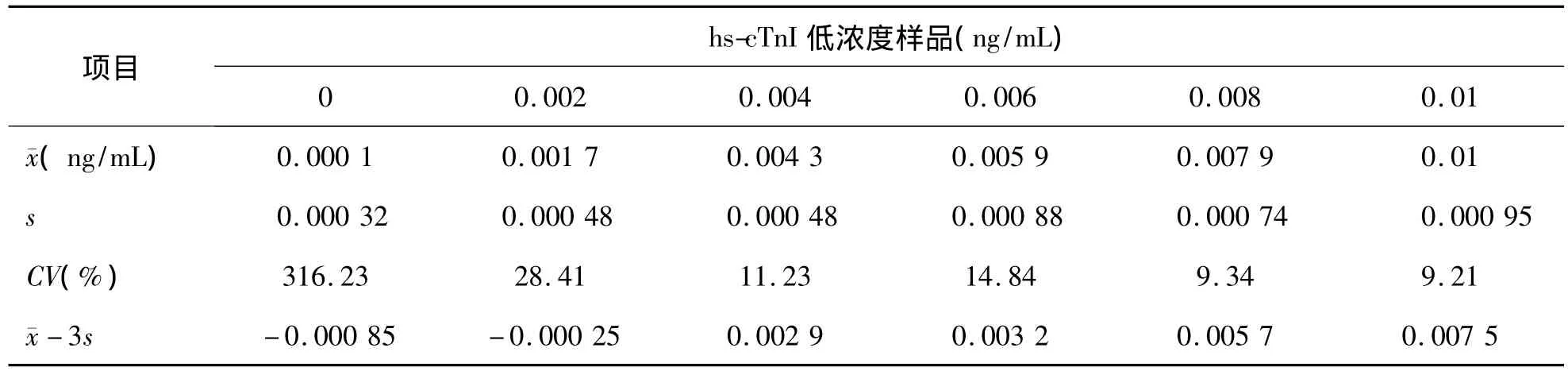
表6 hs-cTnI低濃度樣品測定結(jié)果及BLD
四、線性范圍
將平均值作為最終的測定值,與設(shè)定值做線性對比,線性方程為 Y=1.015X+0.152,R2=0.993。各測定樣品濃度見表7,線性曲線見圖2。
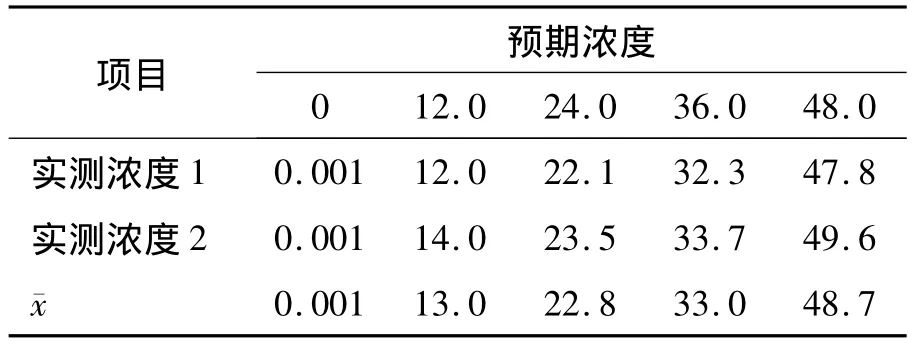
表7 線性范圍各濃度cTnI樣品的測定值(ng/mL)
五、生物參考區(qū)間的驗(yàn)證
按NCCLS C28-A2推薦方法,驗(yàn)證現(xiàn)用廠家提供的生物參考區(qū)間。結(jié)果顯示95%的健康個(gè)體(19名)的檢測結(jié)果落在現(xiàn)用參考區(qū)間內(nèi),不超過5%(1名)健康個(gè)體的檢測結(jié)果落在現(xiàn)用參考區(qū)間外,說明廠家提供的生物參考區(qū)間有效,適合本實(shí)驗(yàn)室。各健康個(gè)體樣品濃度詳見表8。
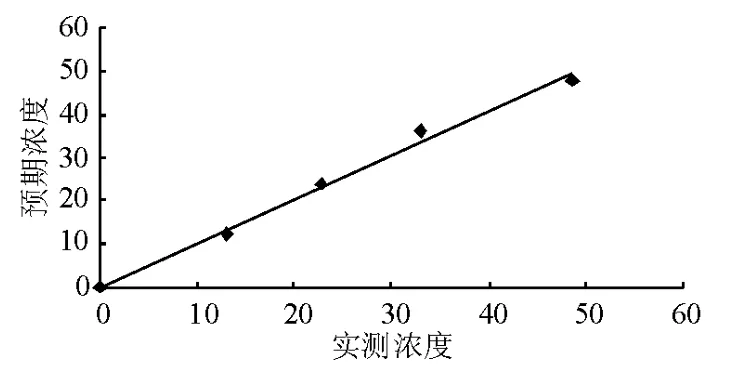
圖2 PATHFAST檢測hs-cTnI的線性圖
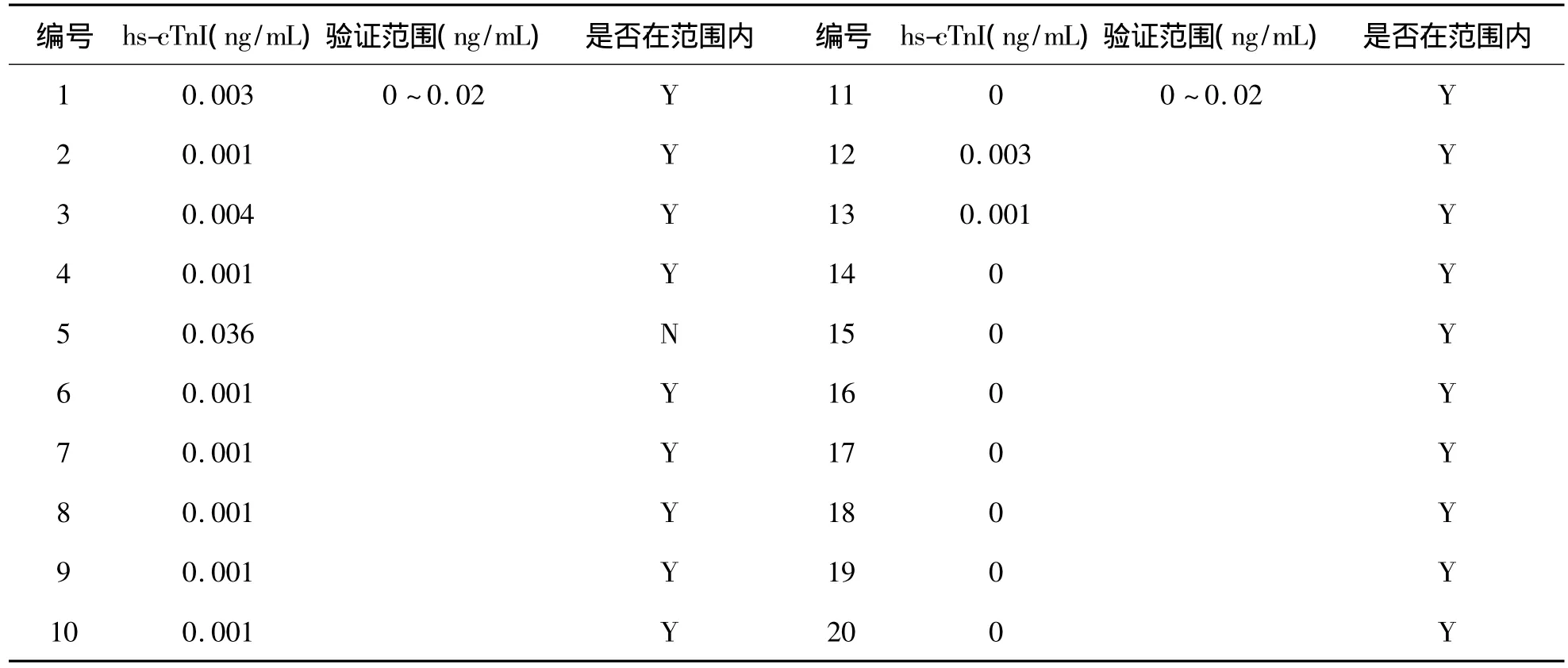
表8 20名健康參考個(gè)體hs-cTnI檢測濃度值
討 論
心肌肌鈣蛋白I(cTnI)是心肌損傷的特異性標(biāo)志物。cTnI檢測方法的分析性能對準(zhǔn)確檢測和評估cTnI水平及臨床診斷心肌損傷至關(guān)重要[1]。POCT平臺PATHFAST主要用于床邊快速定量檢測hs-cTnI。在使用前對儀器的主要性能進(jìn)行驗(yàn)證,是保證檢驗(yàn)質(zhì)量的一個(gè)重要措施,這也是實(shí)驗(yàn)室認(rèn)可的要求。因此本研究對PATHFAST檢測hs-cTnI的分析性能進(jìn)行了評價(jià)。
本研究結(jié)果顯示高值樣品(2.65 ng/mL)批內(nèi)CV和批間CV分別為4.70%、5.05%,中值樣品(0.65 ng/mL)批內(nèi) CV和批間 CV分別為5.16%、5.23%,低值樣品 (0.025 ng/mL)批內(nèi)CV和批間CV分別為5.30%、6.07%。Francesca等[10]依據(jù)CLSI EP5-A方案檢測40個(gè)樣品得出PATHFAST檢測 hs-cTnI樣品濃度為3.1 ng/mL時(shí)的批內(nèi)CV和批間CV分別為5.10%、6.0%,樣品濃度為0.66 ng/mL時(shí)的批內(nèi)CV和批間CV分別為5.80%、6.30%,其兩濃度水平的批內(nèi)、批間不精密度與本研究結(jié)果較為相似。而廠商提供的高值樣品(2.22 ng/mL)的批內(nèi)CV和批間CV分別為2.8%、3.1%,低值樣品(0.09 ng/mL)的批內(nèi)CV和批間CV分別為3.7%、3.9%。本研究結(jié)果高于廠商說明書所提供的CV值,這與本研究納入樣品例數(shù)較少有一定關(guān)系,也可能是POCT分析儀本身檢測的加樣隨機(jī)性大、試劑均一性差等導(dǎo)致的重復(fù)性差[11]所致。
文獻(xiàn)[12]報(bào)道,只有當(dāng)檢測CV<生物學(xué)變異1/2時(shí)才具有相應(yīng)的臨床意義。根據(jù)文獻(xiàn)[8]對促甲狀腺素FS的評價(jià),其是檢測系統(tǒng)或方法可定量報(bào)告分析物的具有臨床意義的最低濃度。心肌肌鈣蛋白(cTn)也引人了FS的概念,參照其他心臟標(biāo)志物將CV≤10% 時(shí)濃度的最低檢測限值作為cTn的FS[13],并采用了更符合臨床實(shí)際檢測狀況的以批間不精密度為基礎(chǔ)的評價(jià)FS的方法,對hs-cTnI的FS進(jìn)行了評估。FS代表的是一個(gè)定量的可報(bào)告低限。這個(gè)值一般要比檢測低限高,區(qū)分從有到無的分析能力,由于其反映了實(shí)際檢測中的靈敏度,所以更有臨床價(jià)值[7]。本研究結(jié)果顯示CV=10%的最低濃度值為0.0198 ng/mL(見圖1),與廠商說明書提供的0.02 ng/mL基本相符,與Francesca等[9]檢測系列低濃度樣品得出PATHFAST檢測 hs-cTnI的 FS為0.02 ng/mL也基本一致。蔡迪婭等[14]對 ADVIA Centaur檢測系統(tǒng)檢測hs-cTnI的FS進(jìn)行研究得出其FS為0.042 ng/mL,結(jié)果顯示 PATHFAST檢測 hs-cTnI的FS低于ADVIA Centaur檢測系統(tǒng)的FS。
本研究參照 CLSI EP17-A文件確定的LoB、LoD 及 LoQ 分別為 0.001、0.008、0.008 ng/mL。參照溫冬梅等[7]用CLSI EP17-A文件建立的AFP的LoB、LoD、LoQ并對其數(shù)據(jù)作出的解釋,本研究結(jié)果顯示PATHFAST在符合質(zhì)量要求的情況下能可靠地檢出hs-cTnI的最低實(shí)際濃度為0.008 ng/mL。本研究用PATHFAST檢測hs-cTnI報(bào)告時(shí),若hs-cTnI結(jié)果低于0.001 ng/mL,則應(yīng)報(bào)告“分析物未檢出,濃度 <0.001 ng/mL”;若 hscTnI檢測結(jié)果 >0.001 ng/mL 且 <0.008 ng/mL,則應(yīng)報(bào)告“有分析物檢出,但不能準(zhǔn)確定量,濃度<0.008 ng/mL”;若 hs-cTnI>0.008 ng/mL,則直接報(bào)告檢測結(jié)果。臨床醫(yī)生可放心使用濃度高于0.008 ng/mL的hs-cTnI結(jié)果。而廠商說明書只提供了一個(gè)籠統(tǒng)的檢測限0.02 ng/mL,對報(bào)告臨床結(jié)果不夠詳細(xì)。而 Francesca等[9]依據(jù) CLSI EP-17A文件得出PATHFAST檢測hs-cTnI的LoB和 LoD 分別為0.0048和0.0066 ng/mL,兩者有一定的出入,這可能是在低濃度樣品濃度的選擇上不同所造成的。
本研究參照常規(guī)方法[7-8]確定的 LLD為0.001 ng/mL,BLD 為 0.002 ~ 0.004 ng/mL。國內(nèi)外未見有PATHFAST的相關(guān)報(bào)道。常規(guī)方法使用光強(qiáng)度值(RLUs)來計(jì)算,但目前實(shí)驗(yàn)室部份儀器存在局限性,即只能報(bào)告分析物的濃度,而沒有原始的分析信號。所以常規(guī)方法不適用于實(shí)驗(yàn)室對所有儀器的靈敏度進(jìn)行評價(jià)。本研究評估的PATHFAST無法讀出光強(qiáng)度值(RLUs),參照文獻(xiàn)[15]用濃度直接計(jì)算得出的LLD與LoB數(shù)值一致,而BLD<LoD。參照CLSI EP17-A文件確定的LoB、LoD和LoQ是直接使用檢測出的分析物濃度進(jìn)行計(jì)算,符合實(shí)驗(yàn)室的實(shí)際情況,統(tǒng)計(jì)分析輸入檢測數(shù)據(jù)時(shí)簡便易行。
由于廠商提供的PATHFAST檢測上限為50 ng/mL,因此本研究評估線性范圍時(shí)選取的高濃度值樣品濃度為48 ng/mL,低值為正常人樣品,按比例稀釋重復(fù)測定后做線性回歸分析得出預(yù)期濃度和實(shí)測濃度的線性方程為Y=1.015X+0.152,R2=0.993,與 Francesca 等[10]根據(jù) EP6-A選取高值樣品(42 ng/mL)按比例稀釋得出的R2(0.995)基本一致。同時(shí)本研究按NCCLS C28-A2推薦的方法,驗(yàn)證了生物參考區(qū)間。結(jié)果顯示,>95%的檢測結(jié)果在現(xiàn)用參考區(qū)間以內(nèi),≤5%的檢測結(jié)果在現(xiàn)用參考區(qū)間以外,判定廠家提供的生物參考區(qū)間(<0.02 ng/mL)適用于本實(shí)驗(yàn)室,可以繼續(xù)使用。
本研究由于試劑成本過高,目前未對儀器的第99百分位值和樣品檢測陽性符合率進(jìn)行研究,希望下一步能對第99百分位值及陽性符合率進(jìn)行深入的探討。
綜上所述,參照CLSI EP系列文件及常規(guī)方法對PATHFAST檢測系統(tǒng)檢測cTnI分析性能進(jìn)行了驗(yàn)證,其可為臨床提供準(zhǔn)確可靠的hs-cTnI結(jié)果,為心肌損傷的臨床診治提供重要信息。
[1]鄢盛愷.高敏感心肌肌鈣蛋白檢測的臨床應(yīng)用[J].中華檢驗(yàn)醫(yī)學(xué)雜志,2010,33(9):809-813.
[2]中國國家實(shí)驗(yàn)室國家認(rèn)可委員會(huì).醫(yī)學(xué)實(shí)驗(yàn)室質(zhì)量和能力認(rèn)可的要求[S].ISO15189,中國國家實(shí)驗(yàn)室國家認(rèn)可委員會(huì),2007.
[3]National Committee for Clinical Laboratory Standards.Protocols for determination of limits of detection and limits of quantitation;approved guideline[S].EP17-A,NCCLS,2004.
[4]National Committee for Clinical Laboratory Standards.Evaluation of precision performance of quantitative measurement methods;approved guideline-second edition[S].EP5-A2,NCCLS,2004.
[5]National Committee for Clinical Laboratory Standards.Evaluation of the linearity of quantitative analytical method:a statistical approach:approved guideline[S].EP6-A,NCCLS,2003.
[6]National Committee for Clinical Laboratory Standards.How to define and determine reference intervalsin clinical laboratory;approved guideline-second edition[S].C28-A2,NCCLS,2000.
[7]溫冬梅,張秀明,王偉佳,等.化學(xué)發(fā)光免疫法檢測AFP的空白限、檢出限和定量檢測限的建立與評價(jià)[J].臨床檢驗(yàn)雜志,2010,28(6):469-471.
[8]杜彥丹,孫 剛,孫 輝,等.Roche E2010檢測系統(tǒng)測定促甲狀腺激素(TSH)分析靈敏度與功能靈敏度的驗(yàn)證[J].內(nèi)蒙古醫(yī)學(xué)雜志,2010,42(5):568-570.
[9]Gualandro DM,Caramelli B,Yu PC,et al.Perioperative myocardial infarction has been forgotten[J].J Am Coil Cardiol,2008,51(18):1825-1826.
[10]Di Serio F,Caputo M,Zaninotto M,et al.Evaluation of analytical performance of the Pathfast cardiac troponin I[J].Clin Chem Lab Med ,2009,47(7):829-833.
[11]從玉隆.POCT的臨床應(yīng)用與存在的問題[J].中華檢驗(yàn)醫(yī)學(xué)雜志,2007,30(12):1325-1328.
[12]Sadler WA,Murray LM,Turner JG.What dose"functional sensitivity"mean[J].Clin Chem,1996,42(12):2051-2052.
[13]宋凌燕,吳 炯,宋斌斌,等.高敏感方法檢測心肌肌鈣蛋白T的分析性能評價(jià)[J].中華檢驗(yàn)醫(yī)學(xué)雜志,2010,33(9):814-818.
[14]蔡迪婭,邱曉明,蘇月梅,等.ADVIA Centaur超敏肌鈣蛋白I測試法的性能分析及臨床應(yīng)用評價(jià)[J].天津醫(yī)藥,2011,39(12):1160-1161.
[15]田秀俊.參照EP方案在不同檢測系統(tǒng)評價(jià)尿微量白蛋白試劑的分析性能[J].醫(yī)學(xué)檢驗(yàn)與臨床,2010,21(1):17-19.
[16]La'ulu SL,Roberts WL.Performance characteristics of five cardiac troponin I assays[J].Clin Chim Acta,2010,411(15-16):1095-1101.
[17]Panteghini M,Pagani F,Yeo KT,et al.Evaluation of imprecision for cardiac troponin assays at low-range concentrations[J].Clin Chem,2004,50(2):327-332.
[18]Casals G,F(xiàn)ilella X,Augé JM,et al.Impact of ultrasensitive cardiac troponin I dynamic changes in the new universal definition of myocardial infarction[J].Am J Clin Pathol,2008,130(6):964-968.

