蛋白質的連接模型及機理研究
楊力權,桑 鵬,李珍貴
(1.大理學院農學與生物科學學院,云南 大理 671003;2.云南大學云南省生物資源保護與利用重點實驗室,云南 昆明 650091)
自然界中蛋白質發揮功能的過程其實就是蛋白質之間或蛋白質與其他生物分子連接和相互作用的過程。因此,闡明蛋白質-配體識別與連接的驅動力及機理對于理解其功能發揮起到非常重要的作用。
1 蛋白質連接的模型
目前,描述蛋白質連接機理的模型主要有以下三種:鎖-鑰匙模型 (lock-and-key)[1],誘導契合模型 (induced-fit)[2]和構象選擇模型 (conformational selection)[3](如圖1所示)。
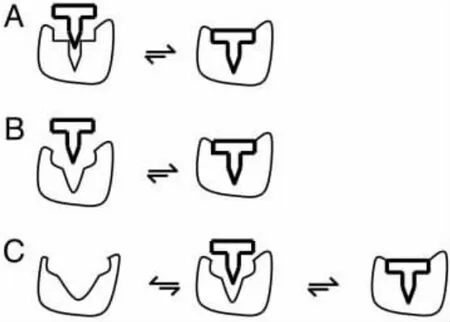
圖1 蛋白質-配體連接模型
此圖引用并修改于參考文獻[3]。
1.1 鎖-鑰匙模型和誘導契合模型
在鎖-鑰匙模型中,蛋白質連接部位 (比喻為鎖)和配體 (比喻為鑰匙)的結構必須是高度互補的,而且蛋白質和配體的結構是剛性的,以保證正確的匹配和連接 (如圖1A所示)。在誘導契合模型中,配體的結合能夠誘導蛋白質連接部位構象發生變化,使連接部位甚至于整個蛋白質的結構不同于連接前的結構 (如圖1B所示)。誘導契合發生的前提是蛋白質的連接部位必須有足夠的構象靈活性。
1.2 構象選擇模型
構象選擇模型是基于自由能圖景理論[4]提出的,自由能圖景理論已經被廣泛用于描述蛋白質的折疊[5],并且逐漸用于描述蛋白質的連接[6]。自由能圖景理論描述了蛋白質折疊和連接過程中體系的能量變化與蛋白質構象的關系,三維空間下的自由能圖景,縱坐標代表了體系的吉布斯自由能,橫坐標代表了蛋白質構象的熵。在蛋白質的自由能圖景理論下,連接過程中體系自由能的不斷降低伴隨著連接中間體構象自由度的逐漸減少,決定了蛋白質連接的自由能圖景為漏斗狀的,稱為連接漏斗[5]。
在漏斗狀的自由能圖景理論中,蛋白質的連接過程被描述為發生在粗糙的漏斗底部的過程,表現為漏斗底部自由能井的熔合 (蛋白質之間連接)[6]或者漏斗底部自由能井的延伸 (蛋白質與配體連接)[7]。而且,自由能圖景底部是粗糙的和動態可變的,也就是說,在天然構型附近存在著多種能量相近、構象不同的構象并存平衡,當有影響體系自由能改變的條件時,構象之間可以發生相互轉換,能量圖景的形狀會隨之發生變化。
構象選擇模型認為不同的構象并存平衡于粗糙的自由能圖景底部,連接過程中配體選擇最合適的構象進行連接,使得構象平衡朝向連接的構象移動[5,8](如圖1C所示)。與誘導契合模型相似,構象選擇模型適合于構象靈活性較高的蛋白質,高靈活性可以降低構象間的能壘,增加配體選擇合適構象及構象轉換 (平衡移動)的幾率。
1.3 幾種模型之間的聯系
在自由能圖景理論下,鎖-鑰匙模型和誘導契合模型都可以看作是構象選擇模型的特例。例如,構象選擇模型雖然描述多種構象存在于漏斗底部粗糙的多個能量井中達到共存平衡,但連接的過程只是選擇性的發生在最適合構象所存在的唯一能量井中,隨后才導致構象平衡朝向復合物形成的構象移動。選擇連接的過程與鎖-鑰匙模型描述的過程相似[5,8]。對于誘導契合模型,雖然連接后的最終構象與連接前的不一樣,但最初的選擇接觸碰撞過程決定了只有接近構象互補的狀態才能保證提供足夠的連接強度和時間,使得形成的中間體內進一步調整,最終形成連接復合物。因此,最初的碰撞選擇是隨后的構象調整變化的前提,從這個角度講,誘導契合模型也可以被認為是構象選擇模型的特例。
總的說來,這三種模型并不是孤立存在、相互排斥的,它們在蛋白質分子識別和連接過程中發揮著聯合的作用[5,8]。由于構象選擇模型包含了鎖-鑰匙模型和誘導契合模型,在解釋蛋白質-配體連接過程中更加全面和合理。在這個模型中,最初的構象選擇過程 (通過鎖-鑰匙)對于相互作用分子最初的識別接觸非常重要,決定了連接的特異性;隨后的構象調整過程(通過誘導契合)決定了連接的親和性。
2 蛋白質連接過程的驅動力
雖然蛋白質與配體的連接過程可以用前述的三個模型來解釋,但進一步闡明蛋白質-配體連接過程的驅動力對于理解三個模型的機理有很大幫助。
2.1 連接過程的基本熱力學屬性
與蛋白質折疊過程相似,蛋白質-配體連接過程的驅動力也是蛋白質-配體-溶劑體系吉布斯自由能的降低[5]。在蛋白質-配體連接過程中,體系的吉布斯自由能 (△G),一般可以通過如下的方程表示:

其中,焓變部分 (△H)來源于連接過程中蛋白質-配體-溶劑之間非共價鍵 (如氫鍵、范德華力、靜電作用等)的形成與斷裂;熵變部分 (△S)來源于所有溶劑分子、蛋白質分子和配體分子的構象變化。
正如方程 (1)所描述,體系吉布斯自由能的變化受焓變 (△H)和熵變 (T△S)共同影響,它們對自由能具有相反的影響效果。在連接過程中,負的焓變值意味著發生了放熱反應,對降低體系自由能有利;正的焓變值意味著吸熱反應,不利于自由能的降低。需要注意的是,連接過程的焓變是整個體系全局性的特性,包含了蛋白質與配體、蛋白質與溶劑、配體與溶劑的相互作用。例如,蛋白質-溶劑,配體-溶劑之間的氫鍵、靜電作用、范德華力的斷裂需要吸收能量,導致體系焓變增加 (△H為正值);在蛋白質表面附近發生的蛋白質-配體-溶劑之間非共價鍵的形成釋放能量,導致體系焓變減少 (△H為負值)。連接過程的焓變是這些具體焓變的綜合效應,具體的連接控制著具體的焓變。
熵是蛋白質-配體-溶劑體系中能量平均分布的一個程度,能量在體系中盡可能平均分布的趨勢會降低最初體系的有序程度,因此,熵也可以看作是體系混亂度和無序程度的一個體現。在連接過程中,熵增加對于降低體系吉布斯自由能有利,熵減少不利于降低自由能。由于蛋白質連接過程體系的復雜性,體系總的熵變 (△Stot)包含三個方面:溶劑熵變 (△Ssolv),構象熵變 (△Sconf),旋轉和轉換熵變 (△Sr/t)[5,8]。

其中,溶劑熵變 (△Ssolv)是連接過程釋放了與結合部位相連的溶劑分子引起的,溶劑分子(水)的混亂度增加,連接過程中的熵增加,對總熵變 (△Stot)增加有利。構象熵變 (△Sconf)是由于在連接過程中蛋白質與配體圍繞旋轉角度的旋轉自由度降低引起的,熵減少,不利于總熵變的增加;旋轉和轉換熵變 (△Sr/t)是由于復合物的形成導致蛋白質與配體的轉換和旋轉的自由度降低引起的,同樣不利于總熵變的增加。由于熵減少會使自由能增加,對連接不利,因此構象熵變、旋轉和轉換熵變也被稱為熵損失[5]。然而,連接過程使連接部位表面緊密存在的水分子網絡得到釋放,增加了水分子 (溶劑)的自由度,由于水分子巨大的數量產生了大量的熵增加值,能夠克服和抵消由于構象熵變、旋轉和轉換熵變帶來的不利影響,使得總熵變值增加,有利于體系總的吉布斯自由能降低[8]。
2.2 熵焓互補平衡
值得注意的是,方程 (1)所描述的焓變和熵變之間的線性關系導致了一個重要的現象——熵焓互補[9]。換句話說,有利于連接的焓變 (△H為負)(如蛋白質和配體間非共價鍵的形成)不可避免的會帶來不利于連接的熵變 (△S為負)(如非共價鍵的形成帶來的構象自由度的降低);反過來,連接過程產生的有利的熵變 (△S為正)也不可避免的會帶來不利的焓變 (△H為正),這個過程導致了連接過程的自由能會有變化和波動,造成體系吉布斯自由能的升高或降低。這種熵焓互補決定連接過程自由能變化的特征,使得很難區分特定配體的連接過程到底是焓驅動還是熵驅動,也使得希望通過修飾配體的結構增強連接的特異性和親和性變得很困難。
3 不同連接過程的連接機理
區分一個連接過程具體是由熵增加驅動、焓減少驅動還是熵增加和焓減少共同驅動對于理解連接的機理有極大的幫助。這里并不針對具體的配體和具體的蛋白受體討論連接過程,而作為一般性討論三種模型的連接機理及具體驅動因素。
3.1 鎖-鑰匙連接的機理
對于鎖-鑰匙連接過程的機理,由于蛋白質和配體連接部位結構的高度互補性,連接過程釋放了結合部位表面的大量水分子,導致產生的大量溶劑熵增加值 (△Ssolv)對于降低體系自由能起到了實質性的作用。同時,由于蛋白質受體和配體具有高度的構象剛性,連接過程不會發生大的骨架構象變化和側鏈的旋轉,因此只產生少量的構象熵變 (△Sconf)以及旋轉和轉換熵變(△Sr/t)降低值。產生的少量熵損失 (△Sconf+△Sr/t)很容易被蛋白質和配體間連接形成的非共價鍵導致的焓降低值抵消。總結起來,鎖-鑰匙連接過程的機理主要受溶劑的熵增加所驅動,這也證實了作為溶劑的水分子在連接過程中發揮了重要的作用。由于蛋白質和配體間高度的構象互補性是獲得大量熵增加的前提,因此鎖-鑰匙模型所描述的過程可以用來解釋連接的特異性。
3.2 誘導契合連接的機理
對于誘導契合模型,由于缺乏高度的構象互補性,蛋白質和配體表面最初的接觸釋放了相對較少的水分子數 (相對于鎖-鑰匙模型)。產生的少量溶劑熵增加值 (△Ssolv)不足以抵消構象的熵損失 (△Sconf+△Sr/t)。然而,蛋白質連接部位的高度構象柔性在適應配體時發生了大的構象調整,使蛋白質和配體之間在結合部位進行全面的接觸,形成了大量的非共價鍵。產生了足夠克服熵損耗 (△Sconf+△Sr/t)的巨大負焓變值 (△H為負),大的負焓變值對于蛋白質-配體-溶劑體系總吉布斯自由能的減少起到了實質性的作用。總結起來,誘導契合連接過程主要由大量的焓變減少驅動。由于誘導契合過程產生的大量非共價鍵作用把配體穩定在連接部位上,因此,誘導契合模型可以解釋配體連接的親和性。
3.3 構象選擇連接的機理
如前所述,構象選擇模型包含了鎖-鑰匙過程和誘導契合過程,最初的選擇連接可被近似的認為是鎖-鑰匙過程,產生了大量的溶劑熵增加值 (△Ssolv);隨后的構象調整階段在蛋白質和配體形成了廣泛的分子間接觸,形成大量的非共價鍵,產生了巨大的負焓變值 (△H為負)。熵增加值和負焓變值大大的超過了不可避免的熵損耗 (△Sconf+△Sr/t),導致了體系總的吉布斯自由能顯著降低。總結起來,構象選擇模型過程受熵增加和焓減少共同驅動,不僅可以用來解釋連接的特異性,還可以解釋連接的親和性。事實上,自然界中的大多數蛋白質都是具有構象活性的(特別是在連接部位),以能量相近但構象有差異的構象聚集體平衡形式存在。因此,選擇連接伴隨著構象調整的過程應該是進化選擇的結果,它有利于調節連接過程蛋白質-配體-溶劑體系的熱力學和動力學特征,也使得蛋白質能夠識別和連接潛在的分子以發揮生物學功能[10]。
4 結論
總的說來,蛋白質的連接過程是由蛋白質-配體-溶劑體系吉布斯自由能的降低驅動的,而體系的吉布斯自由能又是受體系熵變和焓變之間的精細平衡互補機理——熵焓互補機理決定[5,10]。作為溶劑的水混亂度增加 (熵最大化)導致蛋白質-配體-溶劑體系熵增加是蛋白質連接最初的驅動力,而隨后蛋白質-配體相互接觸并形成大量的非共價鍵導致的焓變值減少進一步驅動了連接的進行。因此,蛋白質的連接過程是由熱力學的熵焓互補機理決定的自由能降低的過程。
[1]Fischer E.Einfluss der configuration auf die wirkung der enzyme [J].Ber Dtsch Chem Ges,1894,27:2984—2993.
[2]Koshland D E J.Application of a theory of enzyme specificity to protein synthesis [J].Proc Natl Acad Sci USA,1958,44:98—104.
[3]Tobi D,Bahar I.Structural changes involved in protein binding correlate with intrinsic motions of proteins in the unbound state [J].Proceedings of the National Academy of Sciences of the United States of America,2005,102 (52):18908—18913.
[4]Bryngelson J D,Onuchic J N,Socci N D,et al.Funnels,pathways,and the energy landscape of protein folding:a synthesis [J].Proteins:Structure,Function,and Bioinformatics,1995,21 (3):167—195.
[5]Liu S Q,Xie Y H,Ji X L,et al.Protein folding,binding and energy landscape:A synthesis[M].in Protein Engineering.Rijeka:Intech,2012:207—252.
[6]Ma B,Kumar S,Tsai C J,et al.Folding funnels and binding mechanisms [J].Protein Engineering,1999,12 (9):713—720.
[7]Tsai C J,Ma B,Sham Y Y,et al.Structured disorder and conformational selection [J].Proteins:Structure,Function,and Bioinformatics,2001,44 (4):418—427.
[8]Yang LQ,Sang P,Tao Y,et al.Protein dynamics and motions in relation to their functions:several case studies and the underlying mechanisms[J].Journal of Biomolecular Structure and Dynamics,2013:1—22.
[9]Ji X L,Liu S Q.Thinking into mechanism of protein folding and molecular binding [J].J Biomol Struct Dyn,2011,28:995—996.
[10]Yang L Q,Ji X L,Liu S Q.The free energy landscape of protein folding and dynamics:a global view [J].Journal of Biomolecular Structure and Dynamics,2013:1—11.

