人溶血磷脂酸受體1基因的克隆、表達載體構建及瞬時轉染293T細胞
李鐵威 趙鵬飛 馬潔 阿拉坦高勒
人溶血磷脂酸受體1(LPAR1)是G-蛋白偶聯受體家族、EDG亞家族成員(EDG family)[1-3],LPAR1在人體正常組織中普遍表達并可在溶血磷脂酸(Lysophosphatidic Acid,LPA)的誘導下與 Gi、Gq、G12/13偶聯介導諸多的細胞生理反應,如細胞增殖、分化、血小板凝集以及在腫瘤細胞中促進細胞的能動性、遷移等生物活性[4-8]。人的LPAR1基因位于人基因的9q31.3區,CDS區長1095bp,編碼364個氨基酸形成七次疏水跨膜蛋白結構,分子量大約為 41kD[7,9-11]。LPAR1能夠感知細胞外LPA的刺激與Gi蛋白偶聯抑制cAMP的生成[9]。隨著對LPAR1介導的信號通路的深入研究發現,LPAR1可能參與細胞增殖與遷移及其相關疾病過程[3,12,13]。為進一步研究 LPAR1參與動脈硬化、腫瘤等疾病的發生、發展及遷移等問題,本研究克隆了LPAR1基因并構建表達載體,瞬時轉染細胞,檢測細胞內cAMP的積累,旨在為進一步研究溶血磷脂酸受體LPAR1的功能研究奠定基礎。
1 材料與方法
1.1 材料
1.1.1 試驗細胞及主要試劑 人胃癌細胞BGC803(本研究室保存)。限制性內切酶 BamHⅠ、XhoⅠ、DNase及T4DNA連接酶(Thermo Scientific公司);TranStart Taq DNA polymerase(北京全式金公司);總RNA提取試劑盒、膠回收試劑盒(上海生工生物有限公司);胎牛血清(Hyclone公司);DMEM高糖(Gibco公司);胰酶(Hyclone公司);脂質體LipofectamineTM2000(Invitrigen公司);DNA分子量標準(北京中科瑞泰公司)、反轉錄試劑盒(TaKaRa)、實時定量試劑盒(北京康為世紀),pCR2.1載體(Invitrogen公司);pIRES2-EGFP(Clontech);293T細胞(本研究室保存),LPA(Sigma),ISP(Isoproterenol,異丙腎上腺素,Sigma),ELISA 試劑盒(AAT Bioquest),其他試劑均為國產分析純。
1.1.2 主要儀器 PCR 儀為ABI公司產品,凝膠電泳儀和熒光定量PCR儀為Bio-Rad公司產品,熒光倒置顯微鏡為尼康公司產品。
1.2 方法
1.2.1 LPAR1基因的克隆 從人胃癌細胞BGC-803提取總RNA,以反轉錄得到的產物為模板,基因庫查找編碼人LPAR1的mRNA序列,用primer 5軟件設計引物,序列如下:上游引物P1:5'-CTCGAGATGGCTGCCATCTCTACTTC-3',下游引物P2:5'-GGATCCCTAAACCACAGAGTGGTCATTG-3'(上海生工生物有限公司合成),其中下劃線為XhoⅠ和BamHⅠ酶切位點;擴增長度1107bp。PCR 反應體系 :上游引物(10μmol/L)1.5μL,下游引物(10μmol/L)1.5μL,雙蒸水 31.5μL,10×GC Enhance 5μL,dNTPs(各 2.5mmol/L)4μL,10×TranStart Taq Buffer 5μL,TranStart Taq DNA polymerase 0.5μL,模板 1μL。反應條件 :94℃預變性5min;94℃變性 30s,58℃退火 30s,72℃延伸 60s,30個循環;最后再于72℃延伸10min。擴增產物進行瓊脂糖凝膠電泳,純化回收 PCR產物,回收產物與pCR2.1載體連接,連接產物轉化DH5α大腸桿菌感受態細胞,藍白斑篩選陽性(pCR2.1-LPAR1)克隆,送測序。
1.2.2 構建表達載體 用XhoⅠ、BamHⅠ雙酶切pCR2.1-LPAR1與pIRES2-EGFP載體,酶切產物回收后用T4 DNA連接酶在16℃連接過夜,連接產物轉化DH5α大腸桿菌感受態細胞,挑取陽性克隆PCR鑒定,送測序。
1.2.3 瞬時轉染293T細胞 293T細胞培養在含10%胎牛血清的DMEM培養基中,胰酶消化制成單細胞懸液,以 2×105個/孔接種于6孔板。提取并純化pIRES2-EGFP-LPAR1和pIRES2-EGFP質粒,用NanoDrop 核酸蛋白測定儀nd1000測定質粒濃度和純度,分別轉染293T細胞。24h后觀察熒光照相,36h提取細胞總RNA。
1.2.4 實時定量PCR檢測目的基因的表達 收集未轉染及轉染上述2種質粒的293T細胞,用總RNA提取試劑盒提取各組細胞的總RNA,再用DNA酶Ⅰ去除RNA中可能殘余的基因組DNA,NanoDrop核酸蛋白測定儀nd1000檢測濃度。用反轉錄試劑盒反轉錄成cDNA。GoldStar TaqMan Mixture 康為世紀試劑盒用來實時定量PCR檢測目的基因在各組細胞中的表達。所用引物如下:LPAR1基因檢測引物,上游引物:5'-CGTCAGGGCCTCATTGACA-3',下游引物:5'-GTGCCTCTCGATTGCAATAGC-3',LPAR1基因探針序列:5'-CCTGACGGCATCTGTGGCCAACTTA-3';以GAPDH基因為內參,上游引物:5'-CCAGGTGGTCTCCTCTGACTTC-3',下游引物5'-GTGGTCGTTGAGGGCAATG-3',GAPDH基因 探 針 序 列:5'-ACAGCGACACCCACTCCTCCACCTT-3';反應體系:2×GoldStar TaqMan Mixture 25μL, 上 下 游 引 物(10μmol/L)各 1μL,探針(Probe)1μL,DNA 模板 2μL,RNase-Free Water 20μL,共 50μL。反應條件 :95℃預變性10min;95℃變性15s,60℃(LPAR1)和60℃(GAPDH)退火1min,循環39次;每個反應有3次重復。
1.2.5 ELISA檢測LPA刺激下的cAMP含量 用ELISA試劑盒所給cAMP標準品制作標準曲線,LPA和ISP刺激轉染空載體(pIRES2-EGFP)和插入LPAR1基因載體(pIRES2-EGFP-LPAR1)的細胞4min然后用1mol/L HCl終止反應;裂解細胞收集胞內cAMP。用ELISA試劑盒在熒光激發波長540nm和發射波長590nm處檢測LPA和ISP刺激下胞內cAMP的積累量。
1.2.6 統計學分析 采用GraphPad Prism 5統計學軟件one-way ANOVA進行數據處理分析。
2 結果
2.1 LPAR1編碼區片段的克隆與序列測定
用引物P1、P2以 cDNA為模板擴增得到與預期片段大小相符的特異性片段(圖1)。回收的PCR產物與pCR2.1載體連接成的重組質粒pCR2.1-LPAR1經酶切鑒定正確(圖2)。序列測定結果表明,擴增出的cDNA片段長1107bp,與已知的NCBI 基因庫中人LPAR1(NM_001401)序列完全一致。

圖1 LPAR1的PCR瓊脂糖電泳結果
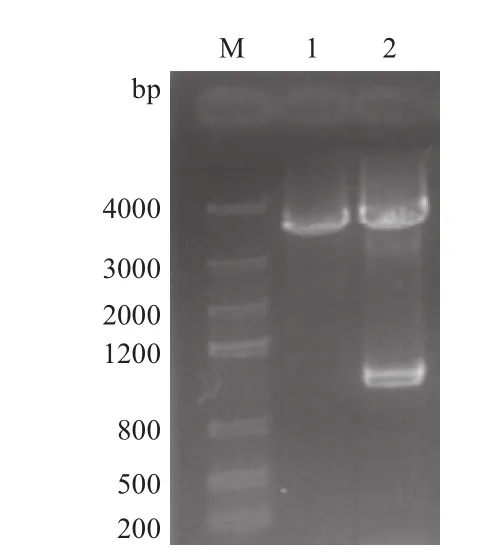
圖2 pCR2.1-LPAR1酶切鑒定電泳結果
2.2 表達載體pIRES2-EGFP-LPAR1的構建
獲得的重組質粒pCR2.1-LPAR1和表達載體質粒 pIRES2-EGFP 經 XhoⅠ+BamHⅠ雙酶切(圖 3),再將LPAR1(1107bp)片段與pIRES2-EGFP酶切產物連接,得到的表達載體pIRES2-EGFP-LPAR1,經XhoⅠ+BamHⅠ雙酶切pIRES2-EGFP及pIRES2-EGFP-LPAR1鑒定與預期序列大小相符。

圖3 pIRES2-EGFP-LPAR1酶切鑒定電泳結果
2.3 轉LPAR1基因293T細胞檢測
pIRES2-EGFP-LPAR1 轉染293T細胞24h后觀察熒光(圖4),統計陽性細胞,轉染率約為61%。

圖4 轉染24h后觀察圖(100×)
2.4 實時定量PCR檢測LPAR1基因在293T細胞中的表達
LPAR1基因的表達檢測,分別提取未轉染細胞、轉染空載體(pIRES2-EGFP)的細胞和轉染插入LPAR1片段載體的細胞中總RNA并去除其中的基因組DNA,反轉錄成cDNA后,以實時定量PCR法檢測LPAR1基因的表達,檢測到LPAR1基因表達水平顯著提高,與未轉染的細胞比較mRNA 表達提高71倍(圖5)。
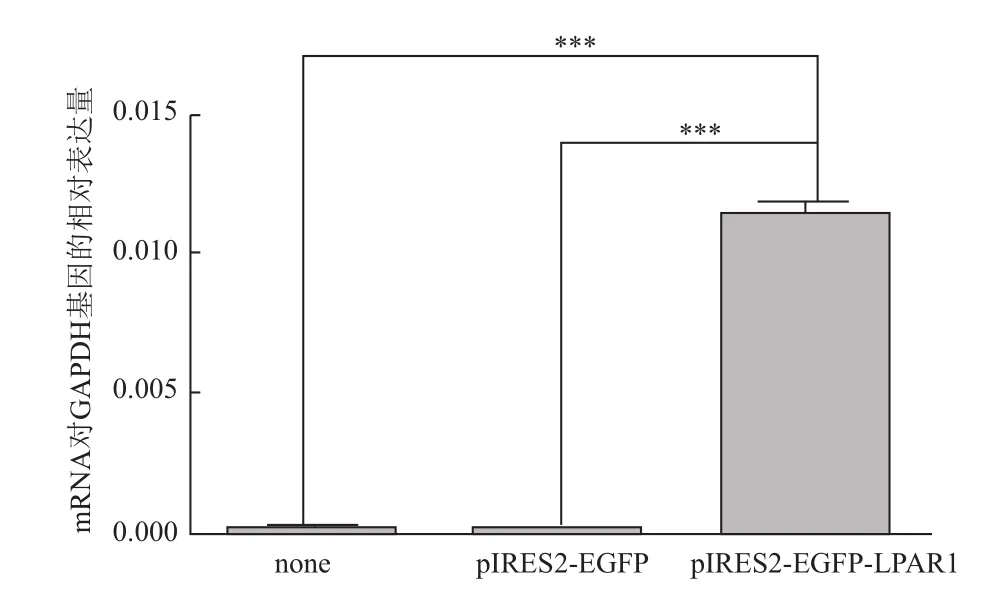
圖5 pIRES2-EGFP-LPAR1轉染后的293T細胞中LPAR1基因相對表達量檢測
2.5 ELISA檢測轉基因細胞的cAMP含量
cAMP的檢測用10μmol/L LPA分別刺激轉染空載體(pIRES2-EGFP)的細胞和轉染插入LPAR1基因片段載體后的細胞并用1mol/L HCl終止反應,裂解細胞收集細胞裂解液,用ELISA試劑盒檢測cAMP的含量,檢測到轉染LPAR1基因的細胞cAMP降低(與轉染空載體的細胞比較)(圖6)。ISP(Isoproterenol,異丙腎上腺素)能夠刺激促進cAMP的產生,在1μmol/L ISP的存在下混以不同濃度的LPA刺激轉染LPAR1基因的細胞,檢測到胞內cAMP的積累量隨著LPA濃度的升高而降低(圖7)。

圖6 LPA刺激轉染pIRES2-EGFP-LPAR1后的293T細胞中cAMP表達量檢測
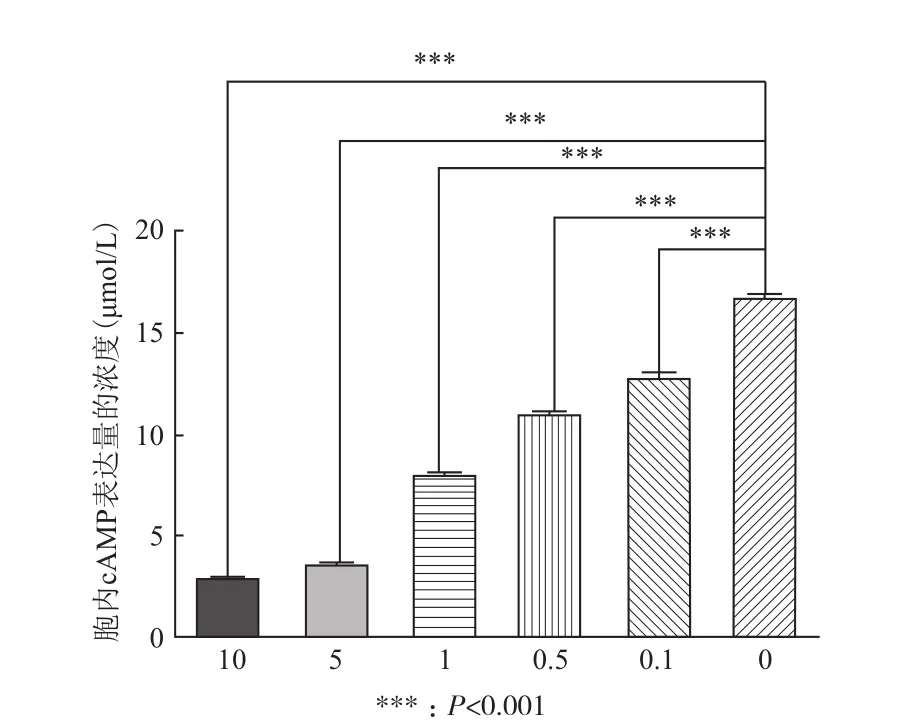
圖7 LPAR1轉基因細胞中不同濃度LPA刺激后cAMP含量檢測
3 討論
LPA是在血漿、血清、組織液及腦組織等體液與組織中廣泛存在的生理活性磷脂小分子[14],在體內有著廣泛的生物學作用,如,細胞增殖、細胞運動等;同時,LPA通過LPAR1與結腸癌、乳腺癌、胰腺癌、動脈粥樣硬化、神經性疼痛等疾病密切相關[13,15-19]。LPA 通過 LPAR1偶聯 Gi蛋白的信號通路抑制 cAMP 的產生[4,7,16]。為了詳細研究人溶血磷脂酸受體LPAR1的功能以及其介導的細胞內信號轉導通路,本試驗克隆了人的LPAR1基因以及構建真核表達載體質粒pIRES2-EGFP-LPAR1,用脂質體介導瞬時轉染293T細胞,發現293T細胞具有極低量的LPAR1基礎表達。轉染pIRES2-EGFPLPAR1后,293T細胞的LPAR1mRNA表達提高71倍(與未轉染的細胞比較)。通過檢測LPA刺激轉染pIRES2-EGFP-LPAR1的細胞cAMP的含量,發現轉染pIRES2-EGFP-LPAR1的細胞cAMP的含量低于轉染空載體(pIRES2-EGFP)的細胞,證實了該轉基因細胞成功表達了活性的LPAR1蛋白,能夠滿足于進一步的試驗需要。又通過在1μmol/L ISP(Isoproterenol)和濃度梯度的LPA共刺激LPAR1轉基因細胞發現LPA可以劑量依賴性的抑制cAMP的形成,且存在著線性關系。
本研究采用瞬時轉染LPAR1基因,獲得約為61%的轉染細胞,此時細胞基因表達相比未轉染的細胞便高出71倍,說明本試驗成功構建得到LPAR1基因的真核表達質粒;此外當細胞群中有61%的細胞高表達LPAR1時細胞應答所造成的差異便具有很高的顯著性,而實際當所有細胞均高表達LPAR1時所造成的差異應該比此更加明顯。Gerrard等[20]研究發現,在激活血小板的過程中檢測到多種分子形態的LPA分子,酰基烴鏈的C原子數和脂肪酸的飽和度不同使LPA具有不同的分子結構。隨后研究發現不同分子形態的LPA活化LPAR1受體的能力不同且在一定程度上存在著拮抗效應,其共同作用發揮其所介導的下游信號通路功能[21],因此通過普通的方法檢測活化LPAR1受體的LPA濃度存在一定的難度,需要進一步的深入研究。
4 結論
克隆LPAR1基因并構建LPAR1基因的真核表達質粒pIRES2-EGFP-LPAR1,瞬時轉染293T細胞獲得LPAR1轉基因細胞模型,LPAR1基因得以高表達。此外LPAR1被激活后能強烈抑制由ISP誘導的cAMP積累,其作用具有LPA劑量依賴性。
[1]Barber SC, Mellor H, Gampel A, et al. S1P and LPA trigger Schwann cell actin changes and migration[J]. Eur J Neurosci, 2004, 19(12):3142-3150.
[2]Okabe K, Hayashi M, Fujii M, et al. Mutations of lysophosphatidic acid receptor genes in human osteosarcoma cells[J]. Pathobiology,2010, 77(5):278-282.
[3]Kato K, Fukui R, Okabe K, et al. Constitutively active lysophosphatidic acid receptor-1enhances the induction of matrix metalloproteinase-2[J]. Biochem Biophys Res Commun, 2012, 417(2):790-793.
[4]Hayashi M, Okabe K, Kato K, et al. Differential function of lysophosphatidic acid receptors in cell proliferation and migration of neuroblastoma cells[J]. Cancer Lett, 2012, 316(1):91-96.
[5]Kato K, Yoshikawa K, Tanabe E, et al. Opposite roles of LPA(1)and LPA(3)on cell motile and invasive activities of pancreatic cancer cells[J]. Tumour Biol, 2012, 33:1739-1744.
[6]Marshall JC, Collins JW, Nakayama J, et al. Effect of inhibition of the lysophosphatidic acid receptor 1 on metastasis and metastatic dormancy in breast cancer[J]. J Natl Cancer Inst, 2012, 104(17):1306-1319.
[7]Anliker B, Chun J. Lysophospholipid G protein-coupled receptors[J]. J Biol Chem, 2004, 279:20555-20558.
[8]Shida D, Kitayama J, Yamaguchi H, et al. Dual mode regulation of migration by lysophosphatidic acid in human gastric cancer cells[J]. Exp Cell Res, 2004, 301(2):168-178.
[9]Hecht JH, Weiner JA, Post SR, et al. Ventricular zone gene-1(vzg-1)encodes a lysophosphatidic acid receptor expressed in neurogenic regions of the developing cerebral cortex[J]. J Cell Biol, 1996,135(4):1071-1083.
[10]Contos JJ, Ishii I, Chun J. Lysophosphatidic acid receptors[J].Mol Pharmacol, 2000, 58(6):1188-1196.
[11]An S, Dickens MA, Bleu T, et al. Molecular cloning of the human Edg2 protein and its identification as a functional cellular receptor for lysophosphatidic acid[J]. Biochem Biophys Res Commun,1997, 231(3):619-622.
[12]Ward Y, Lake R, Yin JJ, et al. LPA receptor heterodimerizes with CD97 to amplify LPA-initiated RHO-dependent signaling and invasion in prostate cancer cells[J]. Cancer Res, 2011, 71:7301-7311.
[13]Lin ME, Herr DR, Chun J. Lysophosphatidic acid(LPA)receptors:signaling properties and disease relevance[J]. Prostaglandins &Other Lipid Mediators, 2010, 91(3-4):130-138.
[14]Saulnier-Blache JS. Lysophosphatidic acid :a “bioactive”phospholipid[J]. Medecine Sciences:M/S, 2004, 20:799-803.
[15]Blaho VA, Hla T. Regulation of mammalian physiology,development, and disease by the sphingosine 1-phosphate and lysophosphatidic acid receptors[J]. Chemical Reviews, 2011,111:6299-6320.
[16]Harma V, Knuuttila M, Virtanen J, et al. Lysophosphatidic acid and sphingosine-1-phosphate promote morphogenesis and block invasion of prostate cancer cells in three-dimensional organotypic models[J]. Oncogene, 2012, 31:2075-2089.
[17]Matsumoto T, Kobayashi T, Kamata K. Role of lysophosphatidylcholine(LPC)in atherosclerosis[J]. Current Medicinal Chemistry,2007, 14(30):3209-3220.
[18]Meyer zu Heringdorf D, Jakobs KH. Lysophospholipid receptors:signalling, pharmacology and regulation by lysophospholipid metabolism[J]. Biochim Biophys Acta, 2007, 1768(4):923-940.
[19]Kitayoshi M, Fukui R, Tanabe E, et al. Different effects on cell proliferation and migration abilities of endothelial cells by LPA1and LPA3in mammary tumor FM3A cells[J]. Journal of Receptor and Signal Transduction Research, 2012, 32(4):209-213.
[20]Gerrard JM, Robinson P. Identification of the molecular species of lysophosphatidic acid produced when platelets are stimulated by thrombin[J]. Biochim Biophys Acta, 1989, 1001(3):282-285.
[21]Bandoh K, Aoki J, Taira A, et al. Lysophosphatidic acid(LPA)receptors of the EDG family are differentially activated by LPA species. Structure-activity relationship of cloned LPA receptors[J]. FEBS Letters, 2000, 478(1-2):159-165.

